本文作者:石油醚
概要
Ohyun Kwon,加州大学洛杉矶分校化学系教授,有机化学家,JCCC中心研究员。课题组主页:https://www.thekwonlab.net/
经历
- 1987年-1991年 首尔大学获得学士学位
- 1991年-1993年 首尔大学获得硕士学位
- 1993年-1994年 耶鲁大学获得硕士学位
- 1994年-1998年 哥伦比亚大学获得博士学位(Professor S. J. Danishefsky)
- 1998年-2001年 哈佛大学博士后
- 2001年-2008年 加州大学洛杉矶分校化学系讲师
- 2008年-2013年 加州大学洛杉矶分校化学系副教授
- 2008年-至今 加州大学洛杉矶分校化学系教授
获奖经历
- 2003 Amgen Young Investigator’s Award
- 2004 Faculty Career Development Award, UCLA
- 2005 Thieme Journal Award, Synthesis and Synlett
- 2005 Faculty Career Development Award, UCLA
- 2008 Glenn T. Seaborg Award
- 2008 Abbott Lecture, University of Notre Dame
- 2018 Boehringer Ingelheim Green Chemistry Award
- 2018 UC CAI Technology Development Award
- 2019 Novartis Chemistry Lectureship Award
研究方向
Kwon 教授目前主要研究的兴趣是新的有机方法应用于合成转化,不对称催化,手性催化剂的设计,具有重要生物活性的天然化合物的目标导向合成(TOS),天然产物类分子的多样性定向合成(DOS)等方面,研究并开发生物学上重要的过程并应用于分子的构建。
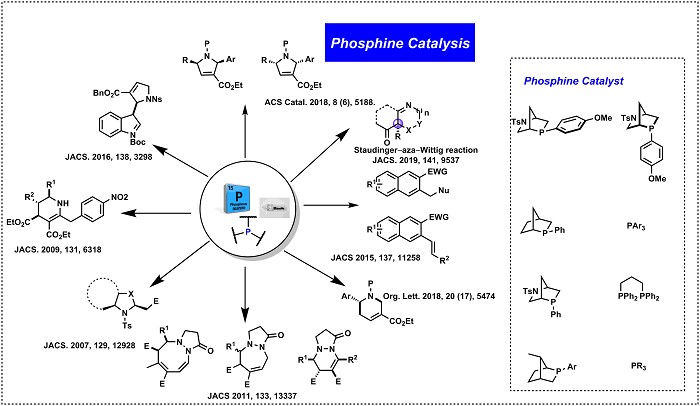
1. 新反应的发展–膦催化
简单有机分子催化(与过渡金属催化反应相比)近年来引起了学术界和工业界的广泛关注。Kwon 教授在有机催化这一领域的贡献是有机膦催化的发展。开发的膦催化剂结构简单,易于操作,仅需要催化量的膦作为试剂以及在反应后仅需要简单操作就可以获得优异的收率的所需产物1-3。 迄今为止,已经开发了超过二十种新的膦催化的反应,如[3+2]环加成4,
ɑ-Umpolung–Aldol 反应5,Staudinger–aza-Wittig 反应6,[4 + 2]环加成7,[3+3]环加成4,8,
[4+3]环加成,γ-umpolung–Wittig Olefination9,不对称催化合成吡咯类化合物10,11,[3+2+3]环加成4等。(Fig.1)Figure 1新反应的发展-膦催化
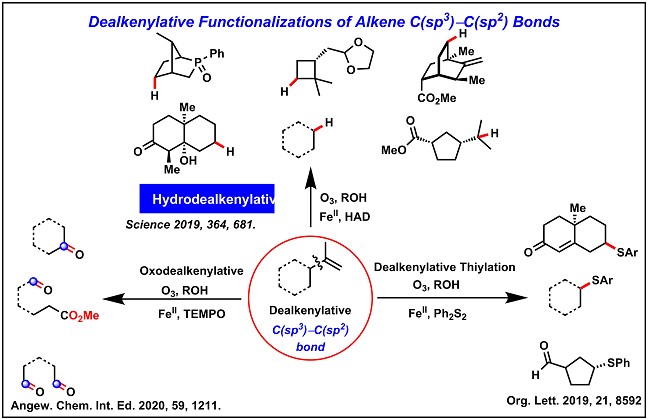
2. 烯烃C(sp3)-C(sp2)键的脱烯基官能化
在Kwon 小组中,最近的一个重点是烯烃C(sp3)-C(sp2)键的活化12-14,这种活化通常存在于丰富的植物萜烯和萜烯衍生物的天然产物中。烯烃C(sp3)-C(sp2)键的脱烯基官能化已经在全合成和生物相关分子的快速合成中得到应用,极大的缩短了合成步骤以及收率最佳。未来的工作包括开发各种类似于脱烯基官能化的方法以及为这类型的转化设计可持续的催化方法。(Fig.2)
Figure 2烯烃C(sp3)-C(sp2)键的脱烯基官能化
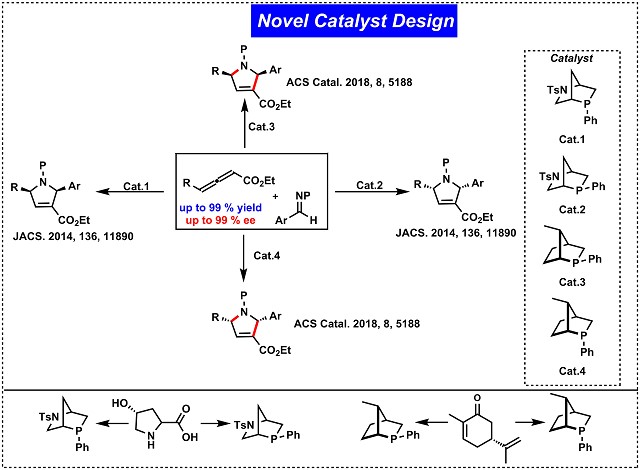
3. 新催化剂的设计
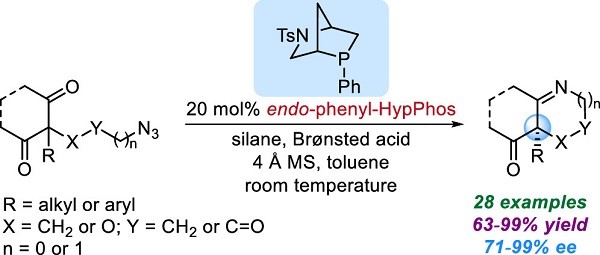
目前用于膦催化的手性膦大多是开发用于过渡金属催化的配体。手性膦在不对称催化中起着重要作用。这些手性配体通常分为三种设计原型:1)具有立体磷中心的膦(例如,DIPAMP);2)具有轴向手性的膦(例如,BINAP);3)具有碳立体中心的膦(例如,DuPhos ,DIOP)。尽管同时具有碳和磷立构中心的膦在不对称催化中特别有用,但仍缺乏有效的方法来生产C-手性膦和P-手性膦的特定对映体。根据这一原理,Kwon小组开发了一个新的L-羟脯氨酸(Hyp)10和香芹酮1衍生的[2.2.1]双环膦催化剂家族(已被Sigma-Aldrich获得专利权)。这些催化剂已显示出巨大的合成作用并证明刚性[2.2.1]双环骨架的催化潜力。目前正在探索以其他天然产物为起点来开发新的手性膦家族,用来促进不对称催化的发展(Fig.3)。
Figure 3新催化剂的设计
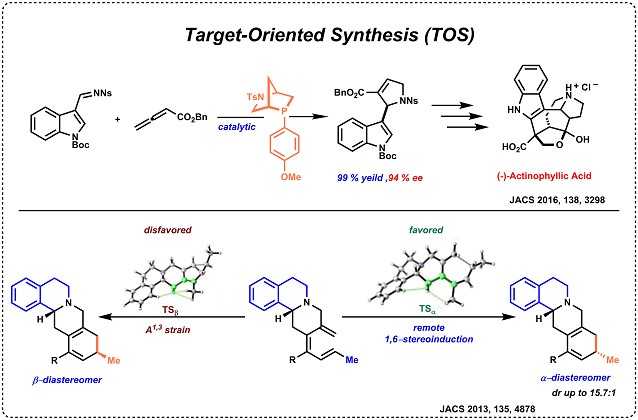
4. 天然产物的目标导向合成(TOS)2,15
Kwon 教授实验室研究的主题之一是膦催化的联烯酸酯的开发及其在天然产物以及具有医学价值的非天然类似物的化学合成中的应用。Kwon 小组合成目标与人类健康高度相关,特别是普通感冒,高血压,疟疾,心律不齐和癌症等方面的治疗。 下面介绍的是在生物学上具有高活性的天然产物合成中的一些应用。(Fig.4)
Figure 4天然产物的目标导向合成(TOS)
5. 多样性合成(DOS)和化学生物学的应用
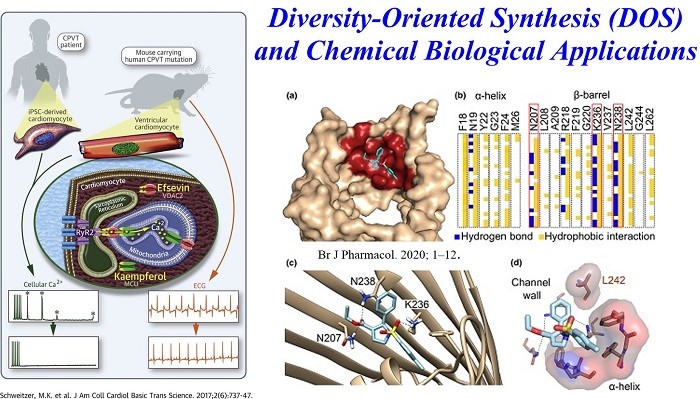
Kwon 小组另外一个研究领域是面向有机小分子库的多样性合成及其在化学生物学方面的应用。在化学遗传学方法中,针对所需的生物学效应系统地筛选有机小分子以及使用鉴定出的有机小分子来调节其靶蛋白的细胞功能,从而阐明生物学上重要过程的分子机制。Kwon 小组与生物学家合作在化学遗传研究中发现了几种酶抑制剂16,其中一种酶抑制剂已获得抗癌治疗药物开发的专利。最近,另一种被称为“ efsevin”的小分子通过调节电压依赖性的阴离子通道 2(VDAC2)来调节线粒体Ca2 +的摄取17,被证明是一种有效的心律调节因子以及它在人类心脏病的啮齿动物模型中显示出对室性心律过快的预防作用(Fig.5)。
Figure 5多样性合成(DOS)和化学生物学的应用
其他
Chem-station:“手性磷催化3-叠氮丙基茚二酮的不对称Staudinger-aza-Wittig反应 ”介绍。
Catalytic Asymmetric Staudinger−aza-Wittig Reaction for the Synthesis of Heterocyclic Amines
Cai, L.; Zhang, K.; Chen, S.; Lepage, R. J.; Houk, K. N.; Krenske, E. H.; Kwon, O. *
参考文献
- [1] Smaligo, A. J., Vardhineedi, S. & Kwon, O.Carvone-Derived P-Stereogenic Phosphines: Design, Synthesis, and Use in Allene–Imine [3 + 2] Annulation. ACS. Catal. (2018) 8, 5188-5192, doi:10.1021/acscatal.8b01081.
- [2] Cai, L., Zhang, K. & Kwon, O.Catalytic Asymmetric Total Synthesis of (−)-Actinophyllic Acid. J. Am. Chem. Soc. (2016) 138, 3298-3301, doi:10.1021/jacs.6b00567.
- [3] Zhang, K., Cai, L., Jiang, X., Garcia-Garibay, M. A. & Kwon, O.Phosphine-Mediated Iterative Arene Homologation Using Allenes. J. Am. Chem. Soc. (2015) 137, 11258-11261, doi:10.1021/jacs.5b07403.
- [4] Na, R. et al.Phosphine-Catalyzed Annulations of Azomethine Imines: Allene-Dependent [3 + 2], [3 + 3], [4 + 3], and [3 + 2 + 3] Pathways. J. Am. Chem. Soc. (2011) 133, 13337-13348, doi:10.1021/ja200231v.
- [5] Zhang, K., Cai, L., Hong, S. & Kwon, O.Phosphine-Catalyzed α-Umpolung–Aldol Reaction for the Synthesis of Benzo[b]azapin-3-ones. Org. Lett. (2019) 21, 5143-5146, doi:10.1021/acs.orglett.9b01749.
- [6] Cai, L. et al.Catalytic Asymmetric Staudinger-aza-Wittig Reaction for the Synthesis of Heterocyclic Amines. J. Am. Chem. Soc. (2019) 141, 9537-9542, doi:10.1021/jacs.9b04803.
- [7] Xu, Q. et al.Catalytic Enantioselective Synthesis of Guvacine Derivatives through [4 + 2] Annulations of Imines with α-Methylallenoates. Org. Lett. (2018) 20, 6089-6093, doi:10.1021/acs.orglett.8b02489.
- [8] Guo, H., Xu, Q. & Kwon, O.Phosphine-Promoted [3 + 3] Annulations of Aziridines With Allenoates: Facile Entry Into Highly Functionalized Tetrahydropyridines. J. Am. Chem. Soc. (2009) 131, 6318-6319, doi:10.1021/ja8097349.
- [9] Zhang, K., Cai, L., Yang, Z., Houk, K. N. & Kwon, O.Bridged [2.2.1] bicyclic phosphine oxide facilitates catalytic γ-umpolung addition–Wittig olefination. Chem. Sci. (2018) 9, 1867-1872, doi:10.1039/C7SC04381C.
- [10] Henry, C. E. et al.Hydroxyproline-Derived Pseudoenantiomeric [2.2.1] Bicyclic Phosphines: Asymmetric Synthesis of (+)- and (−)-Pyrrolines. J. Am. Chem. Soc. (2014) 136, 11890-11893, doi:10.1021/ja505592h.
- [11] Sriramurthy, V., Barcan, G. A. & Kwon, O.Bisphosphine-Catalyzed Mixed Double-Michael Reactions: Asymmetric Synthesis of Oxazolidines, Thiazolidines, and Pyrrolidines. J. Am. Chem. Soc. (2007) 129, 12928-12929, doi:10.1021/ja073754n.
- [12] Smaligo, A. J. & Kwon, O.Dealkenylative Thiylation of C(sp3)–C(sp2) Bonds. Org. Lett. (2019) 21, 8592-8597, doi:10.1021/acs.orglett.9b03186.
- [13] Smaligo, A. J. et al. Oxodealkenylative Cleavage of Alkene C(sp3)−C(sp2) Bonds: A Practical Method for Introducing Carbonyls into Chiral Pool Materials. Angew. Chem. Int. Ed. (2020) 59, 1211-1215, doi:10.1002/anie.201913201.
- [14] Smaligo, A. J. et al.Hydrodealkenylative C(sp3)−C(sp2) bond fragmentation. Science. (2019) 364, 681-685, doi:10.1126/science.aaw4212
- [15] Patel, A., Barcan, G. A., Kwon, O. & Houk, K. N.Origins of 1,6-Stereoinduction in Torquoselective 6π Electrocyclizations. J. Am. Chem. Soc. (2013) 135, 4878-4883, doi:10.1021/ja400882y.
- [16] Wilting, F. et al.The antiarrhythmic compound efsevin directly modulates voltage-dependent anion channel 2 by binding to its inner wall and enhancing mitochondrial Ca2+ uptake. British Journal of Pharmacology (2020) 1-5, doi:10.1111/bph.15022.
- [17] Schweitzer, M. K. et al.Suppression of Arrhythmia by Enhancing Mitochondrial Ca2+ Uptake in Catecholaminergic Ventricular Tachycardia Models. JACC: Basic to Translational Science. (2017) 2, 737-747, doi:10.1016/j.jacbts.2017.06.008
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!




























No comments yet.