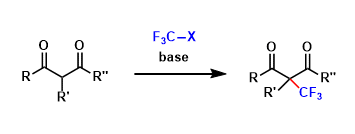
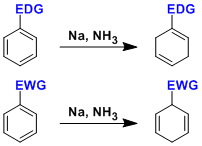
卤代化合物→芳香化合物,烷烃,烯烃
- 概要
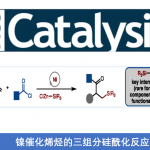
芳基卤代物・芳基三氟甲磺酸酯和Grignard试剂之前的用镍或钯催化剂的交叉偶联反应。
生成sp2碳-碳键的反应,就是所谓的”交叉偶联”反应的先驱,此反应在实用和学术双方面都是一个重要的里程碑。
操作简单,而且该反应使用廉价镍,实用性也很高。另一方面,相对于使用钯催化剂,镍的反应性更温和,而且化学选择性也更好。
但是,当然该反应不能应用于含有能与格式试剂反应的官能团的底物上。
利用锌以及其转移金属化后的相对低反应活性的有机锌试剂(根岸交叉偶联),或者用Fe(III)催化剂(Kochi-Fustner交叉偶联)替代Ni・Pd,有时可以解决上述问题。
- 基本文献
・Tamao, K.; Sumitani, K.; Kumada, M. J. Am. Chem. Soc. 1972, 94, 4374. DOI: 10.1021/ja00767a075
・Corriu, R. J. P.; Massse, J. P. J. Chem. Soc., Chem. Commun. 1972, 144. DOI: 10.1039/C3972000144a
・Yamamura, M.; Moritani, I.; Murahashi, S. J. Organomet. Chem. 1975, 91, C39. DOI: 10.1016/S0022-328X(00)89636-9
・Tamao, K.; Kumada, M. et al. Bull, Chem. Soc. Jpn. 1976. 49, 1958. doi:10.1246/bcsj.49.1958
- 反应机理
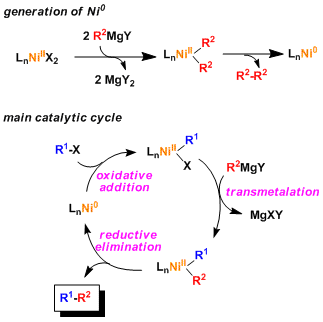
首先通过Grignard试剂的自偶联,形成0价的Ni或者Pd. 然后卤代芳烃经过氧化加成。接着经历和格式试剂的金属转移→还原消除,完成整个催化循环。
- 反应实例
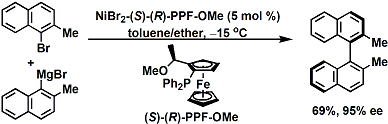
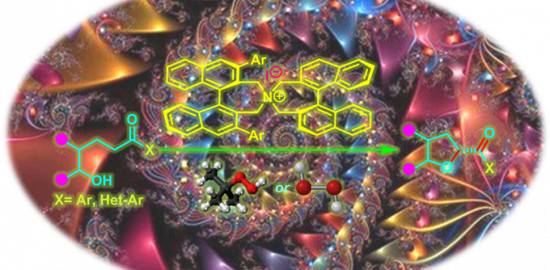
不对称熊田交叉偶联的例子[1]
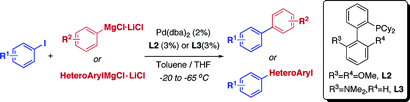
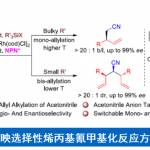
使用Mg金属配体的具有官能团耐受性熊田交叉偶联[2]
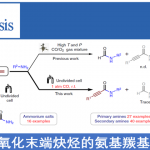
氟代芳烃的熊田交叉偶联[3]
- 实验步骤
- 实验技巧
- 参考文献
[2] Martin, R.; Buchwald, S. L. J. Am. Chem. Soc. 2007, 129, 3844. doi:10.1021/ja070830d
[3] Yoshikai, N.; Mashima, H.; Nakamura, E. J. Am. Chem. Soc. 2005, 127, 17978. DOI: 10.1021/ja056327n