本文作者:自由基先生
导读:
近日,美国Ohio州立大学的D. A. Nagib课题组在Science中发表论文,报道一种全新的将醛转化为具有电子多样性的metal carbenoid的全新策略,进而能够有效地完成对一系列非稳定化carbene反应活性的深入研究。
Carbene reactivity from alkyl and aryl aldehydes, W. M. Amberg, E. M. Carreira, Science. 2022, 377, 649. doi: 10.1126/science.abo6443.
正文:
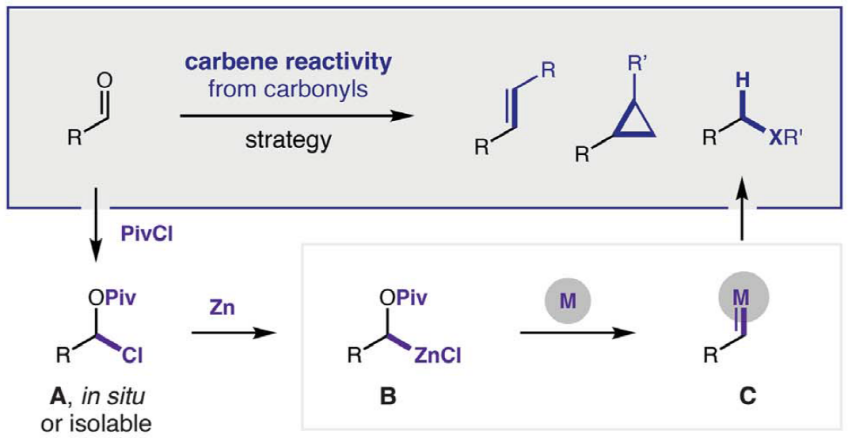
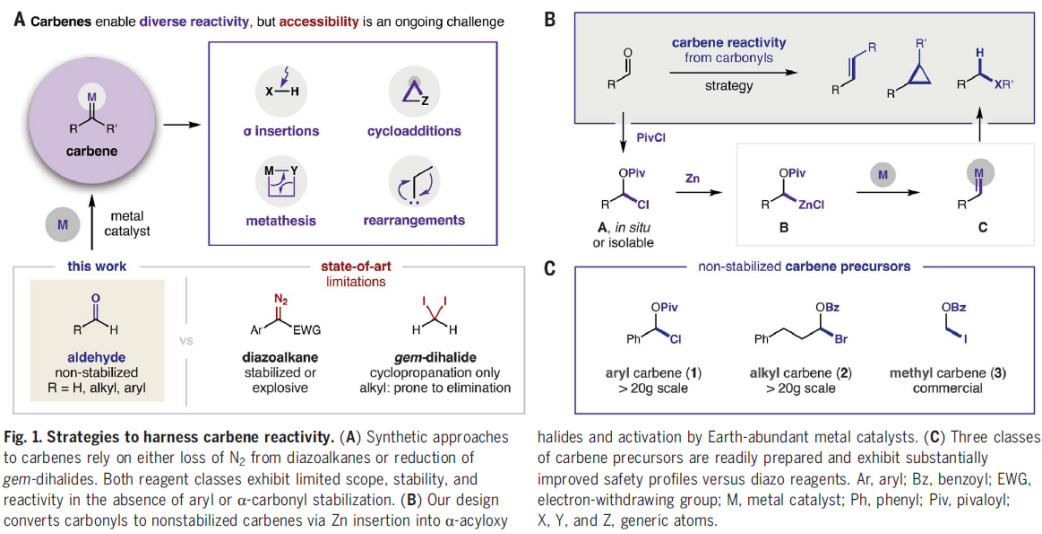
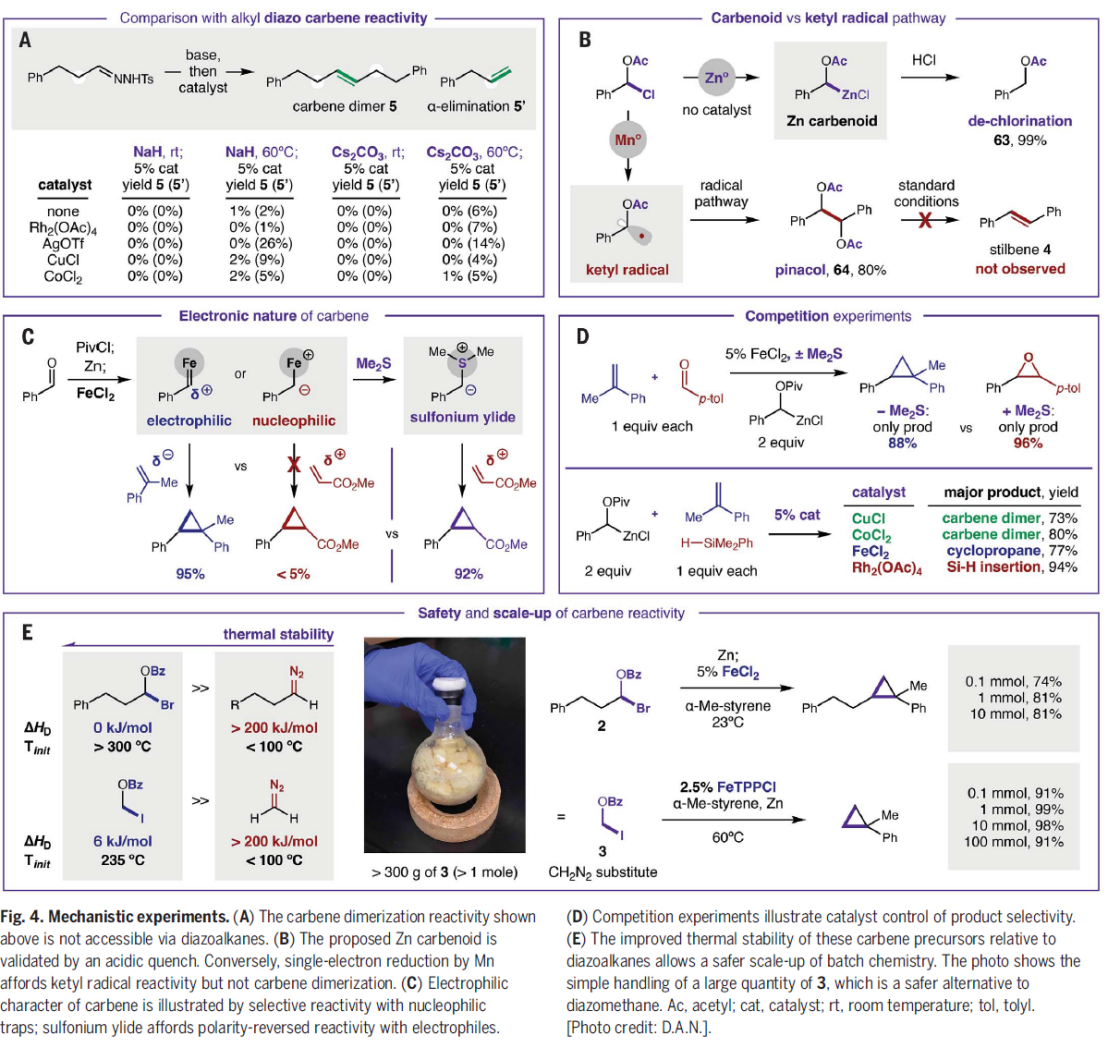
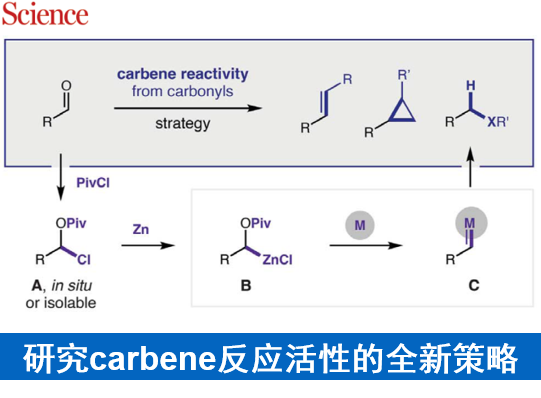
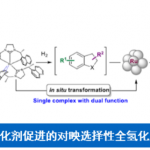
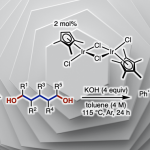
作为重要的合成中间体,carbene已经广泛应用于多种不同类型的有机合成转化反应方法学研究 (Fig. 1A)[1]-[5]。这里,受到经典的Clemmensen还原[6],乙酰氯与羰基化合物之间通过加成反应过程,形成稳定的α-乙酰氧基卤[7a]以及本课题组前期对于乙酰碘与羰基化合物之间通过电子与原子转移机理形成羰基自由基负离子相关研究报道[7]的启发,D. A. Nagib团队成功设计出一种全新的采用PivCl与醛形成的非稳定化carbene前体 A,在金属锌的作用下,获得具有电子多样性 (electronically diverse) metal carbenoid的反应策略 (Fig. 1B-C),进而能够有效地完成对一系列非稳定化carbene反应活性的深入研究。
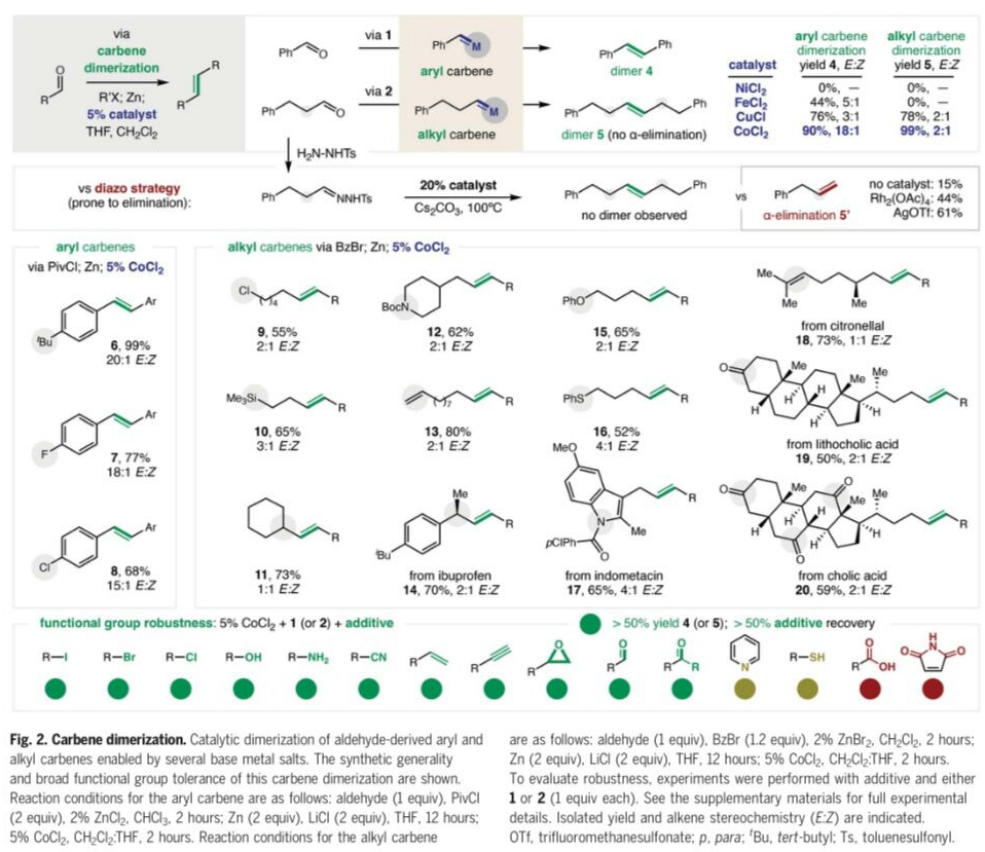
基于上述策略,作者分别对通过芳基醛与烷基醛形成的metal carbenoid的二聚反应进行深入研究 (Fig. 2)。
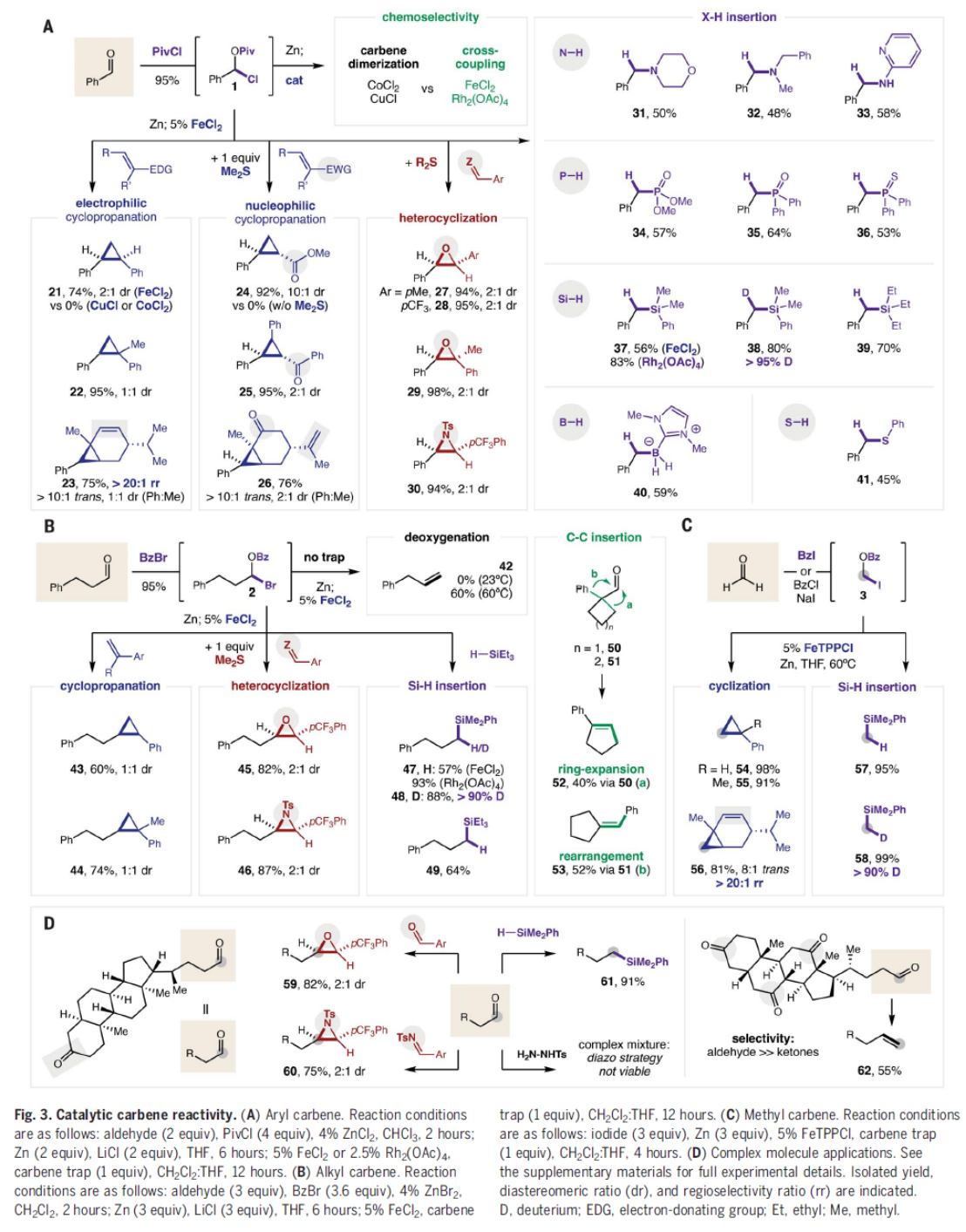
之后,该小组进一步对上述metal carbenoid参与的合成转化过程进行更为系统地研究 (Fig. 3)。
接下来,该小组通过一系列实验 (主要涉及中间体表征、反应活性比较以及动力学数据),对上述通过metal carbenoid参与的合成转化过程的反应机理进行初步研究 (Fig. 4)。首先,作者通过对上述实验中选择的各类不同的碱 (NaH, Cs2CO3)、反应温度 (0° to 100°C)以及不同催化剂的相关研究表明,上述carbene参与的二聚反应过程中并未涉及重氮烷中间体 (Fig. 4A)。同时,作者通过在HCl存在下进行的protodechlorination 反应过程,进而证实zinc carbenoid的存在 (Fig. 4B)。之后,作者进一步发现,上述的metal carbenoid中间体在反应过程中表现出较为显著的亲电性 (Fig. 4C)。然而,在加入硫醚试剂之后,通过sulfonium ylide的形成,却能够使上述的亲电反应活性发生翻转。同时,作者通过后续的竞争实验 (Fig. 4D)进一步支持这一结论。而且,研究发现,金属催化剂同样能够有效地控制反应过程中的化学选择性。接下来,该小组通过原位红外光谱以及VTNA (variable time normalization analysis) [8]的相关研究表明,上述的催化二聚过程属于动力学二级反应 (see supplementary materials)。并且,由于上述metal carbenoid中间体的形成过程,无需N2释放的推动,因此这类carbene前体的热稳定性显著高于相应的重氮烷类carbene前体 (Fig. 4E)。同时,该小组通过克级规模实验的研究表明,这一全新的metal carbenoid形成策略具有良好的实验操作安全性。
总结:
美国Ohio 州立大学的D. A. Nagib团队成功设计出一种全新的将醛转化为具有电子多样性的metal carbenoid的反应策略,进而能够有效地完成对一系列非稳定化carbene反应活性的深入研究。同时,这一策略具有良好的实验操作安全性与潜在的合成应用价值。
参考文献:
- [1] M. S. Sanford, J. A. Love, R. H. Grubbs, J. Am. Chem. Soc. 2001, 123, 6543. doi: 10.1021/ja010624k.
- [2] S.P. Green, K. M. Wheelhouse, A. D. Payne, J. P. Hallett, P. W. Miller, J. A. Bull. Org. Process Res. Dev. 2020, 24, 67. doi: 10.1021/acs.oprd.9b00422.
- [3] K. Liao, S. Negretti, D. G. Musaev, J. Bacsa, H. M. L. Davies, Nature, 2016, 533, 230. doi: 10.1038/nature17651.
- [4] D. Zhu, L. Chen, H. Fan, Q. Yao, S. Zhu, Chem. Soc. Rev. 2020, 49, 908. doi:10.1039/C9CS00542K.
- [5] J. Werth, C. Uyeda, Angew. Chem. Int. Ed. 2018, 57, 13902. doi: 10.1002/anie.201807542.
- [6] E. Clemmensen, Chem. Ber. 1913, 46, 1837. doi: 10.1002/cber.19130460292.
- [7] (a) H. French, R. Adams, J. Am. Chem. Soc. 1921, 43, 651. doi: 10.1021/ja01436a035.
- (b) L. Wang, J. M. Lear, S. M. Rafferty, S. C. Fosu, D. A. Nagib, Science, 2018, 362, 225. doi: 10.1126/science.aau1777.
- (c) S. M. Rafferty, J. E. Rutherford, L. Zhang, L. Wang, D. A. Nagib, J. Am. Chem. Soc. 2021, 143, 5622. doi: 10.1021/jacs.1c00886.
- [8] J. Burés, Angew. Chem. Int. Ed. 2016, 55, 2028. doi: 10.1002/anie.201508983.
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载














No comments yet.