新的取代环己烷的立体选择性合成方法学最近被开发报道。作为频繁出现的环己烷结构的新合成策略,意义巨大。
取代环己烷合成法
环己烷环是一种在化合物中常见的结构,也常常出现在天然产物中。取代的环己烷环合成方法可以通过使用单元碳的组合,通常分为四种类型的[6 + 0],[5 + 1],[4 + 2]和[3 + 3](图1A)。具体来说、[6+0]与[4+2]的方法分别有芳香环的还原氢化[1]与Diels–Alder反应加后续还原[2]。此外,还已知通过环丙烷二聚化的[3 + 3]型合成方法[3]。另一方面、已报道的[5+1]型的合成方法是在丙二酸二酯二烷基化后进行脱羧进行的,但由于步骤数很多,因此没有广泛使用[4]。
另一方面,作者Donohoe等人在本文中,在氢转移催化剂Ir1和碱存在下,使用伯醇或仲醇成功地与酮发生烷基化反应合成环己烷骨架[5](图1B)。这次,Donohoe等人应用这种氢转移催化反应,开发了由五甲基苯基(Ph *)酮2和1,5-二醇3生成取代的环己烷4的立体选择性合成方法(图1C)。
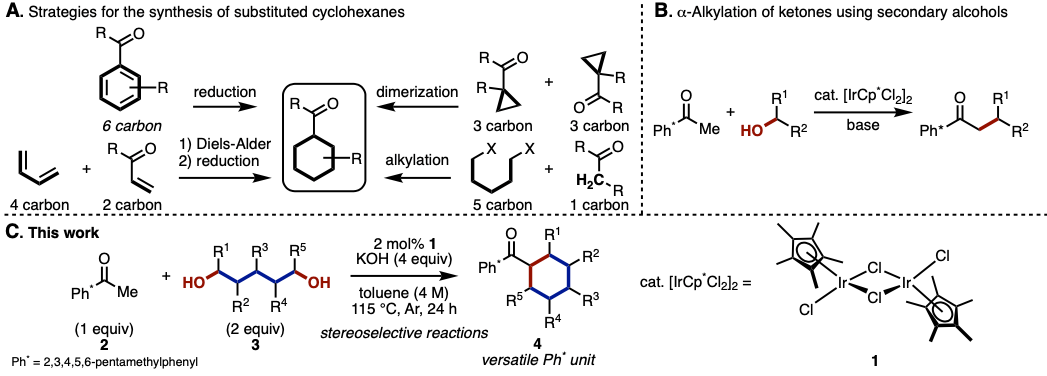
图1. (A) 环己烷环合成法的分类 (B) 通过氢转移反应进行的酮的α-烷基化 (C) 本论文中的反应
“Stereoselective Synthesis of Cyclohexanes via an Iridium Catalyzed (5 + 1) Annulation Strategy”
Akhtar, W. M; Armstrong., R. J.; Frost, J. R.; Stevenson, N. G.; Donohoe, T. J.J. Am. Chem. Soc. 2018, 140, 11916.
DOI: 10.1021/jacs.8b07776
论文作者介绍

1985–1989 BSc (Hons) first class, University of Bath. (Professor T. J. Gallagher)
1989–1992 PhD, Oxford University, (Prof. S. G. Davies)
1993–1994 Post doctoral research (Prof. P. D. Magnus FRS)
1994–2000 Lecturer in Chemistry, University of Manchester
2000–2001 Reader, University of Manchester
2001–2004 Lecturer, Magdalen College and the University of Oxford
2004– Professor, Magdalen College and the University of Oxford
2006–2011 Head of Organic Chemistry, University of Oxford
研究内容:新型催化反应的开发、天然产物的全合成
论文概要
通过在铱催化剂1和氢氧化钾存在下,对酮2和二醇3加热进行的该反应。二醇的底物范围宽,无论是使用无取代的二醇3a,单取代的二醇(3b–3e),二取代的二醇3f,具有环结构的二醇3g,都适用于该反应(图2A)。
该反应具有中等〜高非对映选择性。关于该选择性,作者从多种底物反应后的选择性为基础,提出了如图2B所示的机理。首先,作者认为是通过重复两次图2B所示的氢转移反应来进行整个反应的。也就是说:1)通过铱催化氧化醇和形成氢化铱[Ir-H],2)所得羰基化合物在碱性条件下发生醛醇缩合,3)生成的烯酮再通过[Ir-H]发生还原氢化并使铱催化剂得到再生。基于该机理,作者认为反应经由如图2B所示的中间体进行。每个取代基的立体化学通过下图中的中间体的反应来确定。C1位的立体化学通过产物4的酮α位差向异构化确定,其是由热力学支配的。C2位由[Ir-H]加氢到环己烯中间体C时的面选择性决定。C3位置通过待形成的二酮B的差向异构化来确定。最后,关于C4位置,它不涉及差向异构化等,因此起始材料的立体化学就反映在产物中。
使用逆Friedel-Crafts反应,可以将该氢转移催化剂反应所必需的Ph *基团转化为酯5或酰胺6而不发生差向异构化(图2C)。
综上,作者报道了新型立体选择性的取代环己烷的合成方法。 这种新的[5 + 1]型的取代环己烷合成方法可以从易得的原料来合成各种取代环己烷骨架,有望用于天然产物的全合成以及活性分子的合成。
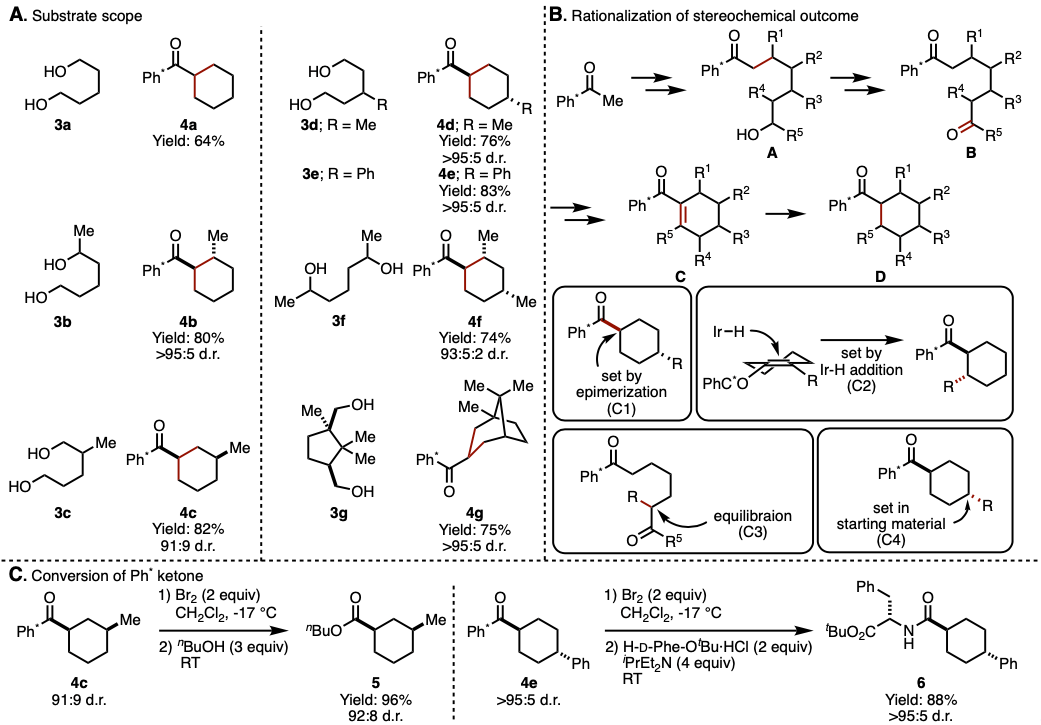
图2. (A) 底物适用范围 (B) 立体选择性解释 (C) Ph*酮的应用
参考文献
- (a) Wang, D.-S.; Chen, Q.-A.; Lu, S.-M.; Zhou, Y.-G. Chem. Rev. 2012, 112, 2557. DOI:1021/cr200328h(b)Stalzer, M. M.; Nicholas, C. P.; Bhattacharyya, A.; Motta, A.; Delferro, M.; Marks, T. J. Angew. Chem., Int. Ed.2016, 55, 5263.DOI: 10.1002/anie.201600345
- Fringuelli, F., Taticchi, A., Eds. The Diels-Alder Reactions: Selected Practical Methods; J. Wiley & Sons Ltd.: Chichester, U.K., 2002.
- (a) Ivanova, O. A.; Budynina, E. M.; Chagarovskiy, A. O.; Trushkov, I. V.; Melnikov, M. Y. J. Org. Chem. 2011, 76, 8852. DOI: 1021/jo201612w(b) Ma, W.; Fang, J.; Ren, J.; Wang, Z. Org. Lett. 2015, 17, 4180. DOI: 10.1021/acs.orglett.5b01927
- Li, X.; Wang, B.; Zhang, J.; Yan, M. Org. Lett. 2011, 13, 374. DOI: 1021/ol102570b
- (a) Frost, J. R.; Cheong, C. B.; Akhtar, W. M.; Caputo, D. F. J.; Stevenson, N. G.; Donohoe, T. J. J. Am. Chem. Soc. 2015, 137, 15664. DOI: 10.1021/jacs.5b11196(b) Akhtar, W. M.; Cheong, C. B.; Frost, J. R.; Christensen, K. E.; Stevenson, N. G.; Donohoe, T. J. J. Am. Chem.Soc. 2017, 139, 2577. DOI: 10.1021/jacs.6b12840
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!


















No comments yet.