译自Chem-Station网站日本版 原文链接:広範な反応性代謝物を検出する蛍光トラッピング剤 〜毒性の黒幕を捕まえろ〜
翻译:炸鸡 校对:Jiao Jiao
在研发新药的过程中,毒性,一直是一个无法回避的问题。具有显著细胞毒性或是表现出Ames positive 的化合物会一开始在研发早期被排除在外,但是仍有一部分化合物直到非临床试验(即动物试验和 in vivo)或临床试验(以人作为对象进行治疗),人们才发现它们具有严重的毒性。例如最近日本武田药业的orexin受体激动剂TAK-994曾经被认为是治疗I型发作性睡病的药物,但由于II期试验中引发了严重的安全问题而被暂停开发。尽管通过分析技术和AI,对未知化合物的毒性预测变得越来越精准,但生物体内的意外作用总是困扰着药物研发者。
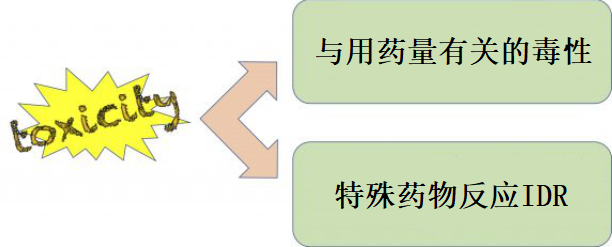
但是,即便临床试验没有发现该化合物有毒,并不能百分之百肯定这个化合物就一定是安全的。某个药物已经被批准允许生产上市了,但不久发现该药物有巨大的副作用,会造成人体脏器受损甚至导致死亡,这样的案例不胜枚举。为什么临床试验没事,到了市场上就会出现严重副反应呢?因为临床试验的试验样本有限,即便是大规模的临床试验,试验样本也不会超过一万,但是一旦药品发售到市面上,那就是上百万上千万的患者在用药了。问题的关键是一种临床试验无法发现,基于少数个体的体质表现出的毒性,我们把这种毒性称为特异体质性药物毒性(Idiosyncratic Drug Toxicity:IDT)。IDT的表达与给药剂量几乎无关,即使少量给药也可能表现出严重毒性,这种毒性反应称为特殊药物反应(IDR:Idiosyncratic Drug Reaction)。一旦发现某种药物有毒性,该药物很可能会被限制用药甚至不得不退出市场,这样的话不管药物最后是被药企回收还是药企得到一点补偿,都对药企来说是个颇为沉重的打击。
IDT的表达与免疫系统和细胞色素P450(CYP)等代谢酶生成的反应代谢物有关[1]。
图1 药物毒性表达的两个模式
反应代谢物
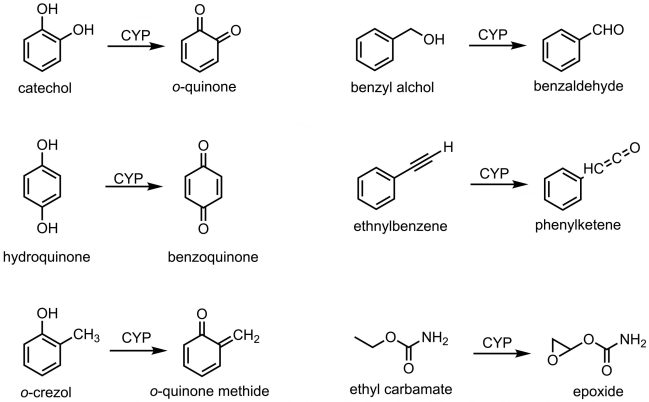
CYP是一种参与大部分药物代谢的酶。在CYP参与代谢的过程中,CYP通常通过增加母体化合物的水溶性(如增加羟基,脱除烷基)使药物转向低毒性和易于排泄的结构。但是代谢也可能产生比母体化合物毒性更高的代谢产物,我们把这样生成的代谢产物称为活性代谢物。活性代谢物和平常的化合物一样,毒性与剂量有关。另一方面,在某些化合物的代谢过程中,会产生化学不稳定和高反应性的反应代谢物,如自由基和亲电体。这些反应代谢物寿命短,极其容易与周围的水分子和谷胱甘肽等解毒・结合分子反应而被无毒化,但在极少数情况下,它们与蛋白质等生物分子形成共价键,不可逆地抑制蛋白质的功能,从而表现出严重的毒性。这种情况下的毒性与剂量无关,即使在低剂量下也可能引起严重的副作用。代谢酶的表达量存在很大的个体差异,在发现大量的可以生成反应中间体的代谢酶的个体中,反应中间体产生毒性的风险相应增加。这与个体体质差异表现出的药物毒性和IDR(特殊药物反应)的表达有关。
图2 部分反应代谢物的结构
近年来在新药研发领域,回避在代谢过程中表现出与用药剂量相关的毒性的化合物已经成为一件理所应当的事情了,这要归功于早早就开始的代谢物预测和检索。并且,在研发初期(早于非临床试验)就确定反应代谢物的生成,在药物上市后也尽可能降低安全风险。积极响应这一需求的工具就是捕捉剂。
捕捉剂
顾名思义,这是一种捕捉毒性幕后黑手并将其暴露在光天化日之下的工具。同义词还有自旋捕捉剂。自旋捕捉剂能与活性种如不稳定的自由基反应形成稳定自由基,可以用ESR法测量。药物代谢中的捕捉剂优先与寿命短的反应代谢物反应,形成稳定的加合物,便于MS等检测。
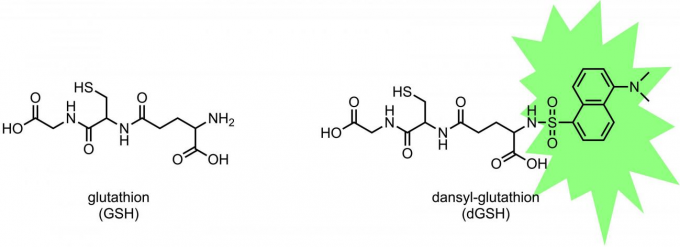
典型的捕捉剂有谷胱甘肽(图3左)。谷胱甘肽是一种由谷氨酸,半胱氨酸和甘氨酸组成的三肽,当半胱氨酸的硫醇(SH)基团与soft亲电体(请参看软硬酸碱理论),如α,β-不饱和羰基化合物(Michael acceptor),反应时发挥解毒作用。通过LC-MS分析谷胱甘肽加成物,可以推测反应代谢物的结构。但是仅凭这一点很难判断反应代谢物的生成量(即定量)。如果要定量测定反应代谢物的生成量,就要用到标记化的捕捉剂。标记能使捕捉剂具有定量性。例如,通过用放射性元素[35S]标记谷胱甘肽,然后用RI-HPLC以高灵敏度对反应代谢物定量测定。但是用放射性元素标记反应代谢物有两个缺点:需要特殊的hot laboratory设备(研究反应堆的辅助实验设施,与反应堆室相连而建。);随着时间推移信号强度会衰减。
那么有没有其他可以有效定量测定反应代谢物的捕捉剂呢?有!那就是荧光标记的捕捉剂。被荧光标记的反应代谢物可以用FL-HPLC定量测得,并且荧光标记法在安全性,稳定性,设施和成本方面优于放射性元素标记法。荧光标记捕捉剂的代表有丹磺酰谷胱甘肽(dGSH)(图3右)。dGSH是N末端与荧光团丹磺基结合的谷胱甘肽,由日本渡边化学工业公司在市场上销售[2]。dGSH在快速检测反应代谢物方面发挥了重要作用,并已被多家制药公司使用。
图3 谷胱甘肽(GSH)和丹磺酰谷胱甘肽(dGSH)的结构
能够捕获广泛反应谢物的新型荧光捕捉剂
不过,dGSH也有一些不足之处,其中之一就是“检测不出hard加成反应的反应性代谢物”。这里的hard和soft对应。我们将参与加成反应的亲电试剂和亲核试剂分为hard类和soft类,根据软硬酸碱理论(HSAB)的分类标准,醛和烯酮属于hard型亲电体,与谷胱甘肽等soft型亲核试剂反应性低,不易形成加成物。但是一些属于hard型亲电型的反应代谢物会与蛋白质的赖氨酸残基(氨基属于hard型亲核试剂)发生反应,从而改变了蛋白质原本的结构,所以这类的反应代谢物是有毒性的。那么怎么定量测量这类反应性代谢物的生成量呢?答案是甲氧基胺。甲氧基胺能检测出hard型亲电体的反应代谢物与对应的亲核剂形成的加合物,但是形成的加合物也是一种叫亚胺的不稳定活性种,所以检测效率不佳。
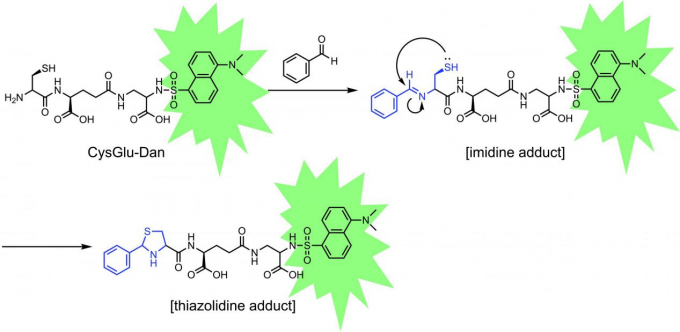
日本庆应义塾大学药学部的大江智之副教授和学生柴崎智香子等人开发了一种新的荧光捕捉剂CysGlu-Dan,能够检测hard和soft型两种反应代谢物[3]。CysGlu-Dan是一种在N-末端具有半胱氨酸的化合物,通过谷氨酸延伸的接头连接荧光团丹磺基(图4)。CysGlu-dan的特征在于它的N-末端。在现有的hard 型捕捉剂剂中,与醛反应形成亚胺,而在CysGlu-Dan中,分子内附近的硫醇基团攻击产生的亚胺,形成稳定的噻唑烷骨架(图4)。这样一来,捕捉剂与反应代谢物形成的加合物十分稳定,用FL-HPLC定量测定也就不是难事了。在大江智之的论文中,描述了通过细胞色素P450(CYP)代谢苯甲醇和乙炔基苯,成功检测出了代谢物苯甲醛和苯基烯酮(均为hard型反应代谢物)。当然,CysGlu-Dan还可以检测和定量soft型反应性代谢物,并且CysGlu-Dan比dGSH更能有效地捕获抗糖尿病药物曲格列酮和抗炎药物双氯芬酸的反应代谢物。CysGlu-Dan的另一个优点是它不会抑制CYP的代谢活性,这对检测反应代谢物的生成至关重要。CysGlu-Dan对CYP的7种同工酶(1A1,2B6,2C9,2C19,2D6,2E1和3A4)的抑制活性与dGSH相当或比之更弱,甚至可忽略不计。这一性质对防止反应性代谢物检测中出现false negative而言至关重要。这些特征表明,CysGlu-Dan是一种高度实用的荧光捕捉剂,能够检测出许多反应代谢物。
图4 CysGlu-Dan与醛(hard型亲电试剂)反应形成加合物
酰基葡萄糖醛酸的检测
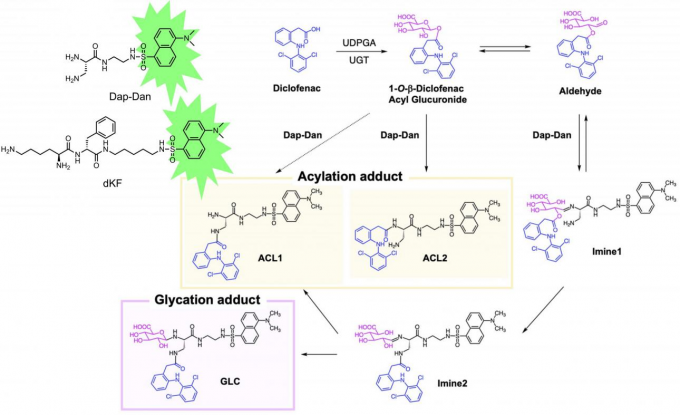
大江教授还和他的同事发明了一种荧光捕捉剂,该荧光捕捉剂能够检测由II期药物代谢(结合反应)产生的反应代谢物酰基葡糖醛酸钠[4]。Dap-Dan(图5)是在末端具有乙二胺结构的丹实基衍生物。到目前为止,与丹磺基结合的赖氨酸-苯丙氨酸二肽(dKF,图5)被用作酰基葡糖醛酸的捕获剂,但其检测效率并不高。Dap-Dan的结构经过了精确的设计,确保能捕获羧酸酰化物和糖基化物(图5:双氯芬酸-酰基葡糖醛酸的捕获机制),并通过结构分析证实了稳定的加合物的形成。Dap-Dan成功地检测到了几种药物的糖化物,这些药物由于其在人体代谢中会形成有毒性的酰葡糖醛酸而退出市场,可以说Dap-Dan比dKF更有效。在药物设计中,羧酸是一种有用的取代基,经常用于提高化合物的水溶性和增加与靶的相互作用位点,但近年来已经发现新增的羧基会带来意外的毒性风险。在毒性风险评估领域,Dap-Dan有望成为新一代荧光捕捉剂。
图5 Dap-Dan的结构以及捕获酰基葡糖醛酸钠的机理(引用自文献[4])
结束语
俗话说“是药三分毒”,药性和毒性的界线非常的模糊,但是IDR(特殊药物反应)和反应代谢物超出了人们对药物毒性的普遍认知,同时也是造成很多药物退出市场的幕后黑手。荧光捕捉剂是一种有效的工具,用于早期有效地发现这些有毒性的反应代谢物,但到目前为止荧光捕捉剂的的种类非常的有限。捕捉剂就像超市里随时待命的警察,他们在活性代谢物与生物大分子发生反应造成损害之前就抓住了罪魁祸首,并把他交给办公室或警察(即使活性代谢物还没有与生物大分子发生反应也会被“捉住”)。在新药研发中,毒性反应代谢物的检测是项体力活,要想提高检测效率,不仅需要大量的“警察”,还需要提高每个“警察”抓捕犯人的能力。笔者希望像CysGlu-Dan和Dap-Dan这样的新一代荧光捕捉剂能被更多人熟知,并广泛被使用。
参考文献
[1] 大江知之、「反応性代謝物とその評価」、日本薬理学雑誌、2009, 134, 338-341, doi: 10.1254/fpj.134.338.
[2] Watanabe Chemical News, WN-180801-431.
[3] Shibazaki, C.; Ohe, T.; Takahashi, K.; Nakamura, S.; Mashino, T., “Development of fluorescent-labeled trapping reagents based on cysteine to detect soft and hard electrophilic reactive metabolites”, Drug Metab. Pharmacokinet, 2021, 39, 100386, doi: 10.1016/j.dmpk.2021.100386.
[4] Shibazaki, C.; Mashita, O.; Takahashi, K.; Nakamura, S.; Mashino, T.; Ohe, T., “Development of a Fluorescent-Labeled Trapping Reagent to Detect Reactive Acyl Glucuronides”, Chem. Res. Toxicol, 2021, In press, doi: 10.1021/acs.chemrestox.1c00236.



















No comments yet.