本文作者:海猫
导读
近日,南安普顿大学的Stephen.M.Goldup教授在JACS杂志上发表论文,报道了一种简单的策略,可以精确控制大环的位置来合成主链寡核苷酸轮烷。作者还对这种新型的基于DNA的轮烷做了一系列分析,来评估机械键对其性能的影响。
AT-CuAAC Synthesis of Mechanically Interlocked Oligonucleotides
Amanda Acevedo-Jake, Andrew T. Ball, Marzia Galli, Mikiembo Kukwikila, Mathieu Denis, Daniel G. Singleton, Ali Tavassoli, and Stephen M. Goldup
J. Am. Chem. Soc., ASAP DOI: 10.1021/jacs.0c01670
正文
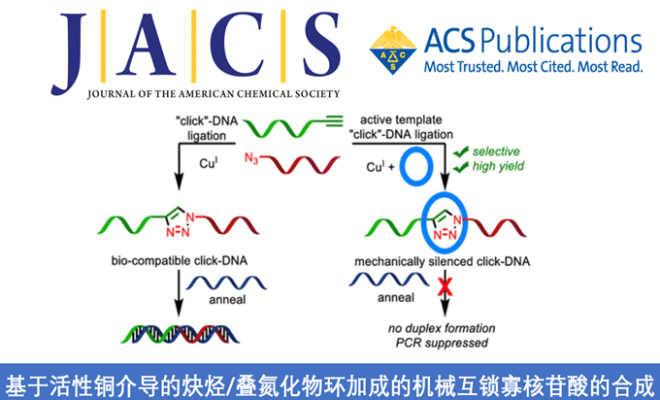
在Wasserman,Harrison和Schill成功合成出基于寡核苷酸的机械互锁分子(MIMs)之前,Vinograd和他的同事早在1967年就观察到了连环化的DNA,这种DNA的连环现象是在DNA复制过程中产生的,受拓扑异构酶控制,其螺旋结构在某些DNA聚合酶的活动中起着重要作用。迄今为止,科学家们也已经使用DNA自组装方法(包括折纸方法)生产了基于人工寡核苷酸的MIM分子。尽管这些方法可以产生复杂的结构并刺激反应系统,但产生的螺旋结构相对比较大(环的大小通常大于100个碱基对),且组装的序列没有生物学意义。目前,尚无含非核苷酸大环的基于寡核苷酸的MIM报道,可能是因为现有合成轮烷的方法均不适用于功能性互锁DNA的合成:被动的模版方法需要对糖-磷酸骨架进行重要的修饰,而基于疏水结构的方法也因为寡核苷酸的亲水性而不适用。
Tavassoli, Brown及其同事已经开发出了一种三唑键,可以取代寡核苷酸链中的天然磷酸二酯键,这种非天然的修饰在细菌和人类细胞中具有很好的生物相容性。这种“点击-DNA连接”方法克服了自动DNA合成的长度限制,它可以合成更长的寡核苷酸——被炔烃或叠氮修饰的约100碱基的片段通过CuAAC连接相互结合,例如一锅法合成表观遗传修饰的、生物相容性比较好的三唑相连的基因。点击-DNA连接也提供了另外一种可能:Leigh的活性Cu介导的炔烃/叠氮环加成反应(AT-CuAAC)允许同时形成三唑部分并形成机械键。
因此作者通过结合Goldup的AT-CuAAC反应的大环修饰和Tavassoli、Brown的点击-DNA连接方法,来合成生物学相关的DNA轮烷。机械键可以显著的改变寡核苷酸的超分子和生物学特性。实验结果表明,机械键可以用来调控生物相容DNA的行为。
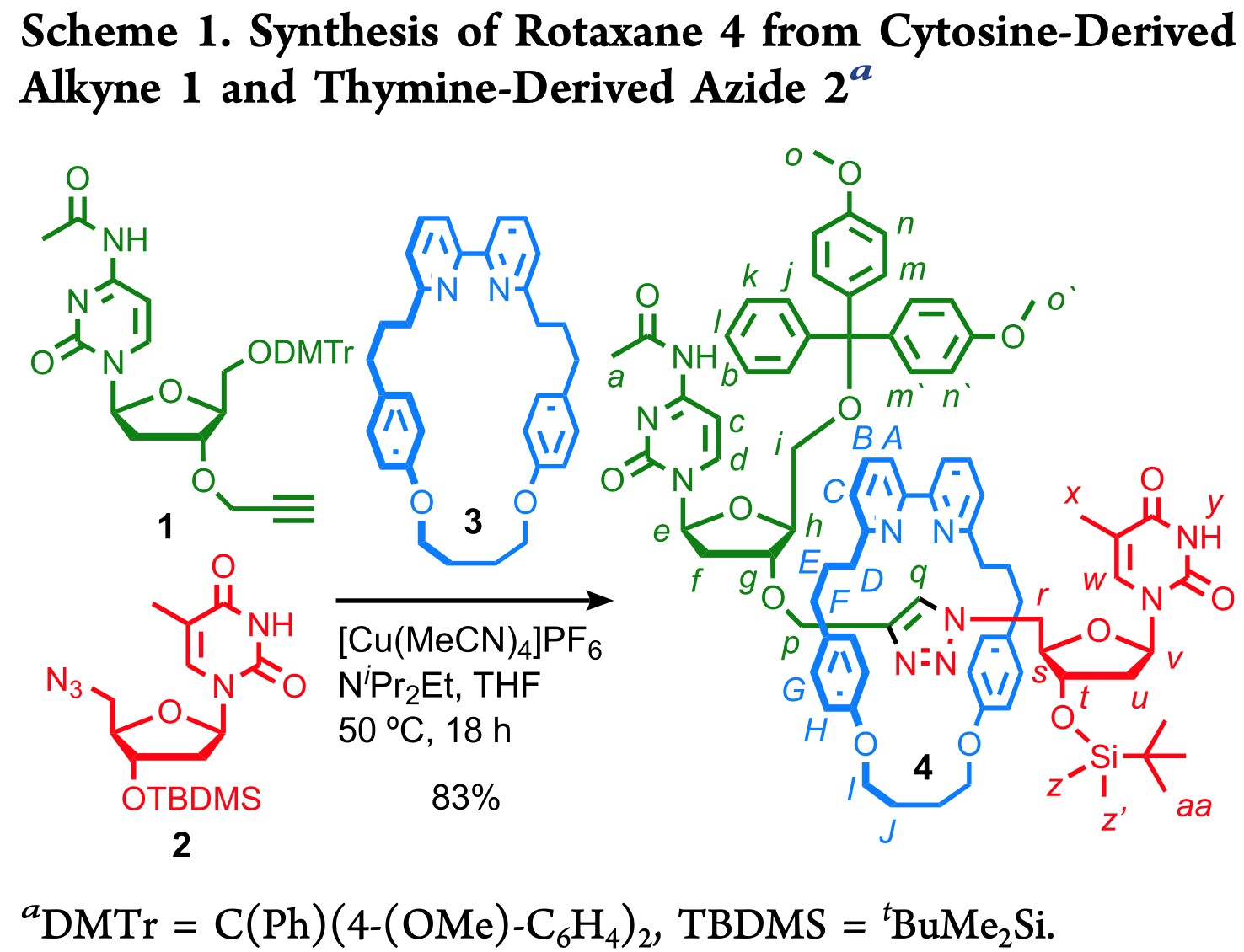
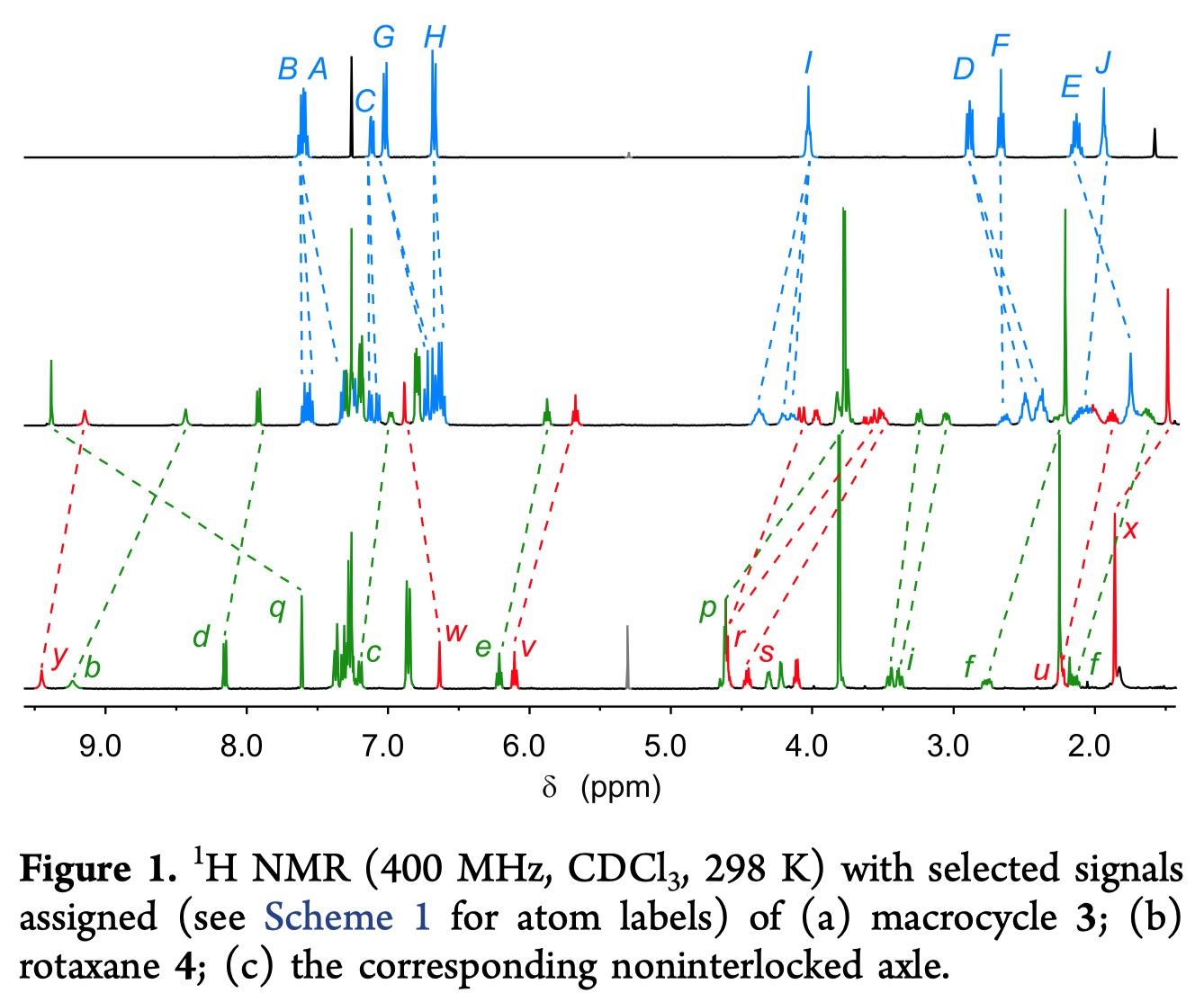
因为AT-CuAAC反应目前还没有被应用在取代的核苷酸上,作者首先探究了在大环3的作用下,将炔丙基胞嘧啶1和叠氮胸腺嘧啶2进行反应,是否能得到轮烷(Scheme 1)。值得高兴的是,在标准的AT-CuAAC反应条件下,可以以很高的产率(83%)得到轮烷4。在质谱中,4的质子化的分子离子峰与预期相同(m/z=1470),核磁共振氢谱也表现出了和这种互锁分子相似的特征;轮烷中的三唑质子Hq的化学位移比非互锁分子的要高1.5 ppm,这也与预期的连吡啶单元中的C—H…N氢键一致(Figure 1)。除此之外,由于手性互锁产物中环两侧对称性的提高,原本在大环非互锁分子3中显示单峰的质子HA,HB,HC,HF和HG,在互锁产物中被分离成两个信号。
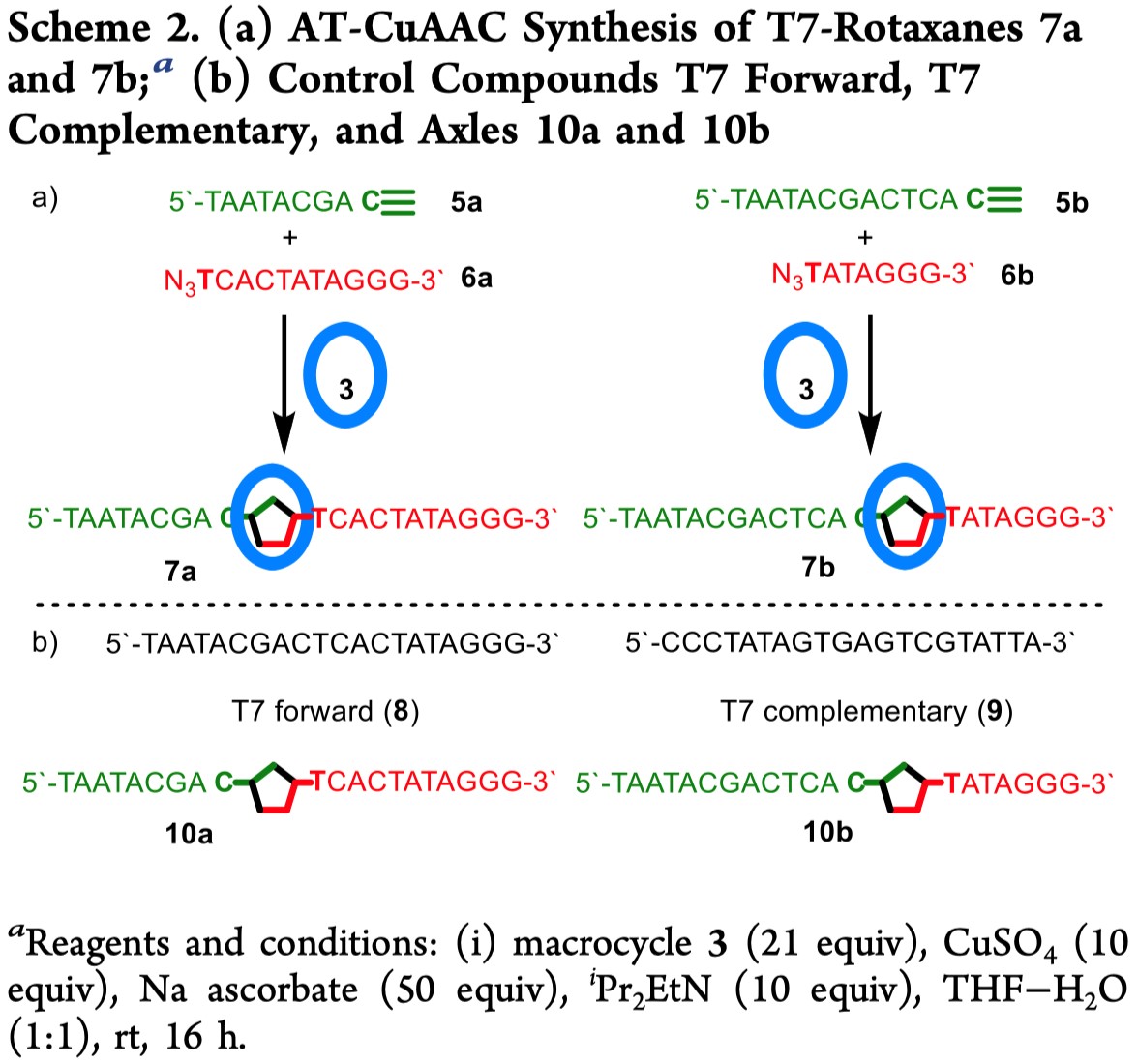
在证明了简单的三唑连接的二核苷酸轮烷4的合成之后,作者开始挑战使用AT-CuAAC方法合成更长的互锁寡核苷酸。他们选择了一种含20个碱基的T7启动子序列,这种启动子序列被广泛用于各种生物学应用中。作者使用标准固相技术合成了炔5a和叠氮化物6a,并系统的优化了click-DNA连接的反应条件(详见Support Information)。优化后的条件为,在大环3的存在下,以THF-H2O(1:1)作为溶剂,CuSO4/Na抗坏血酸盐作为一价Cu的来源,NiPr2Et作为碱来加速反应,得到唯一产物T7轮烷7a(Scheme 2),经过HPLC纯化后,产率为83%(LC-MS分析未检测到非互锁产物10a)。在相同条件下,炔烃5b和叠氮化物6b以90%的产率反应生成了T7轮烷7b,它与7a在DNA主链的机械键位置不同。LC-MS分析证实了生成的两种产物的纯度。此外,作者合成了天然寡核苷酸T7正向序列(8)和非互锁三唑轴向分子10a和10b,作为对照化合物。检测发现,轮烷7和轴向化合物10在HPLC中的保留时间显然不同(分别为~8.5和~7.5分钟)。
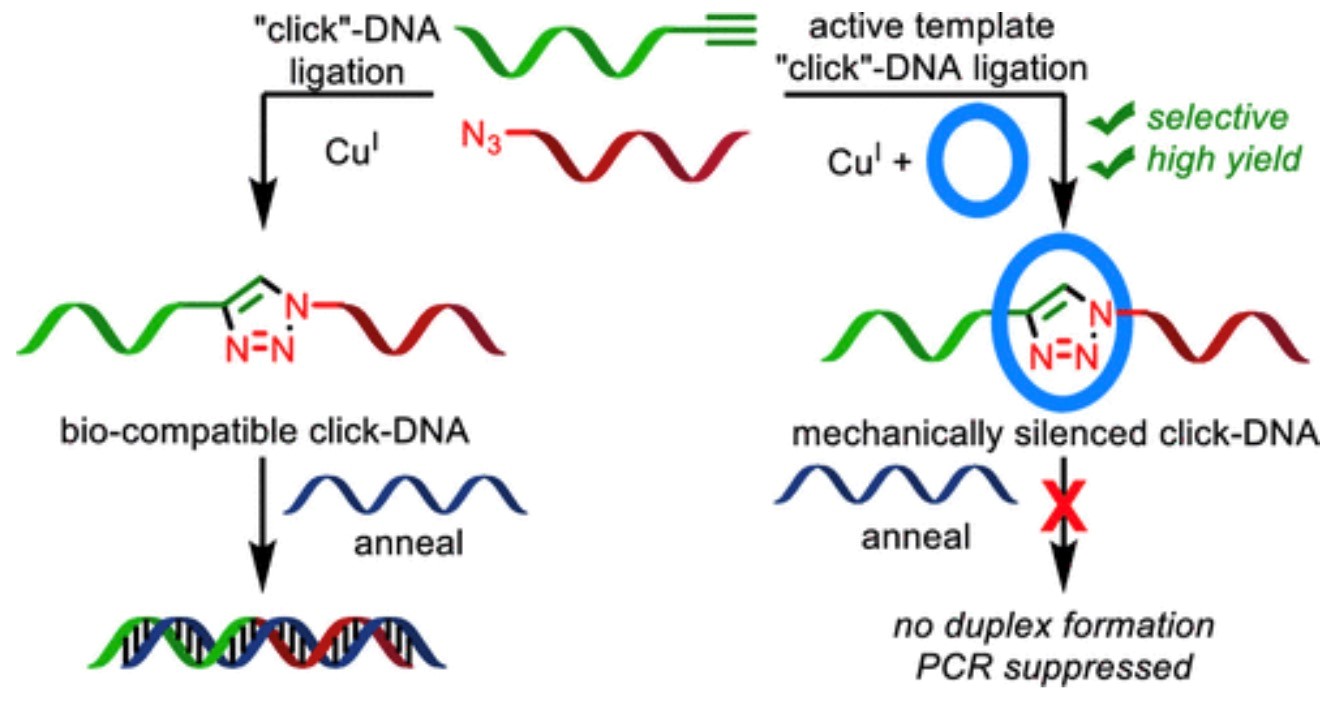
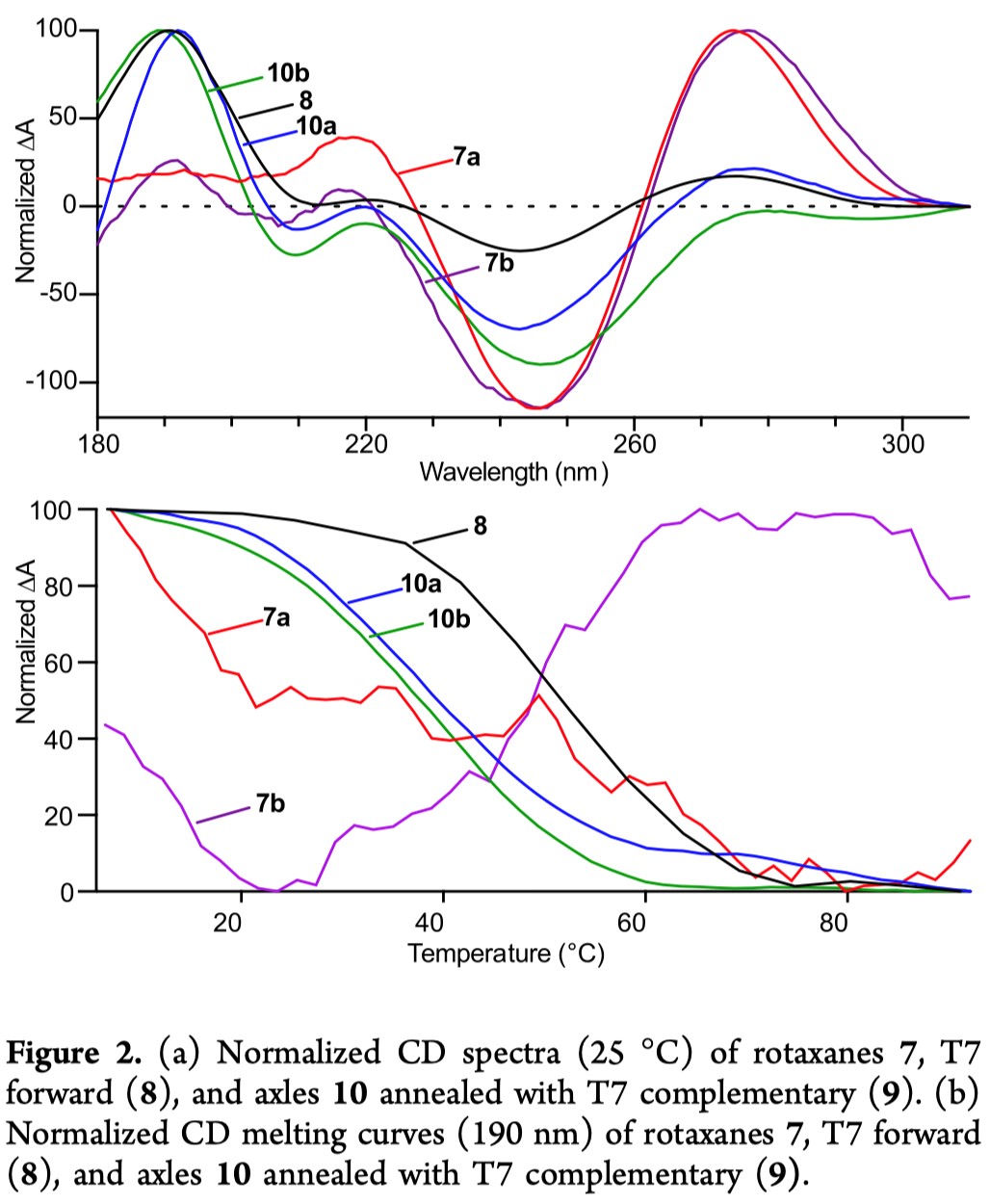
为了评估机械键对DNA双链形成的影响,作者将轮烷7与T7互补寡核苷酸(9)一起退火,然后用圆二色谱(CD)分析所得的混合物(Scheme 3)。在室温下,天然的T7正向序列(8)和非互锁的含三唑的寡核苷酸10表现出了预期的CD信号,介于180和200 nm之间。这个信号与DNA双螺旋结构有关(Figure 2)。此外,对8和10缓慢升高温度以“熔化”双链体会导致与双链体形成相关的CD信号显著下降,而对轮烷类化合物7来说,就没有观察到与双链体分解相关的CD信号的改变。综上所述,这些结果表明轮烷7不与其互补链杂交形成DNA双链体,即DNA杂交被机械键抑制。
轮烷7未能与其互补链形成双链体,这说明机械键起到“笼罩”寡核苷酸的作用。目前已经有了基于对天然碱基的共价修饰来掩蔽的DNA或RNA的研究,可以选择性的控制生物学的功能。然而在这种情况下,通常需要多个修饰位点才能有效的抑制杂交。而在轮烷7这样的寡核苷酸中,似乎只需要单个修饰就足以完全抑制双链体形成。
为了证明这一结果的生物学应用前景,作者检查了轮烷7a和7b用作PCR引物时的行为。天然的T7正向序列和非互锁的含三唑的寡核苷酸10a和10b用作阳性对照。这些对照引物均在各种退火温度(55 °C,41 °C和32 °C)下成功地从模板质粒中扩增了1000 bp片段,从而形成了预期分子量的单条带(Figure 3)。然而,与上述实验表明的没有双链体形成的结果相一致,当寡核苷酸轮烷7a和7b被用作PCR扩增的正向引物时,即使在相对较低的32 °C退火温度下,也未观察到扩增(Figure 3)。基于上述结果得出,轮烷7a和7b中的机械键有效的抑制了互锁的寡核苷酸用作T7聚合酶的引物的能力。
总结
南安普顿大学的Stephen.M.Goldup教授团队证明了点击-DNA连接中使用的CuAAC方法可以用在具有生物活性的模板,合成生物相容的基于三唑的寡核苷酸轮烷。实验表明,非互锁的产物链能够与互补链形成双链体,并可以充当寡核苷酸扩增的引物序列,但互锁的产物就不可以;双链形成和PCR扩增被单个大环围绕着链而完全抑制,这表明机械键是可以“笼罩”寡核苷酸的有效修饰。即使互锁分子已经多年用于人工分子机器的组成部分,近年来,研究者对其生物学应用的兴趣不断增长,比如作为前药、传感器和生物活性分子的传递因子等。根据作者所研究的结果,机械键将在人工刺激反应性DNA的开发中起到关键作用,可以用于实时研究基因表达和蛋白质功能。今后作者的工作将会集中在开发可裂解的大环,当有外界或者生物刺激时,大环就会去除以重新激活寡核苷酸的生物活性,并且之后还将把这种方法扩展至更长的寡核苷酸和质粒中。
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!





















No comments yet.