L2015年、加州大学洛杉矶分校・Neil Garg课题组、使用镍催化剂在温和条件下通过酰胺键裂解成功地形成酯。
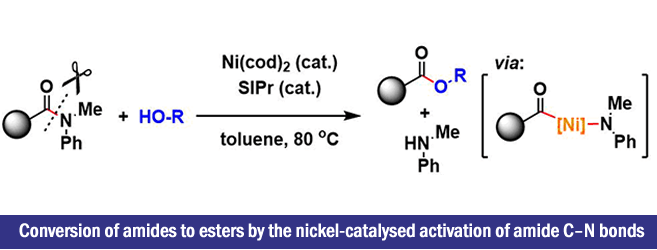
“Conversion of amides to esters by the nickel-catalysed activation of amide C–N bonds”
Hie, L.; Nathel, N. F. F.; Shah, T. K.; Baker, E. L.; Hong, X.; Yang, Y.-F.; Liu, P.; Houk, K. N.; Garg, N. K. Nature 2015, 524, 79–83. doi:10.1038/nature14615
课题设定
酰胺是蛋白质中常见的官能团。 由于氮原子的给电子性质引起的共振贡献,C-N键很强,因此它在合成过程中在许多反应条件下是很稳定的。因此除酶促反应外,仍然难以合成化学切割酰胺C-N键。已经报道的酰胺裂解包括、通过Schwartz试剂转换为醛基或者Weinreb酰胺与有机金属试剂的反应生成酮(Weinreb ketone synthesis)。
在酰胺的酯化反应中,通常需要诸如强酸性或强碱性,溶剂量的醇等严苛的条件才能进行。高可靠性酰胺的酯化包括通过Keck酰胺氧甲基化后水解的方法[1],但该方法仅限于甲酯的应用。
实施手法
Garg等人、使用廉价的镍催化剂,用有机金属(氧化加成)活化酰胺的C-N键的手法,巧妙了回避了酰胺的低反应性的问题。由于该手法在非常温和的条件下就能进行,所以这样就可以使得酰胺成为building blocks应用。
主张的有效性验证
①从计算化学与实验两面来进行反应探讨
使用苯甲酰胺作为底物进行镍-NHC催化反应以获得苯甲酸甲酯的方法学开发的同时,再使用计算化学进行优化与机理研究。为了研究N上的取代基对酰胺→酯转化的反应能量关系的影响、作者通过计算化学模拟计算出ΔG与氧化加成的能量壁垒。通过计算发现Weinreb酰胺与N-芳基酰胺再能量上是有利的、N-烷基酰胺是不利的。而实际反应收率几乎与此趋势一致。
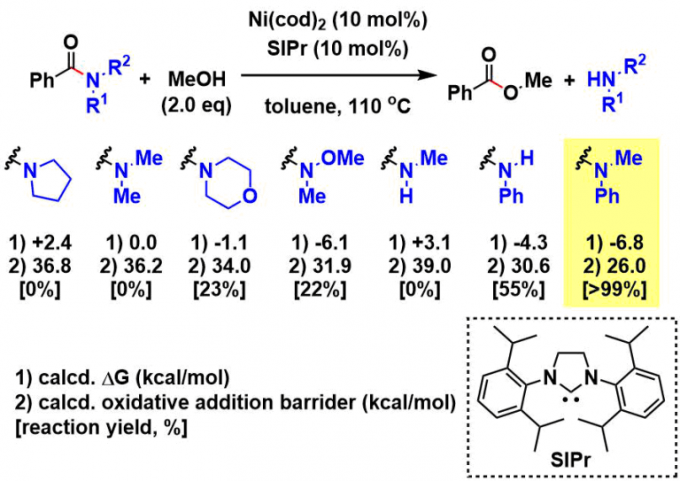
最后,作者通过使用N-甲基苯胺(R1 = Ph,R2 = Me)作为底物研究该条件,给出了在100当量MeOH的条件,在80℃下产率> 99%的最佳条件。
在该反应中,无论缺少哪种Ni催化剂或NHC配体(SIPr),反应都会不进行。 在配体的研究中,作者发现SIPr是最好的。
②底物适用范围的探讨
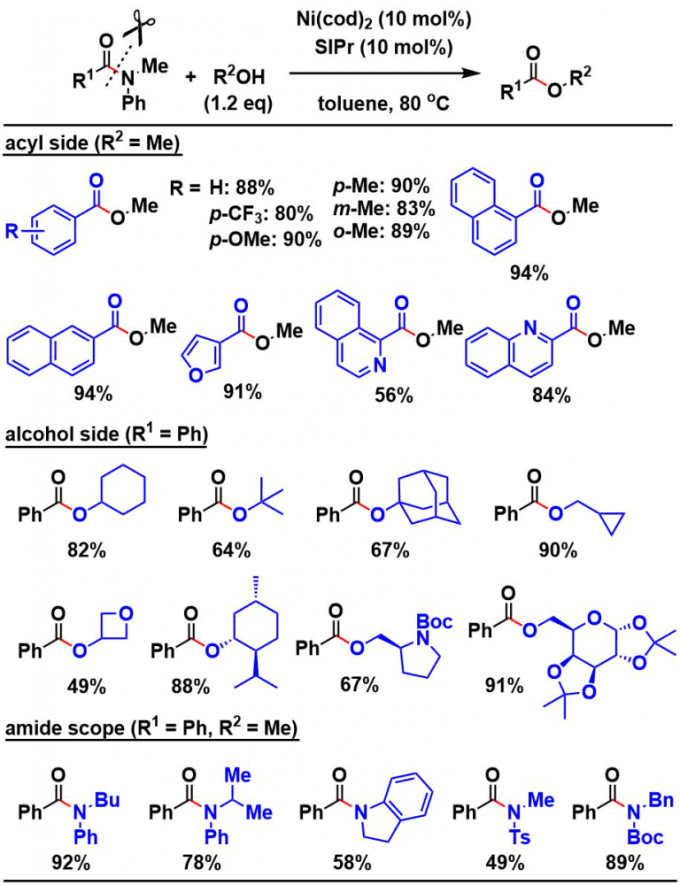
作者研究了酰胺侧和醇侧的底物范围。对于酰胺侧的底物来说,主要以芳香取代的羧酸由来的酰胺为主,而脂肪族的羧酸由来的酰胺在本反应中基本不反应。另一方面,醇侧的底物的兼容性范围比较广。另外酰胺的氮上的取代基不仅仅是Ph,其他的Ts或者Boc取代基的底物也能进行反应,英雌只要在热力学上是有利的,不一定必须是苯胺取代的底物也能进行反应。
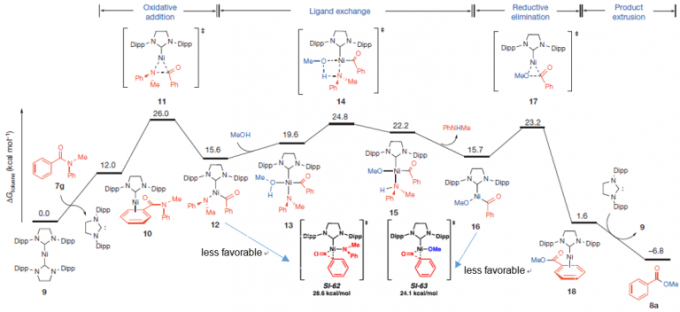
③催化循环
通过DFT计算作者假定该反应是如图中所示的催化循环进行的。催化循环包括对Ni的氧化加成,配体交换,还原消除。从计算来看氧化加成的阶段是限速步骤(+26.0 kcal/mol)、 反应整体是热力学比较有利的(ΔG=-6.8 kcal/mol)。
另外对12与16的脱碳酸过程的过渡态进行了计算、发现这两个过程在能量上都是不利的。
引用自论文
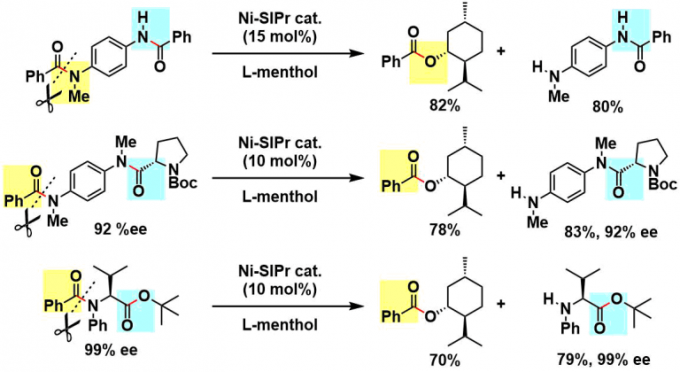
④选择性酰胺裂解
对于二级酰胺与三级酰胺混杂的底物来说、反应性高的三级酰胺会选择性的进行酯基化、并且在酰胺与酯混杂的情况下,只有酰基会发生酯化。脯氨酸和缬氨酸由来的含有酰胺底物也适用于该反应、由于反应条件比较温和,所以不会发生消旋化,仍然能够保持高ee。
需要讨论的点
- 用于酯化的醇的适用范围广,而且基本上等当量就能完成反应。如果能够克服酰胺侧的限制的话,那么该反应可以应用于多样的从酰胺到酯的转换。
- 虽说是温和的反应,但是实际上反应温度达到了80℃、如果想要适用于蛋白质等底物的话,还需要更加温和的条件。
接下来需要读的相关论文有?
- Zn催化剂催化的2步骤 (one-pot)、40-60℃的条件下、路易斯酸形式的伯酰胺裂解→酯化反应[2]。
- 使用DPT-BM试剂在中性室温条件下经由O-Bn化、成功切断酰胺的实例[3]。
参考文献
- Keck, G. E.; McLaws, M. D.; Wager, T. T. Tetrahedron 2000, 56, 9875. doi:10.1016/S0040-4020(00)00969-8
- Wybon, C. C. D.; Mensch, C.; Hollanders, K.; Gadais, C.; Herrebout, W. A.; Ballet, S.; Maes, B. U. W. ACS Catal. 2018, 8, 203. DOI: 10.1021/acscatal.7b02599
- Yamada, K.; Karuo, Y.; Tsukada, Y.; Kunishima, M. Chem. Eur. J. 2016, 22, 14042. doi:10.1002/chem.201603120
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!


















No comments yet.