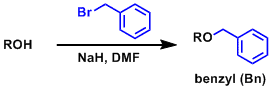
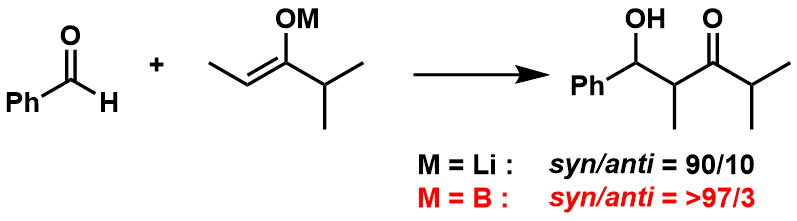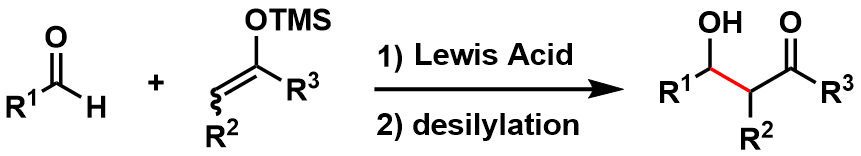对于化学界的明星反应-aldol reaction, 小编在化学空间,准备借此系列介绍一下它的特点、具有里程碑意义的研究、以及最近的研究方向等等。
在第1弹中,小编介绍了什么叫aldol反应,以及它的传统条件以及一些亟待解决的问题。
在第2弹中,小编想带大家一起来看一下针对第一弹中提及到的一些问题,我们的化学工作者是怎样开发一系列改良法来改善的,这里重点介绍一下烯醇的形成对aldol反应的影响。
利用金属烯醇进行的aldol反应
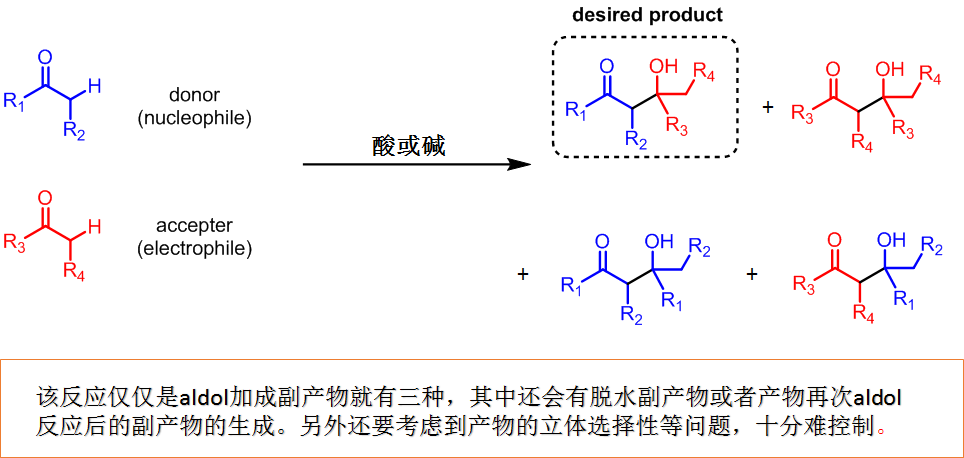
在上回的传统条件中,一般都是把两种作为donor・acceptor的羰基底物与活化剂(酸或碱)一起混合进行的反应。这个条件的最大的缺点就是:本身想作为donor使用的底物在反应中也作为acceptor或者作为acceptor的也同时作为donor反应,这样就像一条生产线,完全乱了,最终得到很多副产物(图1)。如果要想只生成所需产物,那么改良反应条件势在必行。
图1:aldol反应的控制十分困难
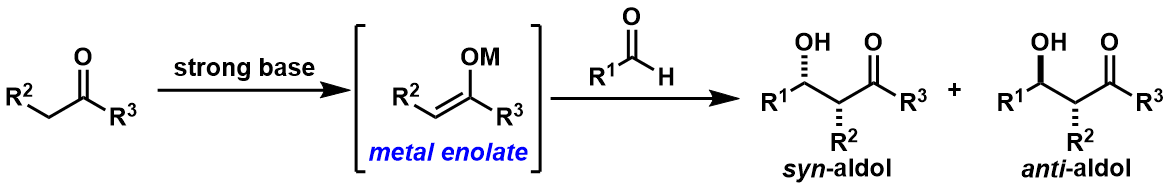
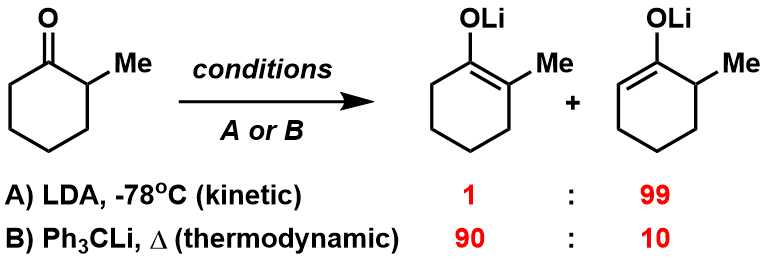
最早解决这个问题的方法是:首先利用强碱对donor底物进行脱氢化后形成金属烯醇,然后再跟acceptor发生aldol反应。(图2)
图2:金属烯醇介导下的aldol反应
跟最初的条件相比、该方法主要改善了以下3处。该方法的实用性很强,直到现在也常应用。
① 低温进行 (得到动力学产物)
② 优先发生交叉反应
③ 产物立体选择性可以预测
特别是第③点的预测产物选择性的特点,对于aldol反应的实用性是巨大的飞跃。接下来就这一点再详细介绍一下。
如图2所示,该方法得到syn体/anti体两种立体产物。从那时开始,对于选择性的问题上的研究又吸引了很多人的眼球。
后续研究结果发现、其实金属烯醇的几何异构性是可以制御的。例如对于金属锂的烯醇,Z-烯醇作为反应底物得到的是syn产物,而相反的E-烯醇中间体反应得到的是anti体产物。
为了便于理解,1957年Zimmerman与Traxler一起提出了aldol的六元环过渡态模型。该反应过渡态以取代基之间的立体位阻最小为基准,通过金属介导形成「椅式六员环结构」,通过这个过渡态,可以准确推断产物的立体选择性,一直沿用至今。(图3)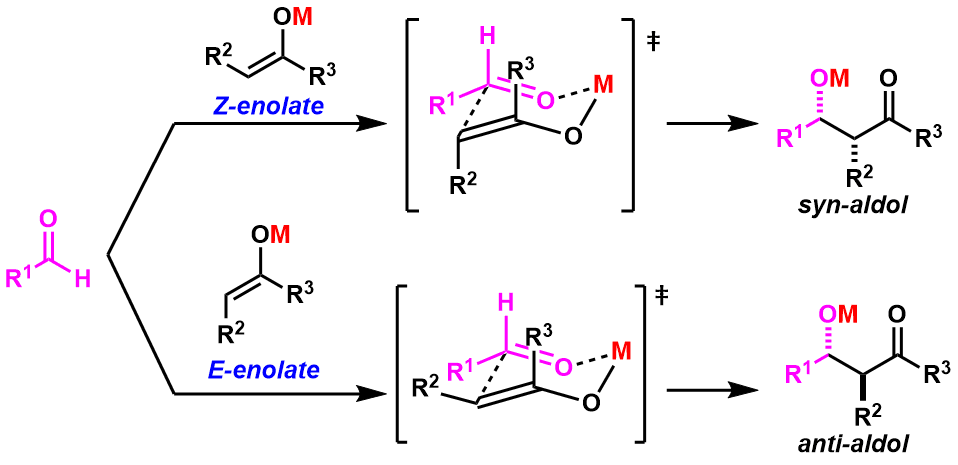 图3:Zimmerman-Traxler 六元环过渡态模型
图3:Zimmerman-Traxler 六元环过渡态模型
经常使用的金属烯醇及其特征
接下来就让我们来看看现在一直在使用的金属烯醇及它们的一些特点。
●锂烯醇
在THF等非质子性溶剂中,LDA或LHMDS等高位阻碱通过拔氢制得。这里使用高位阻碱的原因很简单,就是为了抑制它们对羰基的亲核进攻。
形成的锂烯醇的几何异构性常常受羰基底物的结构・使用的碱・溶剂等因素的影响。
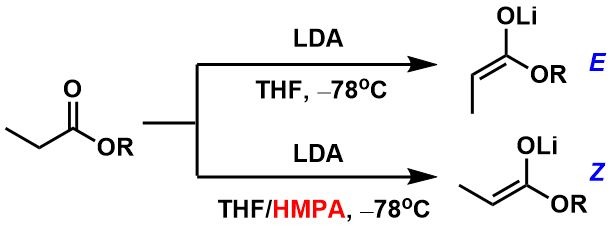
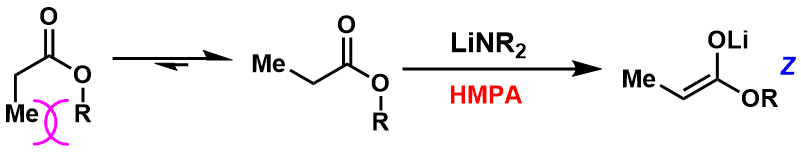
特别是在底物是酯且利用LDA拔氢的情况,HMPA的添加可以左右拔氢后烯醇的几何异构性。也就是说,通常该拔氢反应生成E-烯醇,而当添加HMPA后,发生逆转生成Z-烯醇。(图4)
图4:添加剂对烯醇几何异构性的影响
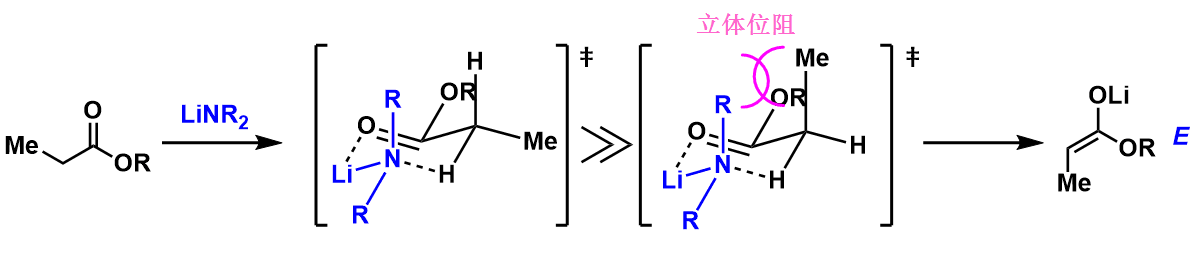
关于HMPA的添加效果在下图作了简要说明。其实,在未添加的情况下,首先底物酯与碱形成六元环过渡态,然后再发生拔氢反应(图5, Ireland模型)。而在添加HMPA的条件下,由于HMPA与碱的配位作用,阻碍了Li与底物形成六元环过渡态。从而形成更稳定的热力学支配的Z-烯醇。(图6)
图5:脱氢机理 (无HMPA添加)
图6:脱氢机理 (HMPA添加)
在上图中我们可以了解到通过LDA的拔氢作用可以得到动力学支配的E-烯醇。除了添加HMPA外,其他的条件也可以形成热力学支配的烯醇产物。也就是说,在适当提高温度,在可逆的平衡条件下,利用锂碱拔氢的话,也是可以得到热力学稳定的Z-烯醇(图7)。
图7:动力学支配或热力学支配的烯醇生成反应
如果可以有效控制烯醇的几何异构性的话,那么根据图3中的六元环过渡态,我们就可以准确预测aldol反应产物的立体结构。
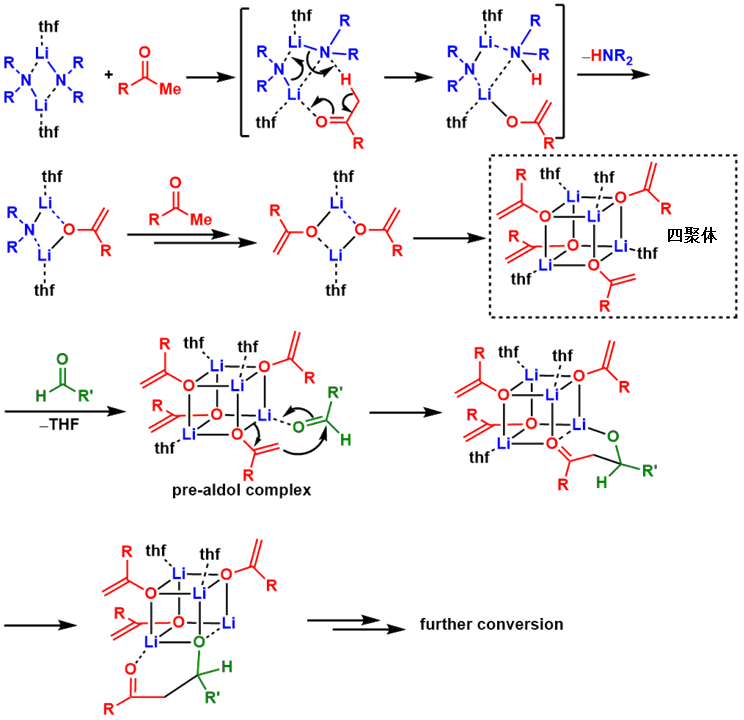
对于含Li的试剂,反应中Li试剂的自我聚合效应也是必须得考虑的(图8)。
在THF溶液中,对羰基化合物用LDA拔氢,在几步反应后底物与Li试剂与溶剂之间会形成4聚物(该结构已经通过结晶被确认)。非聚合的机理的话很简单,就是烯醇单体与另一分子的羰基化合物进行aldol反应,而4聚体的情况下,也就是下图所示保持4聚态进行反应。所以现在也一般认为有可能两者会同时进行,而他们两者的比例应该随着溶剂,添加剂,底物结构与碱的位阻有关。
图8:非解离(聚合态)反应机理
硼化烯醇
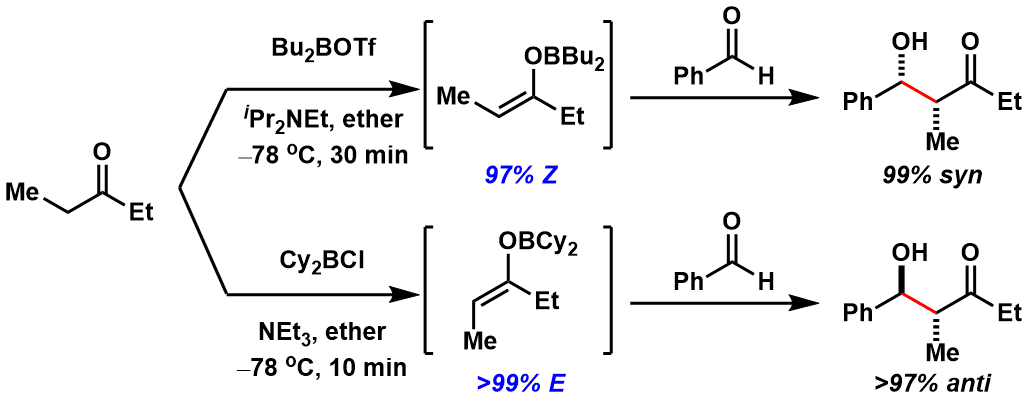
除了强碱金属作用形成烯醇以外,另外一个常见的就是利用具有路易斯酸性的硼酸化合物与高位阻的胺基联用形成烯醇后再发生aldol反应,此类在不对称ladol反应上的应用十分广泛。通过试剂的不同可以选择性的得到E/Z烯醇。(图9)
图9:硼酸化烯醇的立体控制
一般利用硼化烯醇的反应中,相对于金属化烯醇来说,得到的产物的立体选择性更佳。这是因为B-O键比Li-O键更短更强,从而形成的六元环过渡态也更加稳定所致。在图10中给出了一个具体实例供大家参考。
图10:锂金属烯醇与硼烯醇的差
硅化烯醇
金属烯醇由于稳定性差要精制分离十分困难,这是众所周知的。而硅取代的烯醇确十分稳定,有很多可以被纯化分离。这类烯醇在与羰基亲电试剂共存的条件下,利用TiCl4,SnCl4,TMSOTf等路易斯酸催化活化,可以有效得到aldol加成产物。这类反应最初是由东京大学的向山光昭教授研究室开发,所以一直被称为向山aldol反应(图11),该反应是有机合成化学也是aldol反应的一个里程碑成果。该反应的名气不在suzuki-cross coupling之下。
图11:向山aldol反応
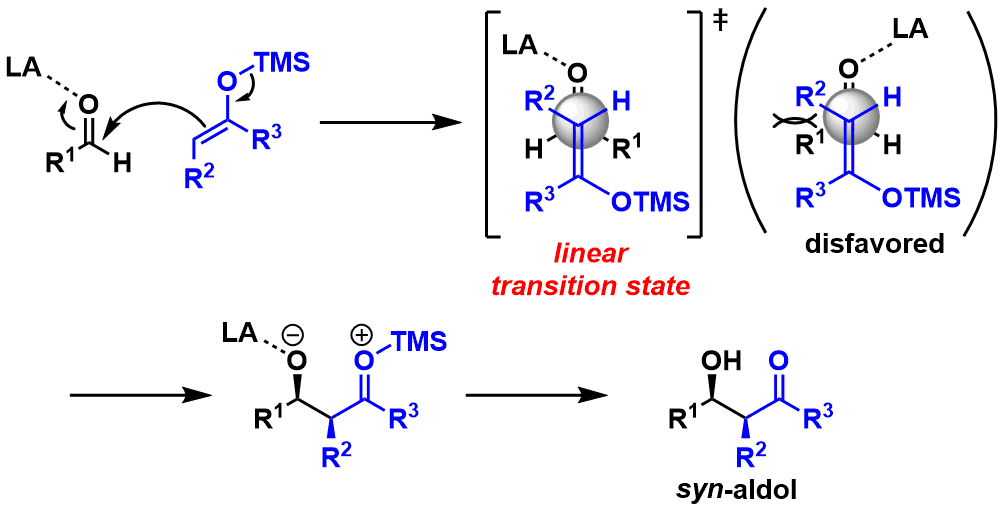
由于硅的Lewis选型太弱,所以无法形成上述一直提到的六元环过渡态,现在普遍认为硅化烯醇的aldol反应是依照线形过渡态进行的。与锂・硼代的烯醇相比,其立体选择性的控制相对来说要困难得多。产物的立体选择性收到底物的结构・Lewis算等条件的影响特别大,没有什么规律可循。(图12)
图12:向山aldol反应的机理
其他的如Ti, Sn, Zn等各种各样的金属烯醇法也有报道,而最常用的一般就是上述三种。
接下来,在下一弹中小编将介绍近年来开发出的使用手性辅助基进行的不对称aldol反应的研究。
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!