本文作者:杉杉
导读
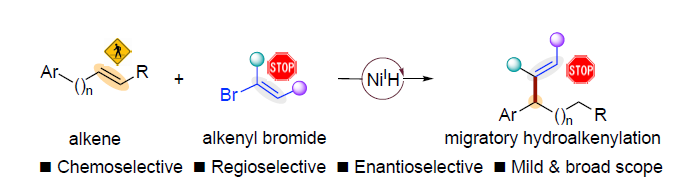
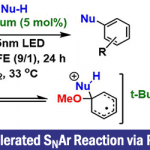
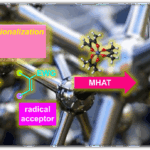
近日,南京大学朱少林教授课题组与上海大学龚和贵教授课题组共同合作在Angew. Chem. Int. Ed.上发表论文,报道了NiH催化的烯烃与烯基溴化物的迁移性加氢烯基化反应(hydroalkenylation),以高收率和优异的化学选择性获得苄位烯基衍生物。同时,温和的反应条件可阻止烯烃产物进一步的异构化或随后的烯基化(alkenylation)。此外,使用手性双噁唑啉配体可实现苯乙烯的催化对映选择性加氢烯基化反应。
Nickel-Catalyzed, Regio- and Enantioselective Benzylic Alkenylation of Olefins with Alkenyl Bromide
Jiandong Liu, Hegui Gong,* and Shaolin Zhu*
Angew. Chem. Int. Ed. ASAP DOI:10.1002/anie.202012614 https://doi.org/10.1002/anie.202012614
正文
过渡金属氢化物催化的烯烃异构化与过渡金属催化的交叉偶联的协同组合,可实现迁移性加氢官能团化。该反应使用易得的烯烃为原料,可作为实现远端定点C(sp3)-H官能团化的有效方案。同时,镍催化剂具有低成本且易获得多种氧化态的优点,已广泛用于偶联反应中。近期,已报道通过氢化镍催化,实现烯烃的远程加氢官能团化的反应,如在远端或近端C(sp3)-H位的芳基化、烷基化、硫醇化和胺化(Figure 1a)。在还原过程中,选择性官能化取决于以下假设,即交叉偶联底物可以选择性地捕获烯烃加氢金属化生成的烷基镍中间体,然后进行链行走。作者质疑,当使用经典的交叉偶联底物烯基溴化物时,该策略是否可以扩展到远端烯基化(Figure 1b)。同时,对于该反应也存在一些挑战(Figure 1c)。首先,烯烃、烯基卤化物和迁移性烯基化产物必须全部含有C=C双键,并且都可能与氢化镍发生链行走或烯基化过程。其次,由于不同烷基镍配合物具有相似的反应性,易获得异构体混合物。第三,NiH可以还原烯基溴化物。在此,南京大学朱少林教授课题组与上海大学龚和贵教授课题组合作报道了使用手性双噁唑啉配体,成功实现了不对称的加氢烯基化反应。
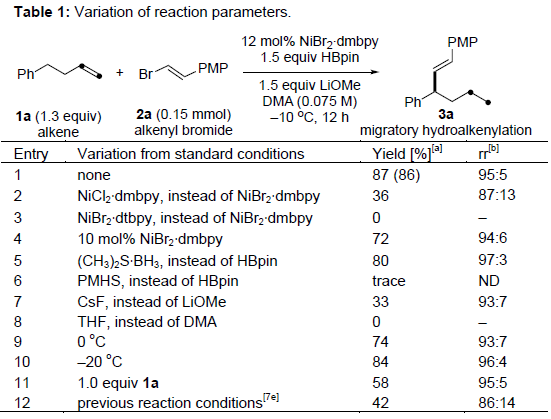
首先,作者以4-苯基-1-丁烯1a和溴代烯基苯甲醚2a作为模型底物,分别对镍催化剂、氢化物来源、碱和溶剂进行了筛选(Table 1)。最终,当以NiBr2•dmbpy作为催化剂,HBpin作为氢化物来源,LiOMe作为碱,可在-10 ℃的DMA溶剂中获得86%收率的目标产物3a,区域异构体比率(rr)为95:5。
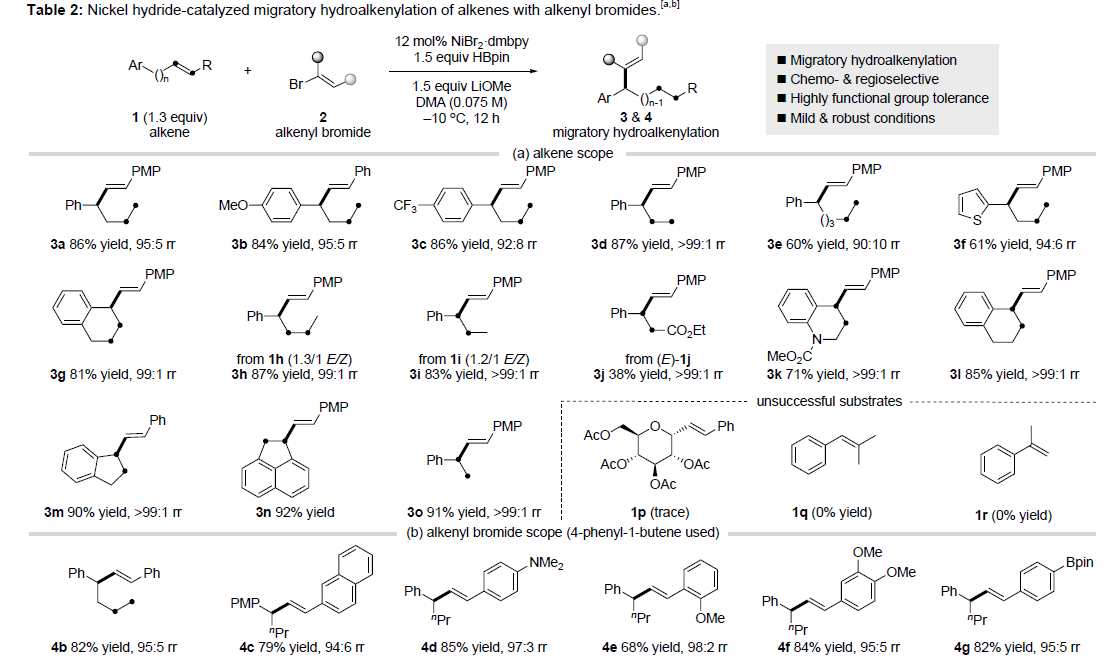
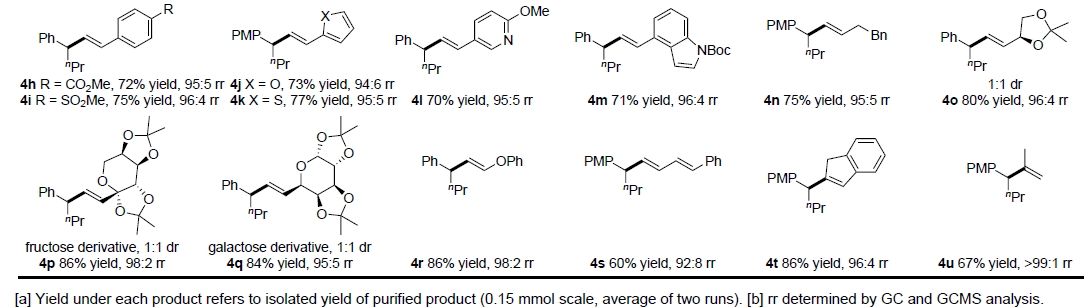
在获得上述最佳反应条件后,作者开始对烯烃1和烯基溴化物2进行了扩展(Table 2)。首先,对烯烃1底物的扩展表明,单取代的末端烯烃(3a-3e)、空间位阻较小的内烯烃(3g,3h)、杂环噻吩(3f)以及β-(未)取代的苯乙烯(3o,3i-3n)均可顺利进行反应。然而,在标准条件下(1p-1r),在α-或β-位具有空间位阻的苯乙烯均为不合适的底物。其次,在对烯基溴化物2的扩展表明,在芳烃上含有富电子基(4d,4e)或缺电子基(4f-4i)、杂环化合物(如呋喃4j,噻吩4k,吡啶4l或吲哚4m)以及β-烷基取代(4n-4q)和β-苯氧基取代(4r)的底物,均可顺利进行反应。然而,当使用1,3-二烯基溴化物(4s)作为底物时,区域选择性略有降低。值得注意的是,α-烷基取代的烯基溴化物(4t,4u)也是有效的偶联底物。
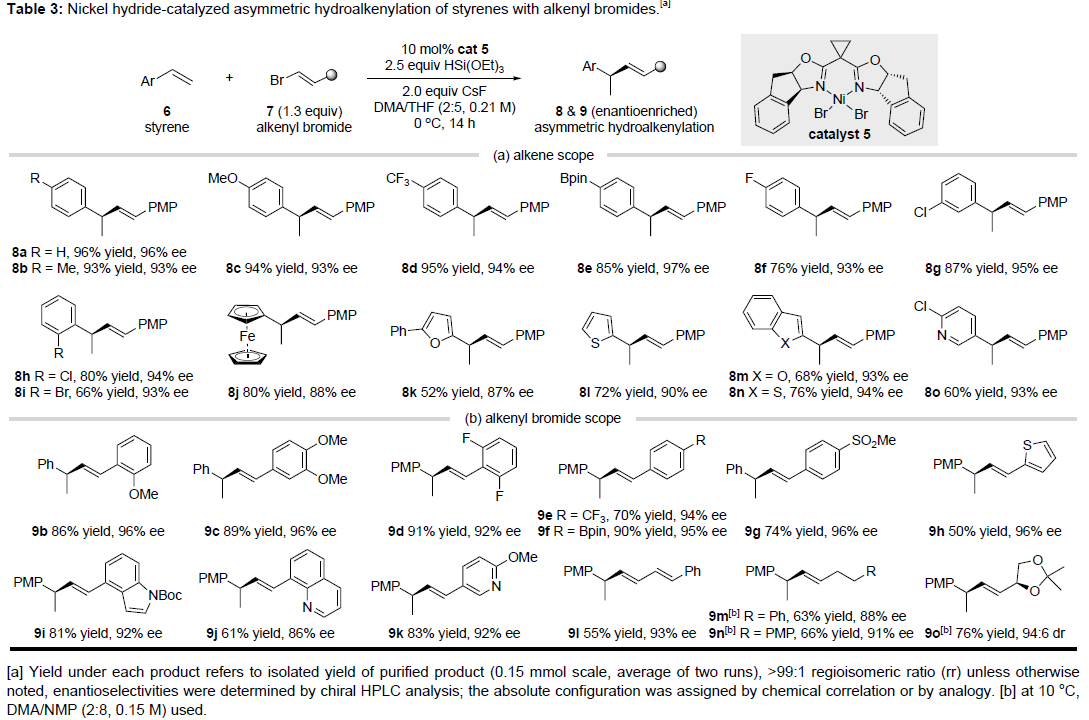
随后,作者使用手性镍-双(噁唑啉)催化剂5,对苯乙烯6与烯基溴化物7进行了相关不对称反应的研究(Table 3)。苯乙烯的芳环上不受电子效应和定位效应的影响,均可获得相应的产物8a-8i。烯基二茂铁(8j)也可以进行反应,从而获得高度对映体富集的二茂铁衍生物。同时,杂环底物(如呋喃(8k),噻吩(8l),苯并呋喃(8m),苯并噻吩(8n)和吡啶(8o))同样取得预期的结果。此外,烯基溴化物的芳环上带有富电子(9b)或缺电子(9c-9g)以及β-杂芳基(9h-9k)均可顺利的地进行反应。此外,1,3-二烯基溴化物(9l)反应平稳,β-烷基取代的烯基溴化物(9m-9o)也是合适的底物,但ee略有降低。
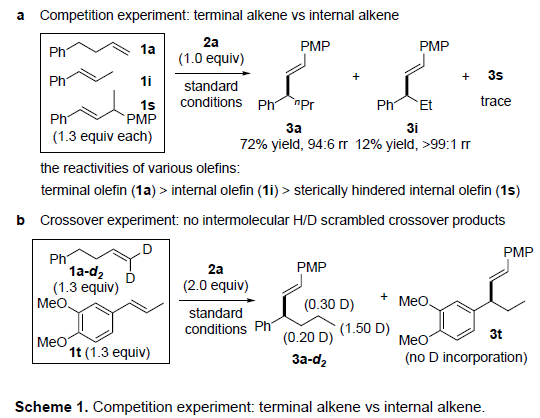
为了进一步了解反应的机理,作者进行了相关的对照实验(Scheme 1)。通过比较不同类型C=C键的相对反应性,作者使用等量的三种烯烃(1a,1i和1s)于标准条件下反应,反应结果表明(空间效应影响),单取代的烯烃(1a)>内烯烃(1i)>空间受阻的内烯烃(1s),这与上述反应中观察到的出色的化学选择性一致(Scheme 1a)。此外,使用氘标记的烯烃(1a-d2)和未氘化的烯烃(1t)的1:1混合物进行反应时,没有获得H/D交叉产物,这表明链行走过程可在没有NiH从烯烃解离的情况下进行(Scheme 1b)。
总结
南京大学朱少林教授课题组与上海大学龚和贵教授课题组报道了通过镍催化,实现烯烃与烯基溴化物的迁移性加氢烯基化反应,具有广泛的底物范围,优异的区域选择性和化学选择性。值得注意的是,烯基化仅发生在苄基位置,并且产物没有进一步的异构化或随后的烯基化。此外,使用手性双噁唑啉配体时,还实现了苯乙烯的催化对映选择性加氢烯基化反应。





















No comments yet.