导读
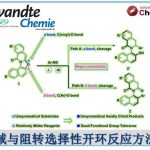
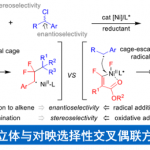
轴手性苯乙烯衍生物是一种新型的轴手性化合物,可作为手性配体用于不对称合成中。因此,轴手性苯乙烯衍生物的不对称合成成为化学家们关注的焦点。早期的研究主要集中在利用手性到轴手性转化的策略构建轴手性二芳基化合物。随着时代的发展,关于不对称合成轴手性芳基环己烯化合物的研究也有了一定的进展,但稳定性较低的轴手性苯乙烯衍生物的不对称合成仍然面临巨大的挑战。到目前为止,合成不对称轴手性苯乙烯衍生物的策略只有Tan课题组和Yan课题组开发的有机催化的不对称加成反应这一种[1]。
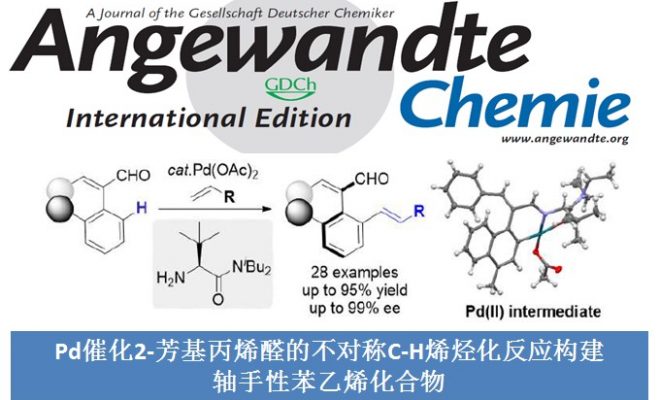
最近,不对称C-H官能团化反应已经成为快速合成联芳基轴手性化合物强有力的方法。受到Yu课题组报道的瞬态手性辅基(TCA)催化不对称C-H官能团化反应构建碳中心手性化合物[2]的启发,浙江大学史炳锋课题组成功开发了利用TCA策略构建一系列联芳基轴手性化合物的报道[3]。出于对利用TCA策略构建轴手性苯乙烯衍生物的极大兴趣,史炳锋课题组成功报道了Pd催化2-芳基丙烯醛与丙烯酸丁酯的不对称C-H烯基化反应,能以良好至优秀的收率和对映选择性得到一系列轴手性苯乙烯化合物,其中大位阻的氨基酰胺作为瞬态手性辅基对反应对映选择性的控制发挥着重要作用。相关研究成果发表于
“Synthesis of Axially Chiral Styrenes via Pd-Catalyzed Asymmetric C-H Olefination Enabled by an Amino Amide Transient Directing Group”
Hong Song, Ya Li, Qi-Jun Yao, Liang Jin, Lei Liu, Yan-Hua Liu, Bing-Feng Shi*Angew. Chem. Int. Ed. 2020, 59, 6576. DOI: 10.1002/anie.201915949
Scheme 1 轴手性苯乙烯化合物的不对称合成
论文概要
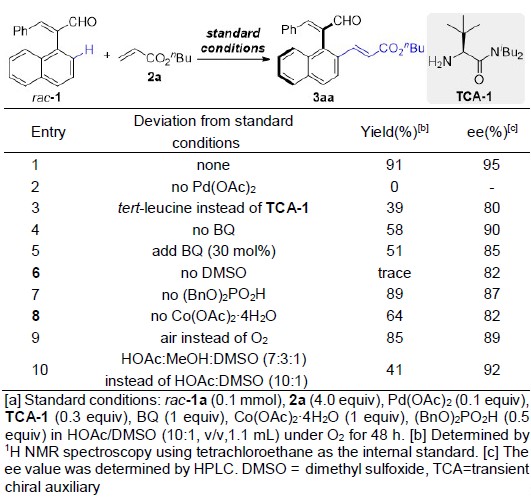
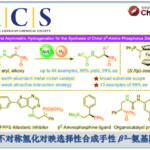
以2-萘基-3-苯基丙烯醛1a和丙烯酸丁酯2a为模板底物,作者对催化剂、溶剂、添加剂等反应条件进行反复筛选,确定最佳反应条件(Table 1):在氧气存在下,10 mol% Pd(OAc)2为催化剂,0.3 equiv TCA-1为瞬态手性辅基,1.0 equiv Co(OAc)2·4H2O和1.0 equiv BQ为共氧化剂,5 equiv (BnO)2PO2H为添加剂,HOAc/DMSO为溶剂,在40 oC条件下反应48小时,能以91%的收率和95%的对映选择性得到相应轴手性产物3aa。
Table 1 条件筛选
在最佳反应条件下,作者首先考察了丙烯醛的底物范围。2-甲基、乙基、异丙基取代的肉桂醛衍生物能较好地适应上述最佳条件,能以良好的收率和良好至优良的对映选择性得到相应产物,但2-丁氧基取代的肉桂醛衍生物则只能得到外消旋产物。各种4位取代的2-萘基-3-苯基丙烯醛以及各种供电子基团取代的肉桂醛衍生物均能较好的适应上述反应条件,能以中等至良好的收率和优良的阻转选择性获得相应产物,但大位阻叔丁基等烷基取代的肉桂醛衍生物只能以相对较低的收率获得相应产物。
接下来,作者对烯烃的底物范围进行了考察(Table 2)。各种丙烯酸酯、烯基膦酸酯、苯磺酸酯、各种吸电子基团取代的苯乙烯以及天然产物衍生的丙烯酸酯都能够与2-异丙基取代的肉桂醛衍生物反应,并且以良好的收率和优良的对映选择性相应轴手性产物。同时,脂肪族烯烃也能适应上述反应条件,然而,只能以较低的收率和优良的对映选择性得到相应产物。
Table 2 底物扩展
为了证明反应的应用潜力,作者进行了克级放大合成反应和一系列相应轴手性产物的合成转化。扩大化反应能正常进行,能以84%的收率和98%的对映选择性得到化合物3db。3db可被被氧化为相应的羧酸产物或可选择性还原醛基,生成相应的醇。3db的酯基可发生水解反应,得到相应的羧酸产物。同时,Co(III)和产物4dl能作为催化剂催化Matsunaga课题组[4]报道的硫酰胺的对映选择性C(sp3)-H酰胺化反应,能以73%的收率和64%的对映选择性得到相应产物。
论文总结评价
浙江大学史炳锋课题组成功报道了Pd催化2-芳基丙烯醛与丙烯酸丁酯的不对称C-H官能团化反应,能以良好至优秀的收率和阻转选择性得到一系列轴手性苯乙烯化合物,其中,大位阻的氨基酰胺作为瞬态手性辅基对反应阻转选择性的控制发挥着重要作用。
参考文献
- [1] (a) S.-C. Zheng, S. Wu, Q. Zhou, L. W. Chung, L. Ye, B. Tan, Nat. Commun. 2017, 8, 15238. DOI: 10.1038/ncomms15238. (b) S. Jia, Z. Chen, N. Zhang, Y. Tan, Y. Liu, J. Deng, H.-L. Yan, J. Am. Chem. Soc. 2018, 140, 7056. DOI: 10.1021/jacs.8b03211 (c) Y. Tan, S.-Q. Jia, F.-L. Hu, Y.-D. Liu, L. Peng, D.-M. Li, H.-L. Yan, J. Am. Chem. Soc. 2018, 140, 16893. DOI: 10.1021/jacs.8b09893
- [2] F-L. Zhang, K. Hong, T.-J. Li, H. Park, J.-Q. Yu, Science, 2016, 351,252. DOI: 10.1126/science.aad7893
- [3] G. Liao, H.-M. Chen, Y.-N. Xia, B. Li, Q.-J. Yao, B.-F. Shi, Angew. Chem. Int. Ed. 2019, 58, 11464. DOI: 10.1002/anie.201906700
- [4] S. Fukagawa, Y. Kato, R.Tanaka, M. Kojima, T. Yoshino, S. Matsunaga, Angew. Chem. Int. Ed. 2019, 58, 1153. DOI: 10.1002/anie.201812215
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!




















No comments yet.