本文作者:杉杉
导读:
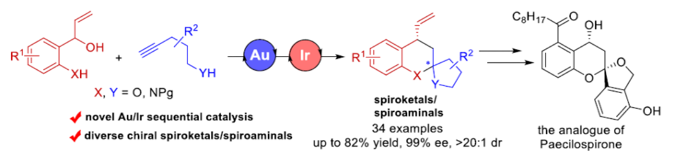
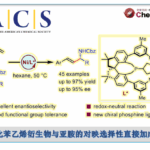
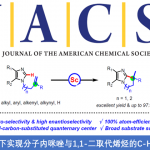
近日,华东理工大学的邓卫平与杨武林课题组在Angew. Chem. Int. Ed.中发表论文,报道一种全新的通过金与铱串联催化的外消旋2-(1-羟基烯丙基)酚与炔醇/炔酰胺之间的对映选择性烯丙基化/螺缩酮化反应方法学,进而成功完成一系列手性螺缩酮以及螺缩醛胺 (spiroaminals)分子的构建。同时,该小组进一步发现,采用外消旋2-(1-羟基烯丙基)苯胺作为反应底物时,则能够通过相关的KR过程,进而分别获得各类对映富集的螺缩醛胺以及相应的手性2-(1-羟基烯丙基)苯胺起始原料。
Enantioselective Synthesis of Spiroketals and Spiroaminals via Gold and Iridium Sequential Catalysis
Yang, X. Shang, X. Luo, W. Deng, Angew. Chem. Int. Ed. 2022, ASAP. doi: 10.1002/anie.202203661.
正文:
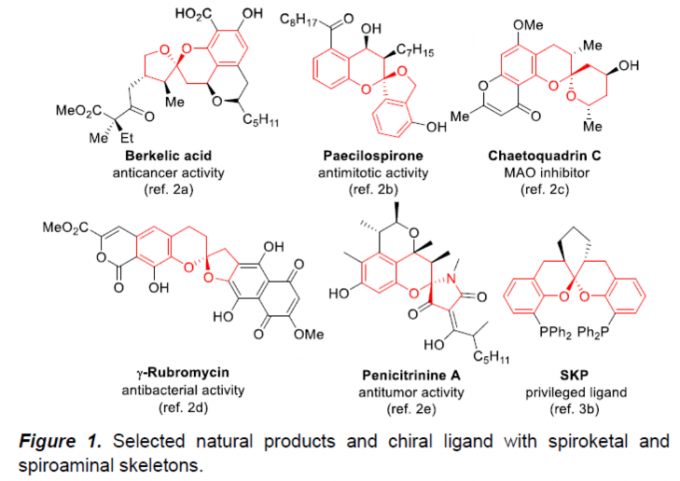
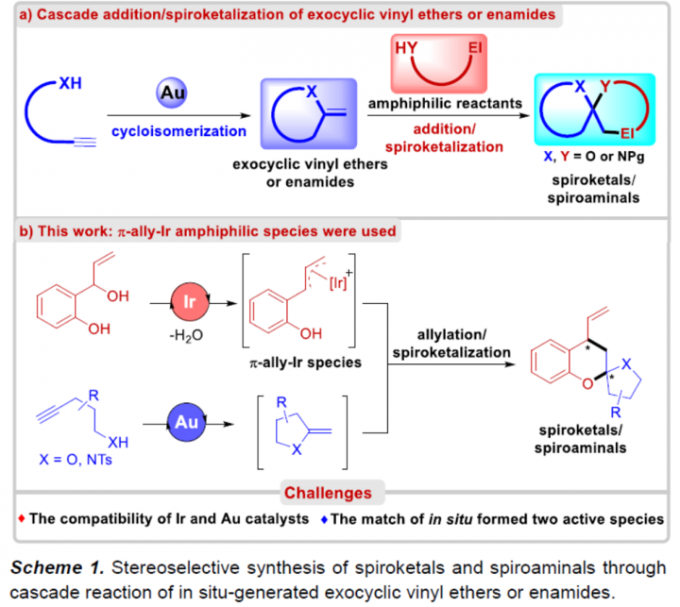
螺缩酮结构单元广泛存在于一系列生物活性天然产物以及各类药理活性分子中 (Figure 1)。同时,螺缩酮骨架同样存在于各类重要的手性配体中[1]。而且,在过去的几十年里,已经成功设计出多种用于构建对映富集的螺缩酮分子的合成转化策略[2]-[3]。尤其采用环外乙烯基醚 (exocyclic vinyl ethers)或烯酰胺与各类两亲性底物进行的串联加成/螺缩酮反应方法学的相关研究,已经备受诸多研究团队的广泛关注[4]-[6] (Scheme 1a)。然而,对于选择其他两亲性砌块进一步构建结构更为多样化的螺缩酮分子,则仍有待进一步研究。这里,受到本课题组前期对于将新型π-ally-Ir两亲性配合物应用于构建对映富集的benzo[b]oxocines分子[7]相关研究报道的启发,华东理工大学的邓卫平与杨武林团队成功设计出一种全新的通过Au/Ir-催化剂促进的2-(1-羟基烯丙基)苯酚与炔醇/炔酰胺之间的环异构化/烯丙基化/螺缩酮化反应方法学,进而顺利完成一系列手性螺缩酮与螺缩醛胺分子的构建(Scheme 1b)。
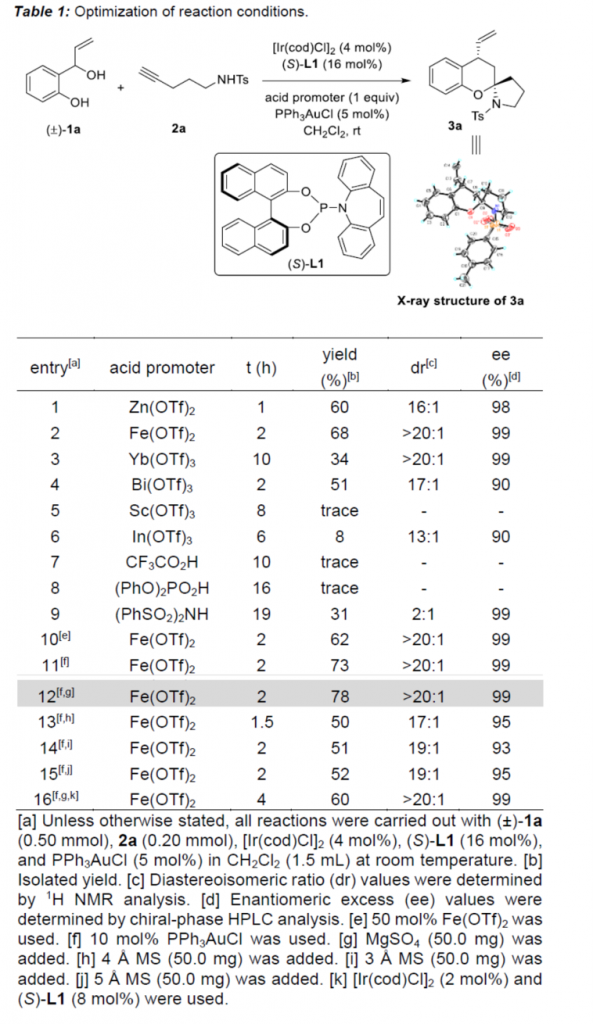
首先,作者采用2-(1-羟基烯丙基)苯酚(±)-1a与炔酰胺2a作为模型底物,进行相关反应条件的优化筛选 (Table 1)。进而确定最佳的反应条件为:采用[Ir(cod)Cl]2与AuPPh3Cl作为催化剂,(S)-L1 (Carreira P-olefin ligand)作为手性配体,MgSO4作为添加剂,Fe(OTf)2作为酸促进剂 (acid promoter),CH2Cl2作为反应溶剂,反应温度为室温,最终获得78%收率的手性产物3a (>20:1 dr, 99% ee)。
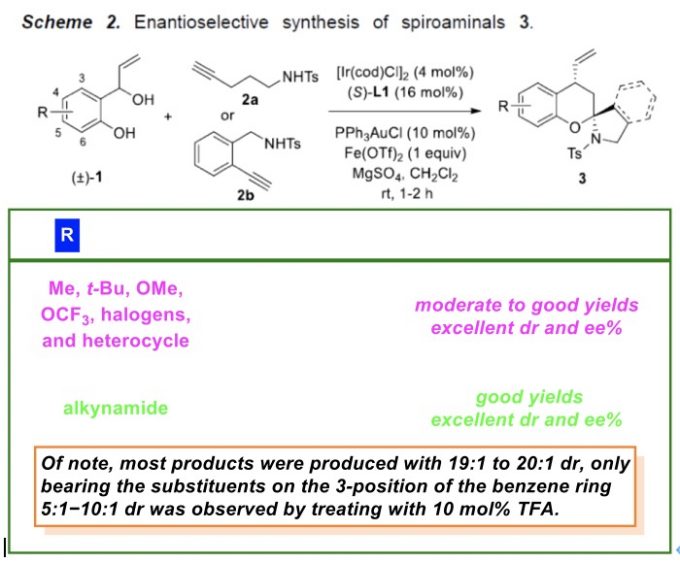
在上述的最佳反应条件下,作者对一系列2-(1-羟基烯丙基)酚 (Scheme 2 )的应用范围进行深入研究。
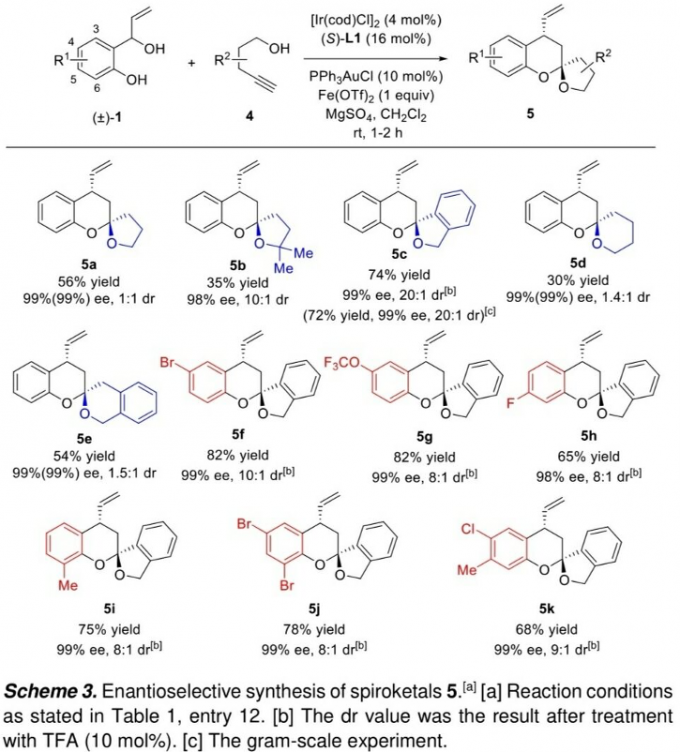
之后,该小组将上述的标准反应体系进一步应用于一系列螺缩酮分子的构建 (Scheme 3)。
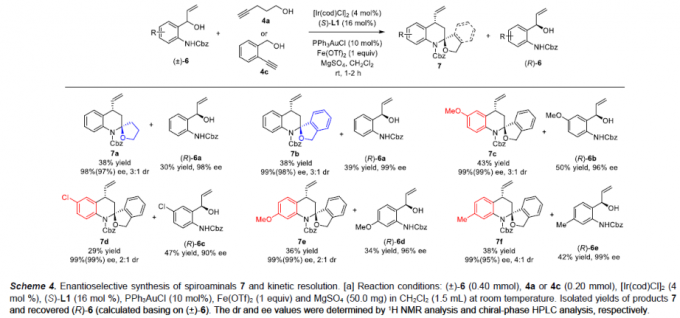
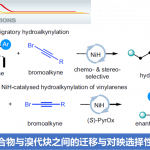
同时,作者发现,上述的标准反应条件对于一系列不同基团取代的2-(1-羟基烯丙基)苯胺底物 (±)-6同样能够有效地兼容,并以中等程度的反应收率以及以及优良的对映选择性,获得预期的螺缩醛胺产物 (Scheme 4)。
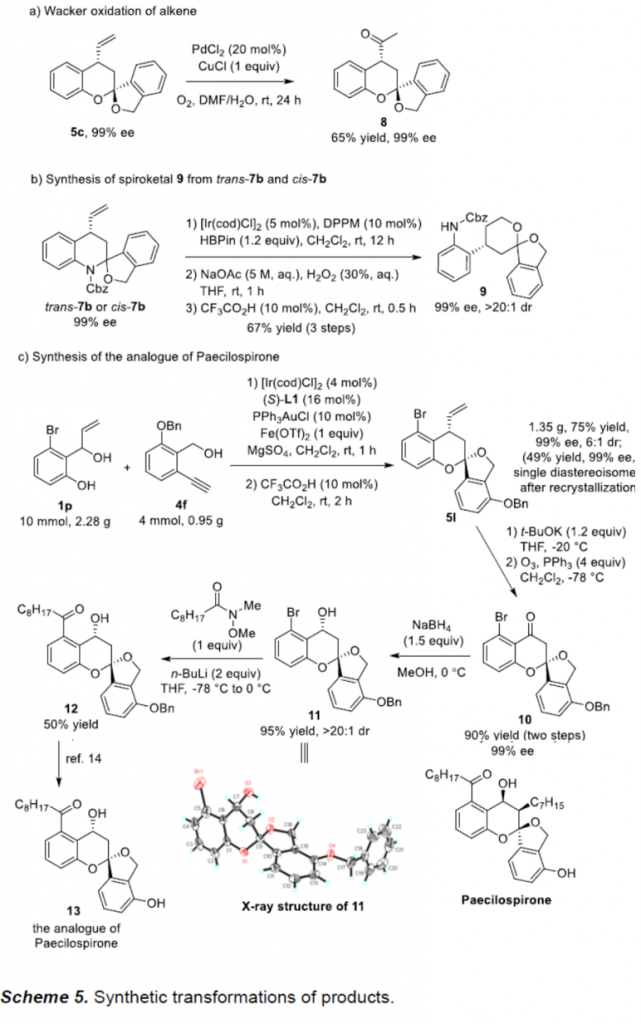
之后,该小组通过如下的一系列研究进一步表明,这一全新的串联反应策略具有潜在的合成应用价值(Scheme 5)。
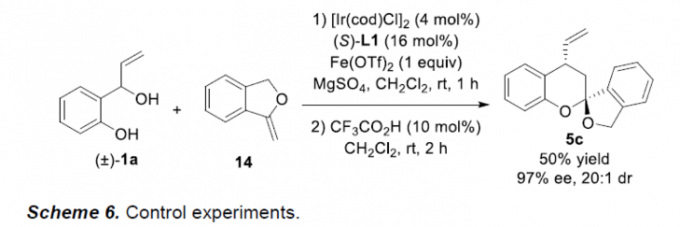
接下来,作者通过一系列相关的控制实验 (Scheme 6)研究表明,反应过程中可能涉及Au催化的环异构化(cycloisomerization)以及Ir催化的分步烯丙基化/螺缩酮化的串联反应路径。
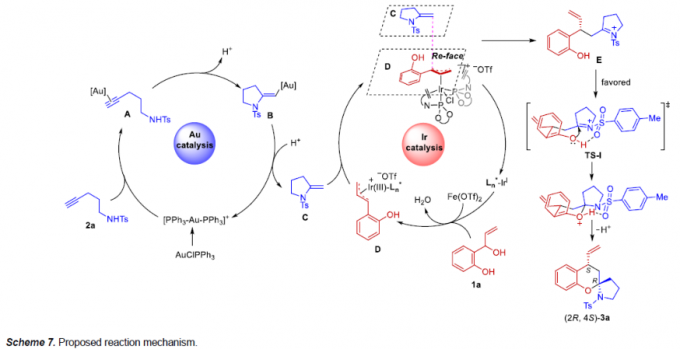
基于上述的实验研究以及前期相关的文献报道[8]-[9],作者提出如下合理的反应机理以及相关的对映选择性控制模型 (Scheme 7)。
总结:
华东理工大学的邓卫平与杨武林课题组报道一种全新的通过金与铱串联催化的外消旋2-(1-羟基烯丙基)苯酚与炔醇/炔酰胺之间的对映选择性烯丙基化/螺缩酮化反应方法学,进而成功完成一系列手性螺缩酮与螺缩醛胺 (spiroaminals)分子的构建。同时,该小组进一步发现,采用外消旋2-(1-羟基烯丙基)苯胺作为反应底物时,则能够通过相关的KR过程,分别获得对映体富集的螺缩醛胺以及相应的手性2-(1-羟基烯丙基)苯胺底物。这一全新的对映选择性合成转化策略具有高度的非对映选择性与优良的对映选择性以及良好的合成应用价值等优势。
参考文献:
- [1] (a) X. Wang, Z. Han, Z. Wang, K. Ding, Acc. Chem. Res. 2021, 54, 668. doi: 10.1021/acs.accounts.0c00697.
- (b) J. Huang, M. Hong, C. Wang, S. Kramer, G. Lin, X. Sun, J. Org. Chem. 2018, 83, 12838. doi:10.1021/acs.joc.8b01693.
- [2] (a) M. Wilsdorf, H. U. Reissig, Angew. Chem. Int. Ed. 2012, 51, 9486. doi: 10.1002/anie.201203847.
- (b) R. Quach, D. F. Chorley, M. A. Brimble, Org. Biomol. Chem. 2014, 12, 7423. doi: 10.1039/C4OB01325E.
- (c) R. Quach, D. P. Furkert, M. A. Brimble, Org. Biomol. Chem. 2017, 15, 3098. doi: 10.1039/C7OB00496F.
- [3] (a) N. Liu, W. Zhu, J. Yao, L. Yin, T. Lu; X. Dou, ACS Catal. 2020, 10, 2596. doi: 10.1021/acscatal.9b05577.
- (b) L. Zhou, W. Yan, X. Sun, L. Wang, Y. Tang, Angew. Chem. Int. Ed. 2020, 59, 18964. doi: 10.1002/anie.202007068.
- [4] S. Yu, L. Gao, Y. Yan, Z. Yin, Y. Shang, Chin. J. Org. Chem. 2021, 41, 582. doi: 10.6023/cjoc202006050.
- [5] (a) W. Mao, S. Lin, L. Zhang, H. Lu, J. Jia, Z. Xu, Org. Chem. Front. 2020, 7, 856. doi: 10.1039/D0QO00022A.
- (b) H. Wang, T. Zeng, X. Li, S. Wang, W. Xiao, L. Liu, W. Chang, J. Li, Org. Chem. Front. 2020, 7, 1809. doi:10.1039/D0QO00464B.
- (c) T. Zeng, J. Kong, H. Wang, L. Liu, W. Chang, J. Li, Adv. Synth. Catal. 2021, 363, 4024. doi: 10.1002/adsc.202100523.
- [6] (a) H. Wu, Y. He, L. Gong, Org. Lett. 2013, 15, 460. doi: 10.1021/ol303188u.
- (b) L. Cala, A. Mendoza, F. J. Fañanás, F. Rodríguez, Chem. Commun. 2013, 49, 2715. doi: 10.1039/C3CC00118K.
- (c) J. Li, L. Lin, B. Hu, X. Lian, G. Wang, X. Liu, X. Feng, Angew. Chem. Int. Ed. 2016, 55, 6075. doi:10.1002/anie.201601701.
- [7] W. Yang, Y. Wang, W. Li, B. Gu, S. Wang, X. Luo, B. Tian, W. Deng, ACS Catal. 2021, 11, 12557. doi:10.1021/acscatal.1c03711.
- [8] D. Li, K. Shi, X. Mao, Z. Zhao, X. Wu, P. Liu, Tetrahedron 2014, 70, 7022. doi: 10.1016/j.tet.2014.06.078.
- [9] (a) S. L. Rössler, S. Krautwald, E. M. Carreira, J. Am. Chem. Soc. 2017, 139, 3603. doi: 10.1021/jacs.6b12421.
- (b) B. Bhaskararao, R. B. Sunoj, J. Am. Chem. Soc. 2015, 137, 15712. doi: 10.1021/jacs.5b05902.
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载



















No comments yet.