本文投稿作者 孙苏赟
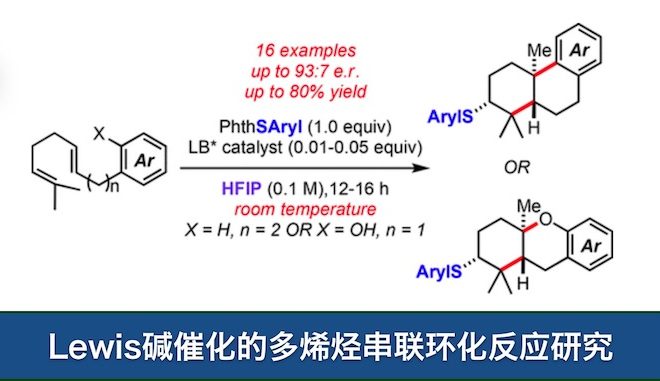
多烯烃的环化是仿生合成中的一个常见的反应。在环化反应中,反应底物烯烃的结构往往已经预设了产物的碳原子的立体构型,例如角鲨烯到羊毛甾醇的转化过程中,首先是一个立体专一的环氧化反应,之后再进行串联环化反应的1,2。此外还有一些手性Lewis酸或Brønsted酸催化的环化反应3-5。
近期,UIUC的Denmark课题组在JACS上发表了一篇关于立体专一的、Lewis碱催化的、硫酚引发的多烯烃串联环化反应。
Enantioselective, Lewis Base-Catalyzed Sulfenocyclization of Polyenes
Zhonglin Tao, Kevin A. Robb, Kuo Zhao, and Scott E. Denmark
J. Am. Chem. Soc., 2018, 140, 3569–3573
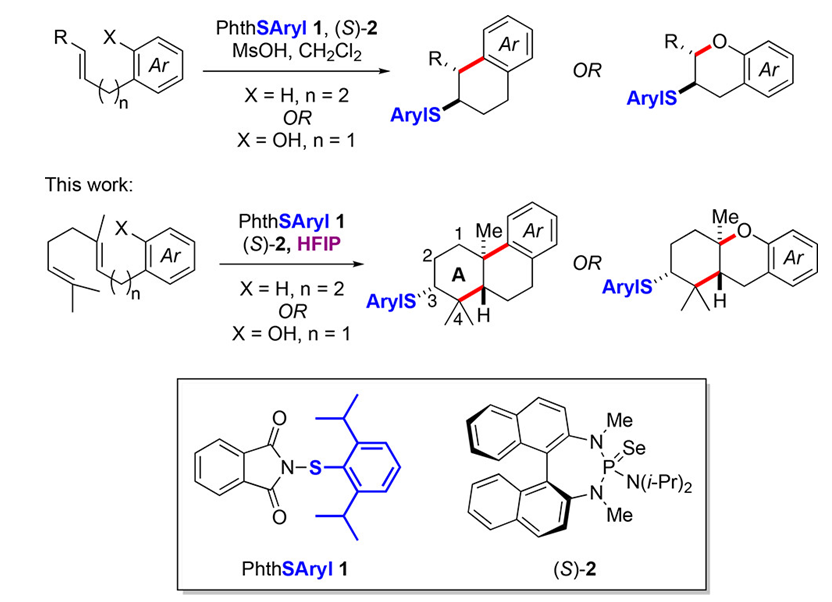
Scheme 1
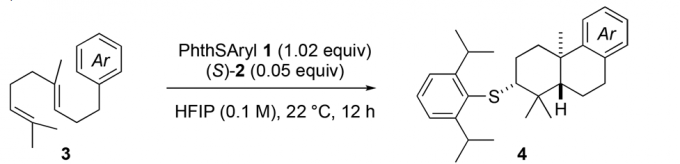
在3到4的转化过程之中,一开始的测试条件是1,(S)-2和MsOH,以DCM为溶剂,但是结果并不好,产率较低但是立体选择性却较好,之后条件筛选发现HFIP为最佳溶剂,其原因是可以抑制链中的双键直接发生反应6,并且MsOH可以更加优秀的发挥效果。在此改进的条件下,进行了一系列的反应底物的测试,见Table 1。
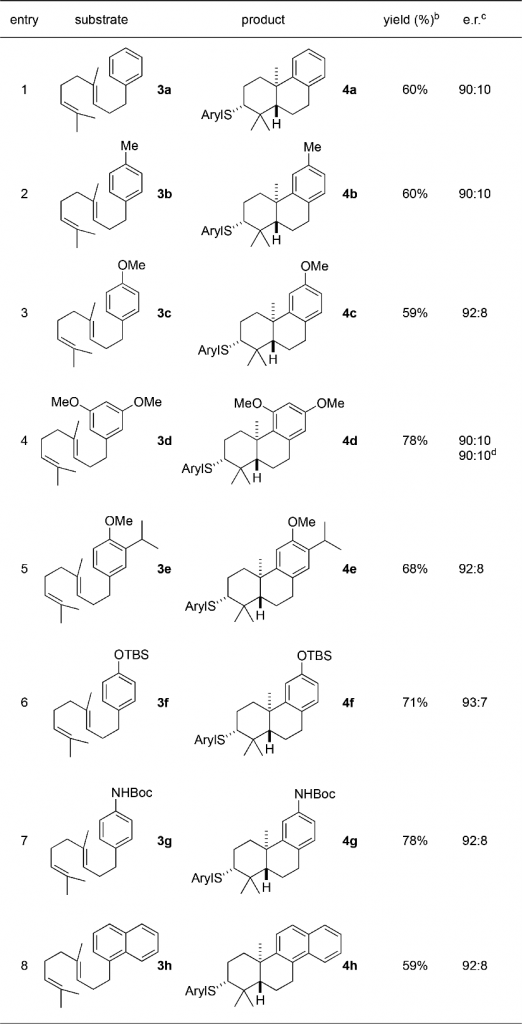
Table 1单香叶基底物的测试
底物3a-3d具有一个或多个供电基团,它们的产率均高于59%;其中3e的环化产物4e的结构在很多天然产物中都可以找到,虽然3e的结构对称性不是很好,但是4e只有一个异构体产物,er高达92/8;含有硅的底物3f的产率也很不错;N-Boc保护的苯胺衍生物3g的产率为78%,er92/8;3h为稠环烃的底物的例子,产率59%,er 92/8。此外,苯环上被吸点集团取代的底物大都难以高效的发生环化反应,产物也十分复杂。
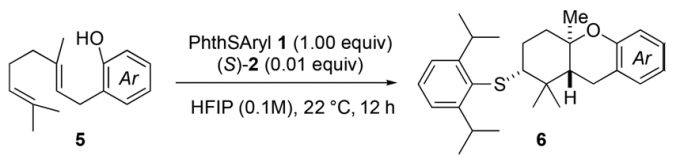
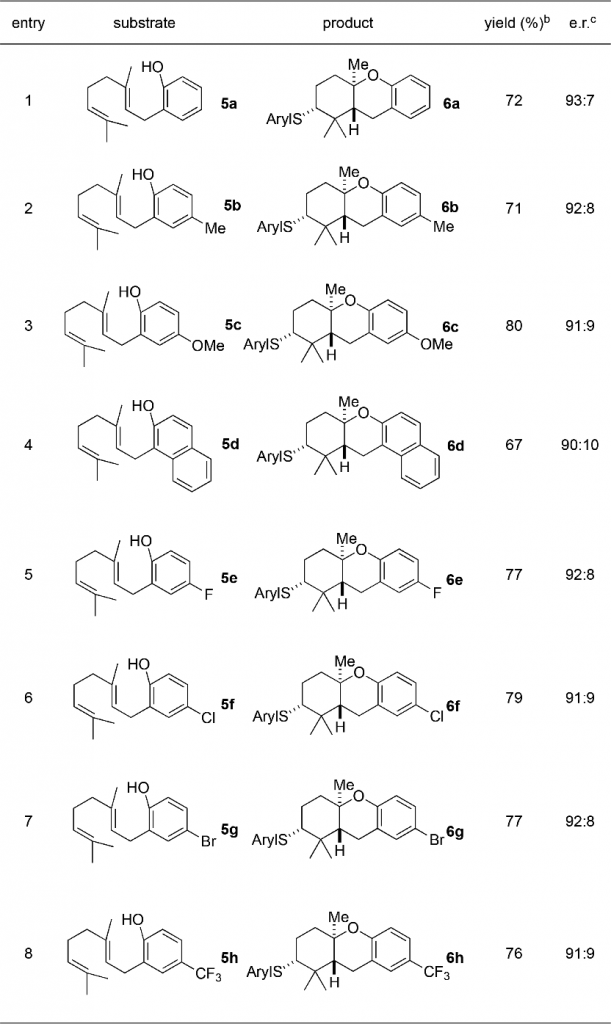
这样的反应体系之后也在邻位取代的苯酚衍生物上进行了试验,其中酚羟基作为端位官能团的功能,电子效应不同的一系列底物5进行高产率地、立体转移地环化反应得到6。5a和一些具有供电基团的底物5b-5c的底物的产率都高于70%;萘酚衍生物5d的反应性也很好。但是和上一个反应不同,含有吸电基团的底物5e-5h也可以很好的进行反应,立体选择性在90/10甚至更高。其中可以看到,被氧取代的底物的稍微更高一些,可能是因为更易捕捉阳离子的缘故。
Table 2临位取代的酚的环化反应
方法学的开发终究是为了有机合成而服务的。尽管产物中二异丙苯基给结构形成了很大的空间位阻,但是硫原子的反应活性还是非常高的,产物可以进行Scheme 2中的一系列转化,例如4b可以被mCPBA选择性的氧化成为11b,再进行脱硫得到12b为产物。
Scheme 2反应产物在合成上的应用
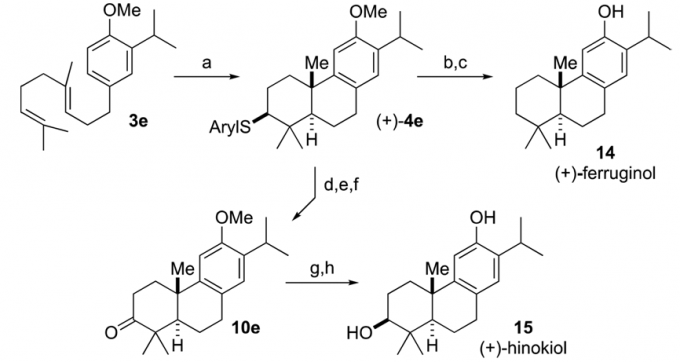
这个环化反应的产物也可以用于天然产物14(+)-ferruginol和15 (+)-hinokiol的全合成中去,这两个化合物都是三环化合物,但是此前还没有人通过多烯烃环化反应合成出14,虽然15的全合成工作已经完成,但是合成中的反应底物就已经具有了手性。
Scheme 3在天然产物全合成上的应用
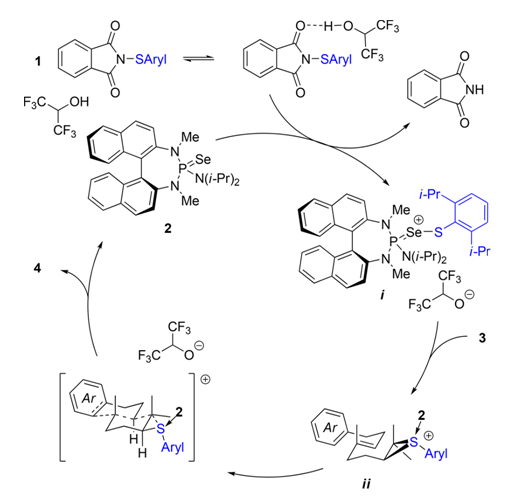
根据之前对于机理的研究7可以推断出类似的循环催化的机理,由HPIP座位质子供体,1将硫转移到2上形成离子配合物i,这个高度亲电的配合物可以和端位双键发生反应得到中间体ii,之后ii进行立体专一的阳离子环化过程得到产物,并且脱去2来进行下一次催化循环过程。
Figure 1可能的反应机理
这篇文章中报道了两种Lewis碱催化的多烯烃串联环化反应,这个反应的产物再合成上具有很广阔的应用。
参考文献
- J. Am. Chem. Soc. 1966, 88, 4750−4751. DOI:10.1021/ja00972a056
- J. Am. Chem. Soc. 1966, 88, 4752−4754. DOI:10.1021/ja00972a058
- J. Am. Chem. Soc.1999, 121, 4906−4907. DOI:10.1021/ja984064+
- J. Am. Chem. Soc. 2001, 123, 1505−1506. DOI:10.1021/ja003541x
- J. Org. Lett. 2004, 6, 2551−2554. DOI:10.1021/ol049126h
- J. Am. Chem. Soc. 2018, DOI: 10.1021/jacs.8b00113.
- Nature. Chem. 2014, 6, 1056−1064. DOI:10.1038/nchem.2109
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!




















No comments yet.