本文作者:海猫
导读
近日,长沙理工大学的杨荣华教授课题组在分析化学杂志上发表论文,报道了第一个光控的酪氨酸荧光探针,将已有的酶促探针用光不稳定基团来掩蔽,只有在光与酪氨酸酶激活相继进行的情况下,荧光探针才能开启。该探针具有良好的选择性和高的灵敏度(检测限为0.08 U/mL)。并且,该探针可以用于细胞内的荧光成像,在光控条件下检测内源性的酪氨酸酶活性,从而为在生理学和病理学中了解该酶的功能提供了一种检测方法。该顺序激活策略还有潜力应用在光控检测更多的酶活性中。
Substrate-Photocaged Enzymatic Fluorogenic Probe Enabling Sequential Activation for Light-Controllable Monitoring of Intracellular Tyrosinase Activity
Sheng Yang, Jiaxing Jiang, Anxin Zhou, Yibo Zhou, Wenling Ye, DongSheng Cao, and Ronghua Yang
Anal. Chem. ASAP DOI: 10.1021/acs.analchem.0c00746
正文
酪氨酸酶,一个含铜的单加氧酶,可催化酚类底物的羟基化反应和随后的氧化反应生成醌的衍生物,可引发黑色素细胞的黑色素生成。这种酶被认为是黑色素瘤的生物标志物,因为它的过表达在黑色素瘤的发展中起着至关重要的作用。此外,酪氨酸酶对帕金森病的多巴胺神经毒性和神经退行性有影响。因此,实时监测酪氨酸酶在生命系统中的活性对于详细阐明其生理功能和病理作用是有意义的。
基于底物设计的小分子酶促荧光探针因其高特异性、灵敏性和非侵入性等特征而成为了可视化活生物体中酶活性的有效工具。迄今为止,已经通过分子工程对一系列具有特定酪氨酸酶底物的荧光团进行了酪氨酸酶激活的荧光探针的开发。然而,在活细胞中没有对这些传统探针进行精确的控制,这阻碍了他们在不同的生理和病理阶段动态跟踪和对酪氨酸酶活性成像的进一步应用。
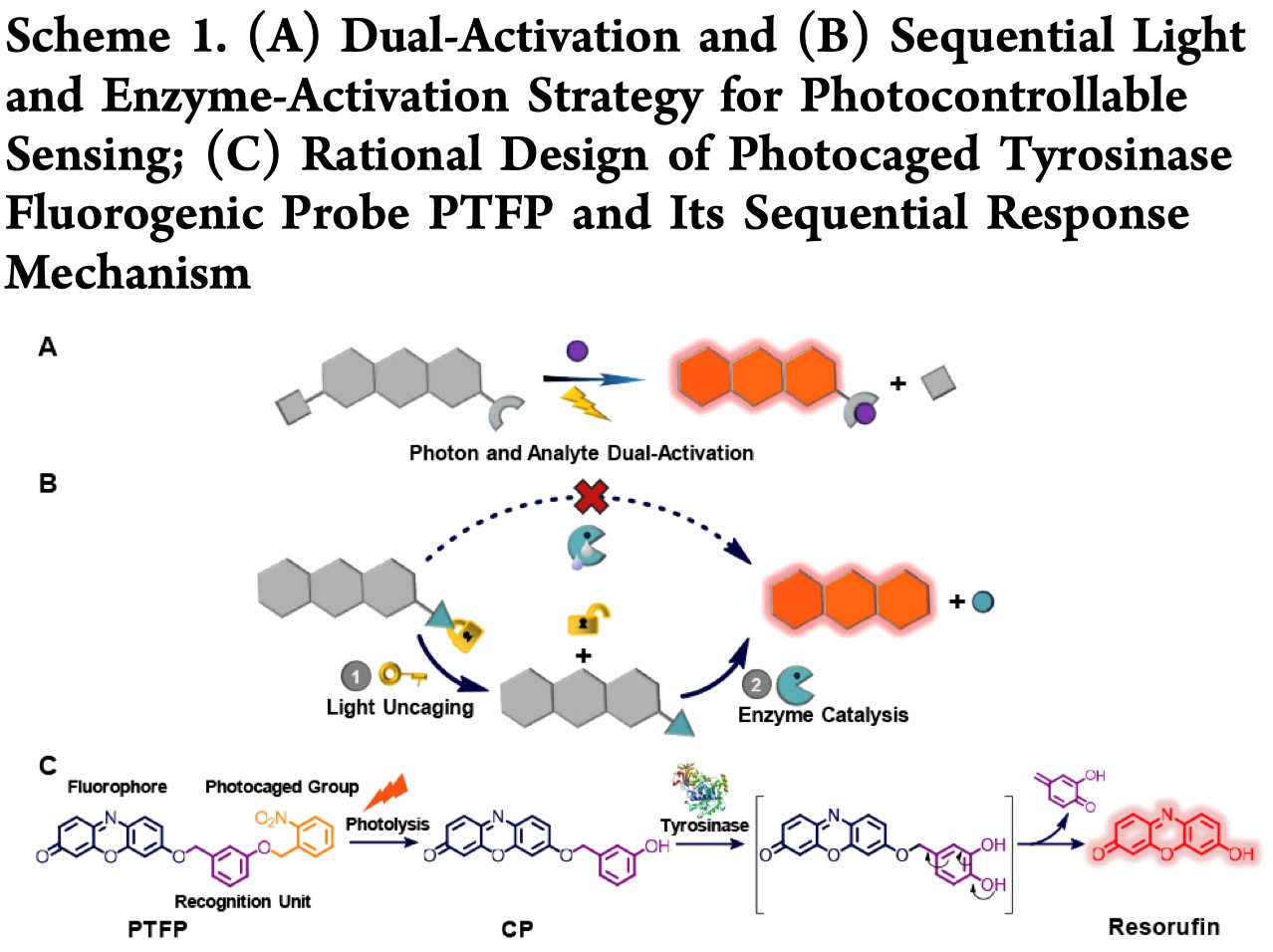
为了满足具有时间分辨率的监测细胞内靶标和相关过程的要求,研究者们已经进行了许多研究,并证明了通过光刺激可以远程操控探针。受到光掩蔽(photocaging)技术的启发,Lin及其同事提出了一种可以双重激活的探针设计策略,该方法可以通过同时用识别部分和光不稳定的掩蔽基团来实现远程可控传感(Scheme 1A)。目前也已经报道了多种光活化的荧光探针用于细胞内与亚细胞生物物种的时间成像,比如锌离子、铜离子、HClO,生物硫醇和酯酶。尽管同步光激活和分析物响应可以精确的在时间上控制信号,但该策略具有明显的局限性:裸露的识别部分可能在所希望的时间点之前与目标物发生反应,可能会干扰检测精度。另外,通过荧光团与螺吡喃之间的结合,已经开发出了一种光致变色荧光探针,该探针能够进行光控制的细胞内靶标识别。在这种情况下,可以直接以休眠的形式存储识别部分,直到我们需要的时候激活荧光。尽管上述优点提供了一个精确时间检测酶活性的方法,但迄今为止还没有报道过用于酪氨酸酶的这座光活化酶促荧光探针。
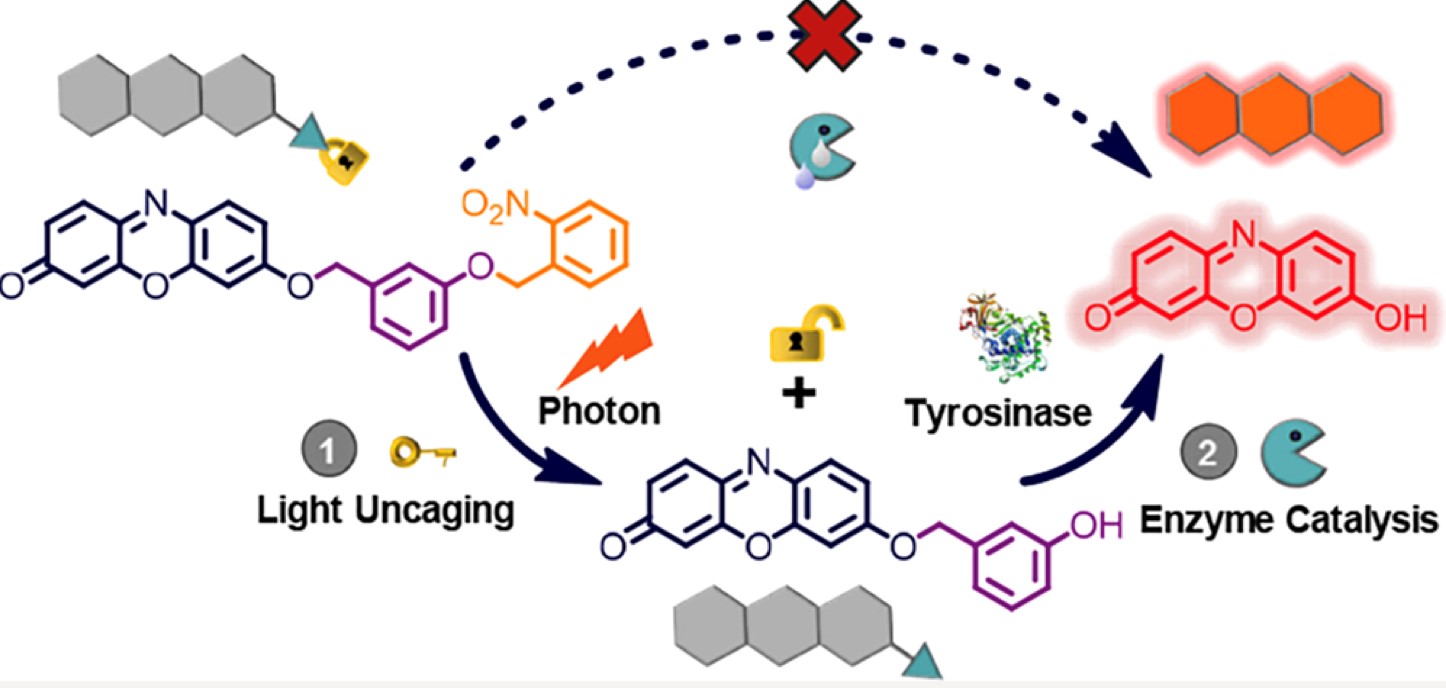
考虑到这一点,作者提出了一种光和酶相继激活的策略来解决上述问题:通过对具有光不稳定基团的探针的底物部分进行分子掩蔽来设计荧光探针,从而由于空间位阻组织了其对酶的反应性。除非未活化的底物被光照射去掩蔽,荧光信号不能仅通过酶促释放荧光团而产生(Scheme 1B)。以此为思路,作者开发了第一个光控的酪氨酸酶响应荧光探针(名为PTFP,Scheme 1C),其中分别使用试卤灵染料和3-羟基苄氧基作为信号报道和酪氨酸酶识别片段,并将最广泛使用的光不稳定的2-硝基苄基团修饰在识别片段上。光保护基团的存在阻止了酪氨酸酶在3-羟基苄氧基的4位空位发生羟基化及其随后通过1,6重排自发去除,从而使设计的荧光探针可以在人工控制下随时监控细胞内的酪氨酸酶活性。
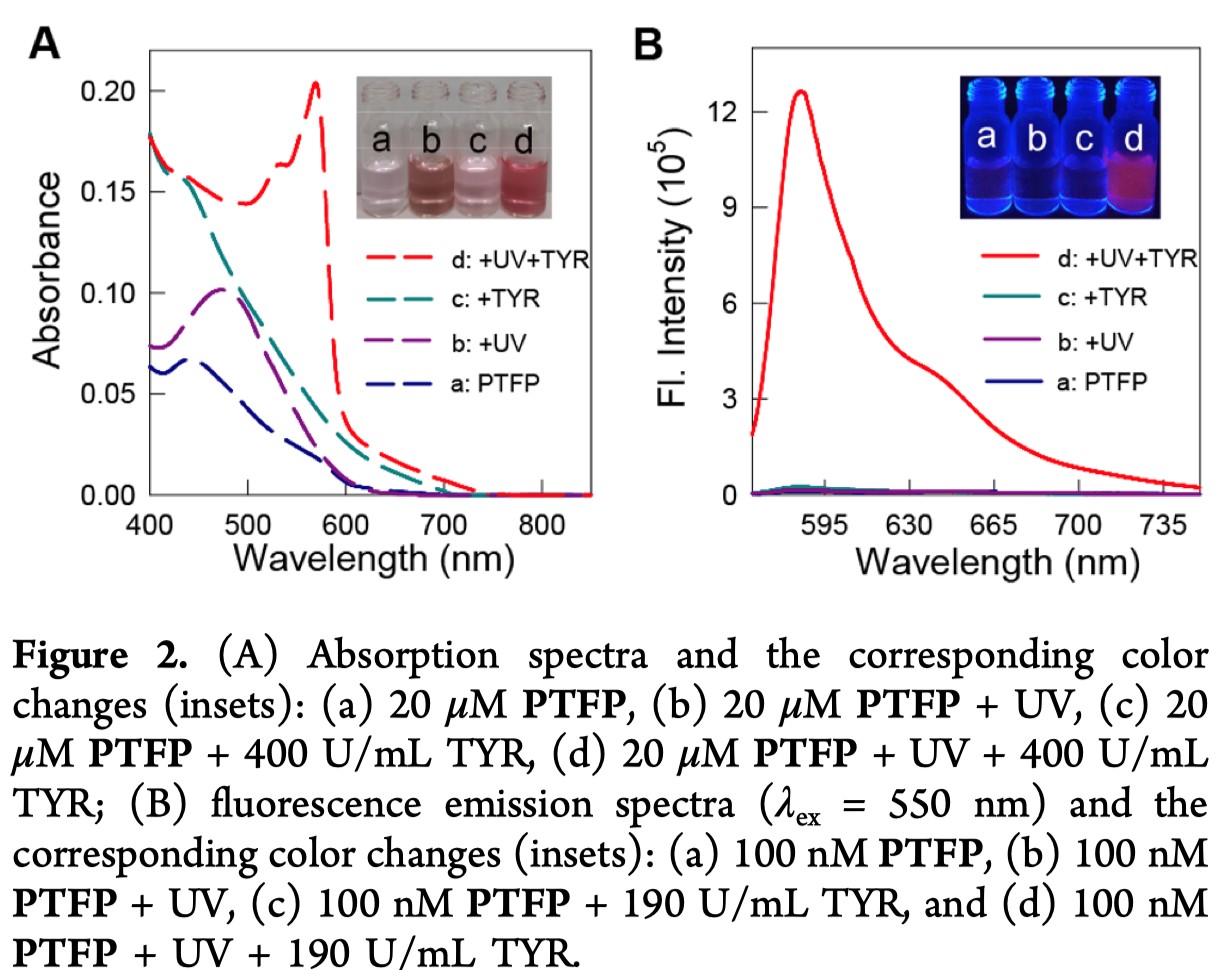
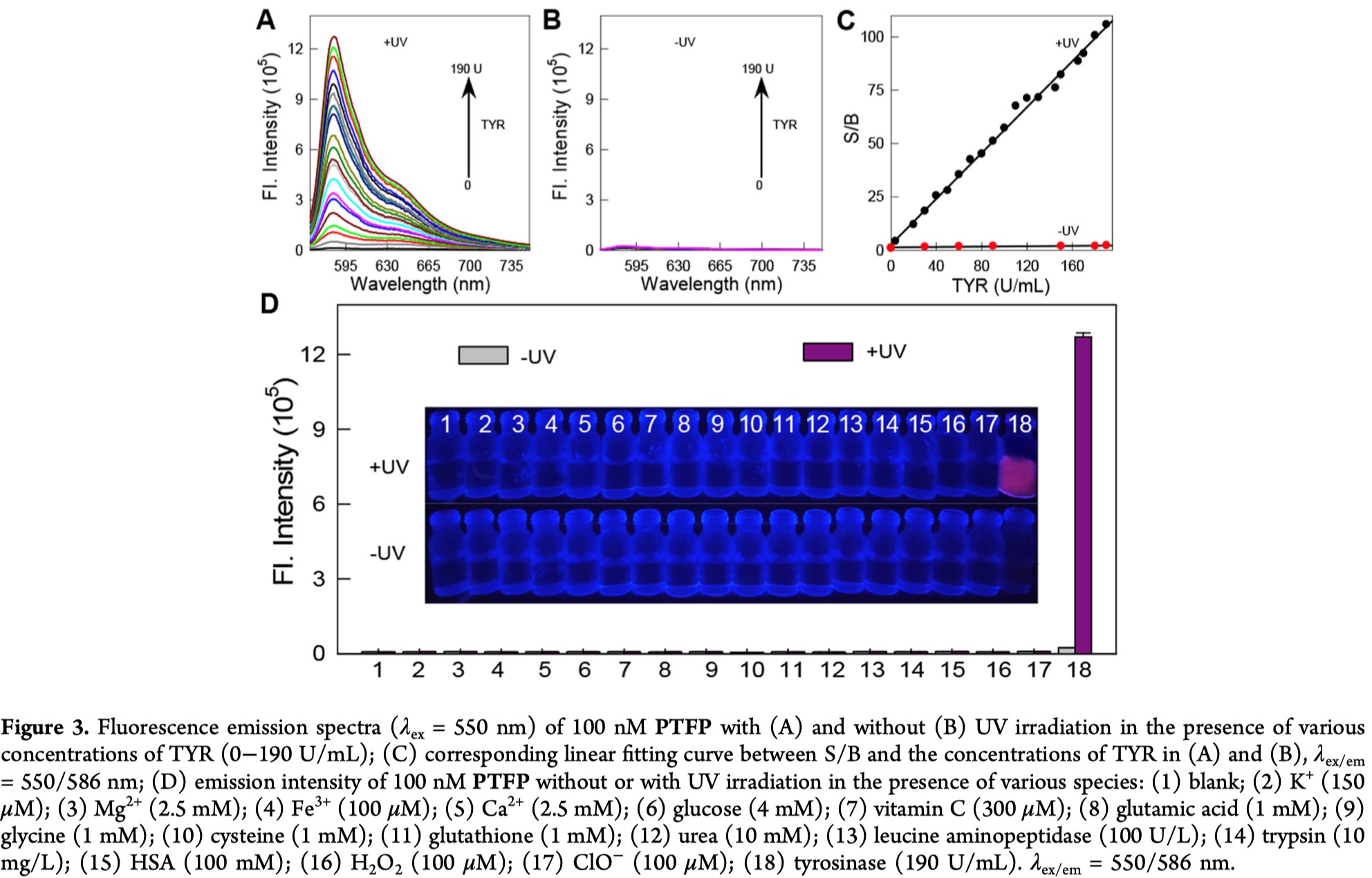
作者制备了PTFP之后,首先测定了它在有无光照以及有无酪氨酸酶时的吸收和荧光光谱,如Figure2所示。PTFP在440 nm时达到最大吸收峰值,并且因为3-硝基苄氧基与2-硝基苄基对试卤灵的烷基化淬灭效应,PTFP不发荧光。存在酪氨酸酶的时候,最大吸收和荧光发射没有明显变化,表明该探针很稳定,被保护的部分在无光照的时候对酪氨酸酶呈惰性。当有紫外光照之后,2-硝基苄基被光解掉,最大吸收值略微红移至470 nm,但未观察到显著的荧光,这与先前报道的CP的光谱特性完全一致。而PTFP溶液在光解后再经酪氨酸酶处理,在570 nm显示出较强的吸收峰,并在586 nm附近显示出显著的荧光增加,并且溶液颜色由无色变为粉红色,并发出明亮的红色荧光(Figure 2里的插入图)。这些光谱特征与试卤灵相似,因此表明荧光开启的响应源自光解和酪氨酸酶催化引起的荧光团释放。
为了深入了解PTFP的反应过程,作者通过质谱和HPLC监测酪氨酸酶存在与否时的探针和其光解产物。仅用酪氨酸酶处理的PTFP在m/z 455.11上显示出一个主峰,表明探针由于2-硝基苄基的保护而对酪氨酸酶不敏感。但是,当进行UV光照时,不存在酪氨酸酶和存在酪氨酸酶的时候,两个主要的新峰主要出现在m/z 318.44和214.2,表明探针被光解生成CP,并进一步被酶促反应转化成试卤灵。HPLC的监控也进一步验证了先光解进而酪氨酸酶催化的反应机理(详见SI)。
接下来,作者优化了该反应的反应条件,包括紫外线照射时间,pH,温度和反应时间。研究结果表明,150秒的紫外光照射(365 nm)可以完全使光解发生。光解后的探针几乎不受pH值4-8.2改变和温度28-43度的影响,并且在生理条件下(pH 7.4,37度)下显示出对酪氨酸酶较好的反应性和显著的荧光增加。作者还做了实时动力学研究,表明在紫外线照射后PTFP保持稳定,但如果随后用酪氨酸酶处理,则其在586 nm处的荧光强度逐渐增加,并在约3小时内达到平稳(详见SI)。
优化了反应条件之后,作者使用不同浓度的酪氨酸酶,在存在或不存在紫外光照的时候检测探针的灵敏度。从Figure 3A和3B可以看出,增加酪氨酸酶的浓度会在探针被光解之后,引起逐步的荧光强度上升,当不暴露在紫外光下的时候荧光强度则不会有明显的变化。Figure 3C中显示出荧光信号与背景的比值S/B在0-190 U/mL的浓度下是与TYR的浓度线性成比例的,检测限为0.08 U/mL。
为了测试探针的特异性,作者验证了一系列可能与探针反应的物质,比如一些比较广泛的阳离子,经常出现的生物物质,还原性物质,典型的活性氧还有一些酶。由Figure 3D可以看出,除了酪氨酸酶之外所有的物质都不会在光解之后引起探针的荧光变化,这表明PTFP对于酪氨酸酶具有高的选择性。究其机理,是因为酪氨酸酶可以对未保护的3-羟基苄基进行羟基化,并随后发生1,6-重排消除反应。同时,作者进行了酶抑制实验,进一步验证光解后的PTFP对酪氨酸酶的特异性识别。曲酸是酪氨酸酶的常见抑制剂,可以使得未被保护的探针对酪氨酸酶响应的荧光强度显著下降。但是曲酸的存在不会影响试卤灵或PTFP的荧光,这些结果表明荧光增强确实是由酶催化的反应引起的(详见SI)。
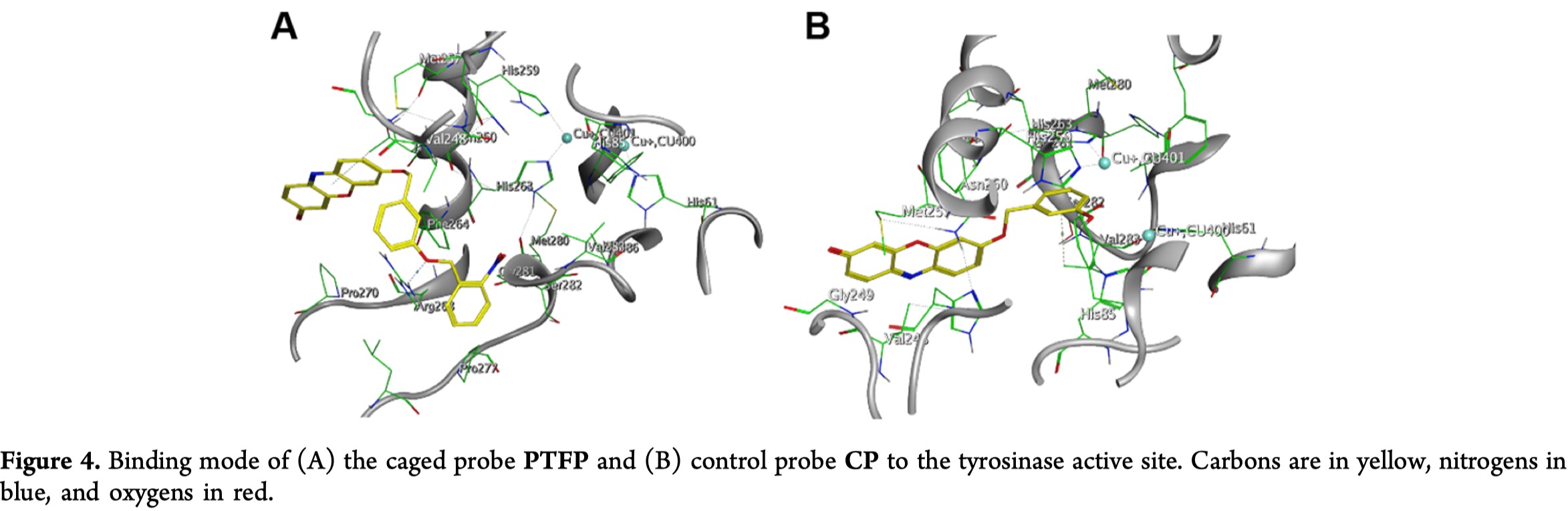
在光解之前和之后,PTFP的敏感性和特异性存在显著差异,这表明将光不稳定的2-硝基苄基修饰在识别部分可用于光控制酪氨酸催化的反应。可能的原因是,来自识别部分3-羟基取代基的空间位阻可能在与酪氨酸酶活性中心的相互作用中起作用。为了更好地理解光解前后PTFP与酪氨酸酶的结合,作者通过Michaelis-Menten方程确定了动力学参数。光解后PTFP的酪氨酸酶催化反应的米氏常数(Km = 11.77μM)低于PTFP本身(Km = 59.28μM),表明未被保护的底物和酪氨酸酶之间的亲和力更强。为了进一步解释,通过MOE软件计算了分子对接模拟。酪氨酸酶与CP和PTFP的结合自由能分别被计算为-6.60和-5.35 kcal / mol,这暗示着光解产物CP对酪氨酸酶的结合能力比PTFP更强。如Figure 4中酪氨酸酶活性位点与PTFP和CP的最有利结合模式所示,除了被保护的氧原子与连接Arg268作为供体的肽主链形成氢键外,PTFP与酪氨酸酶活性位点残基之间没有显著的相互作用,被保护的识别单元远离催化中心,每个铜离子由三个组氨酸残基配位。相反,CP被17个氨基酸残基包围,识别部分的芳环由π-π堆积和CH···π分别与活性位点残基His263和Val283相互作用。3-羟基苄氧基的4位空位朝向附近的双核铜结合位点。而且,带负电荷的酚基团可以直接与去质子化CP的活性位点的铜离子配位,这与先前提出的酪氨酸酶催化机理一致(详见SI)。
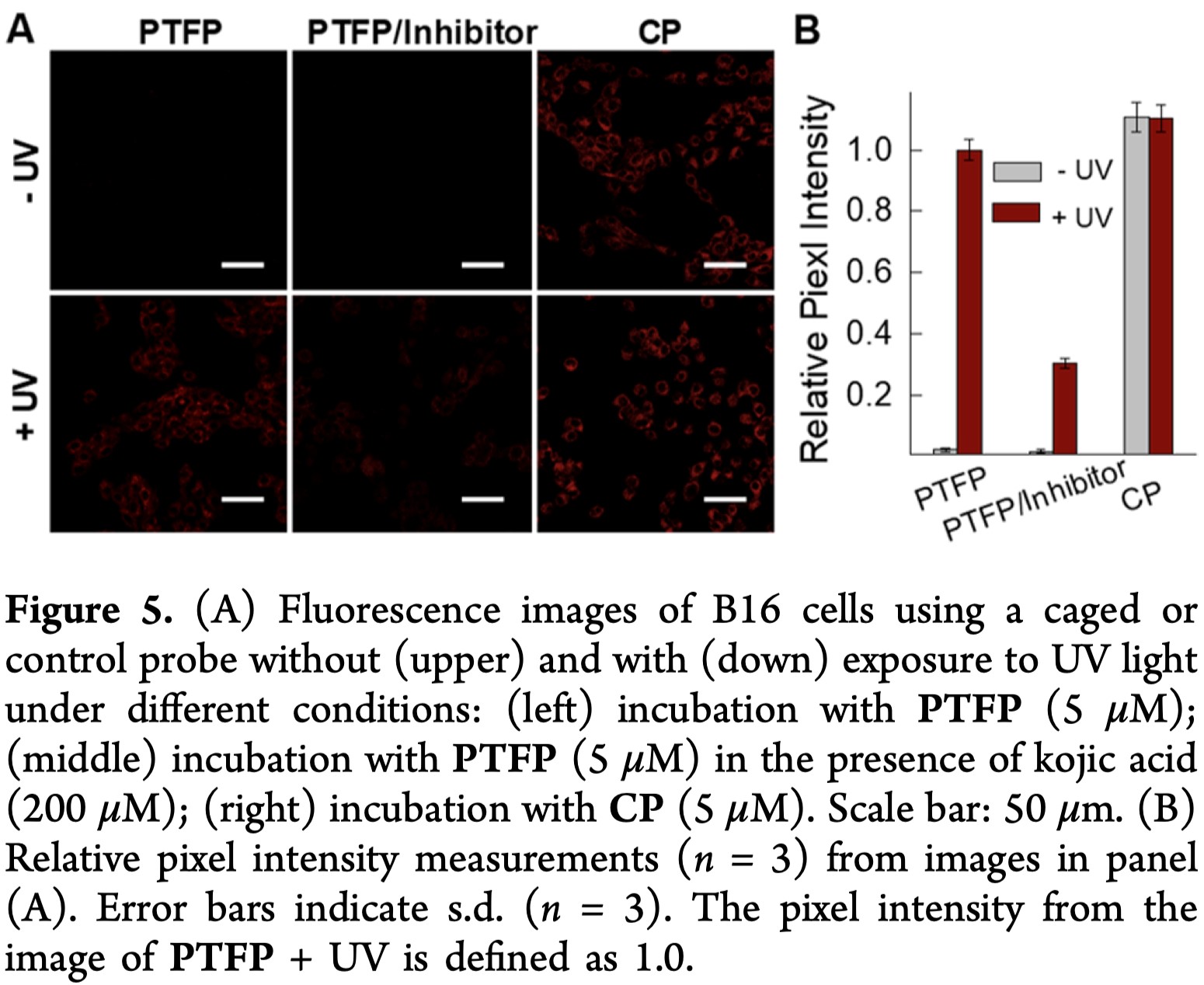
由于PTFP在体外光调节TYR活性的荧光传感中具有优异性能,作者继续探索其在具有光控作用的活细胞中对内源性酪氨酸酶活性进行荧光成像的能力。MTT分析表明,PTFP几乎不会影响细胞活性,表明该探针具有良好的生物相容性。酪氨酸酶过表达的小鼠黑色素瘤B16细胞系用作共聚焦成像实验的目标模型。如Figure 5所示,B16细胞与PTFP孵育后几乎没有荧光信号,而用PTFP处理的受光细胞则发出明亮的荧光。在另一个对比组中,可以观察到酪氨酸酶抑制剂曲酸预孵育的细胞的荧光显著降低。作为对照组,CP孵育的细胞无论是否进行紫外线照射,基本上都显示出明亮的荧光,这表明传统的CP探针无法进行光调节。这些数据清楚地证明了PTFP具有细胞渗透性,并且可以通过光化学活化人工控制,对细胞中内源性酪氨酸酶活性进行荧光成像。
结语
长沙理工大学的杨荣华教授课题组设计了第一个通过光控酶活化的检测酪氨酸酶的荧光探针。通过对一个传统的酶促探针修饰光不稳定基团,从而实现高灵敏度和高特异性的光控检测酪氨酸酶,并可以可控的在细胞内检测内源性酪氨酸酶活性。这个探针将可以在生物医学研究中动态的检测酪氨酸酶的生理学和病理学功能,并有潜力将同样的光控策略应用在更多酶的检测上。
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!















No comments yet.