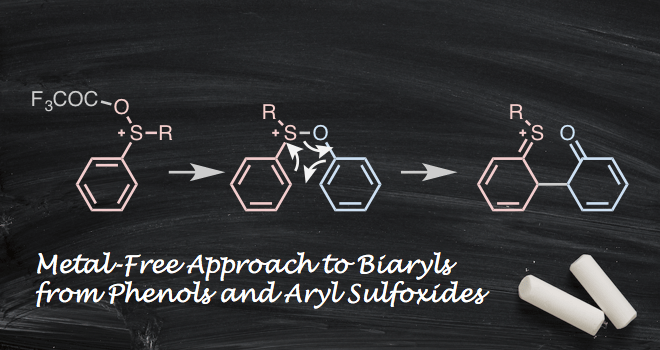
通过扩展型Pummerer反应,经过[3,3]-sigmatropic rearrangement(σ键重排),由芳基亚砜化合物与酚类化合物合成联芳基化合物的合成方法近期被化学家报道,该方法条件温和,操作简便,具有普遍适用性。
不含过渡金属催化剂的联芳基化合物的合成反应
联芳基化合物是生物活性化合物,功能材料分子中常出现的骨架,高效的合成联芳型化合物的反应时化学家多年来一直在探寻的研究对象,其中以钯催化的芳基金属化合物和芳基卤化物的偶联反应,是目前公认的,也是最广泛应用的有效合成方法。
而近几年直接简便的联芳基化合物的新型反应开发也引发到科学家的兴趣,其中,利用钯、铜、铑催化剂将两个芳香环上的C–H键通过活化直接结合为联芳基化合物,即C–H键之间的氧化偶联反应[1]。
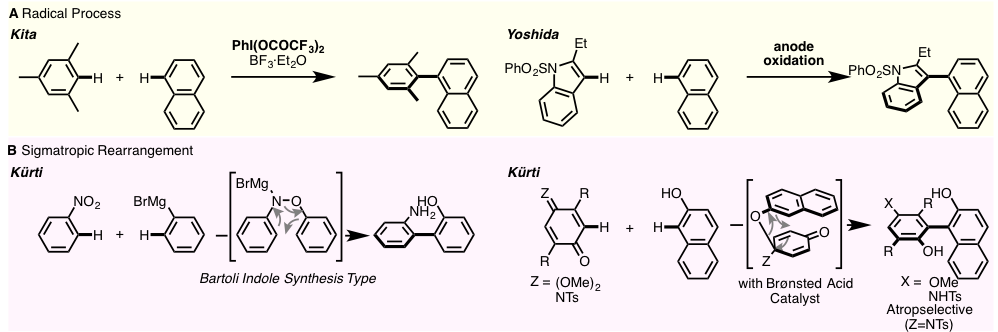
与上述两种利用金属有机催化反应相对应的,不含有金属催化剂的C–H键之间的氧化偶联反应的研究也被报道过,主要如下两例(图1)
一是 按照自由基机理进行的反应,利用双三氟乙酸碘苯[2a]或负极氧化[2b]直接进行两个芳基的偶联。
另一种是,[3,3]-σ键重排为驱动力的直接联芳基合成。Kürti等人在2013年报道了硝基苯与芳基格式试剂的Bartoli吲哚合成型的偶联反应[3a]2016年他们又报道了醌缩醛(Z=(OMe)2)或亚胺基醌(Z=NTs)与酚类的联芳化合物合成法。[3b,3c] 与亚胺基醌的反应中利用手性质子酸催化剂可以实现轴不对称偶联反应。
而这一次,京都大学的依光教授等人,报道了由硫化合物的性质产生的[3,3]-sigmatropic重排型的直接联芳基化合物的合成方法。
“Metal-Free Approach to Biaryls from Phenols and Aryl Sulfoxides by Temporarily Sulfur-Tethered Regioselective C−H/C−H Coupling”
Yanagi, T.; Otsuka, S.; Kasuga, Y.; Fujimoto, K.; Murakami, K.; Nogi, K.; Yorimitsu, H.; Osuka, A. J. Am. Chem. Soc. 2016, 138, 14582. DOI: 10.1021/jacs.6b10278
论文作者介绍
研究者:依光英树
研究者经历:
–2002 博士(工学), 京都大学大学院工学研究科 (大嶌幸一郎教授)
2002–2003 JSPS博士研究員, 東京大学大学院理学系研究科 (中村栄一教授)
2003–2008 助手(即助教), 京都大学大学院工学研究科
2008–2009 副教授, 京都大学大学院工学研究科
2009–2015 副教授, 京都大学大学院理学研究科
2015– 教授, 京都大学大学院理学研究科
研究内容:反应开发、含硫化合物的有机化学
论文概要
依光教授等人开发了由含硫化合物的特性产生的有机合成反应,其中之一就是,2014年利用三氟乙酸酐,由烯基亚砜和酚类合成苯并呋喃的合成方法,并命名为“扩张型Pummerer重排反应”[4]。
这个反应中[3,3]-σ键 重排是C-C键形成的关键,本论文中,由芳基亚砜形成A,发生[3,3]-σ键 重排生成中间体B,再芳香化为联芳基化合物的产物(图1)。
这一反应,虽然必须使用富电子的芳基亚砜化合物,不过含有杂原子的芳香化合物也能够适用于该体系,实现高収率的偶联。值得一提的是,这个反应对于形成的碳碳键邻位都被取代了的大位阻联芳化合物的合成也丝毫不费力,并且还能轻松的大量的反应。成功合成三联萘这样大位阻的产物作为该方法中的成功反应实例确实让人惊叹。
作为反应的应用拓展,邻位残留的硫代基团与羟基的环化反应可以高度快速的缩环成为芳香杂环化合物。由上述的三联萘出发还能合成含有杂原子的螺烯,实在是具有非常高的应用拓展性。
该新型反应因为条件的温和,简便,以及颇具魅力的应用拓展,今后这一类型的反应在联芳基化合物的合成中是不是会被广泛使用啊。拭目以待吧!
参考文献
- Liu, C.; Yuan, J.; Gao, M.; Tang, S.; Li, W.; Shi, R.; Lei, A. Chem. Rev. 2015, 115, 12138. DOI: 10.1021/cr500431s
- (a) Dohi, T.; Ito, M.; Morimoto, K.; Iwata, M.; Kita, Y. Angew. Chem., Int. Ed. 2008, 47, 1301. DOI: 10.1002/anie.200704495 (b) Morofuji, T.; Shimizu, A.; Yoshida, J.-i. Angew. Chem., Int. Ed. 2012, 51, 7259. DOI: 10.1002/anie.201202788
- (a) Gao, H.; Ess, D. H.; Yousufuddin, M.; Kürti, L. J. Am. Chem. Soc. 2013, 135, 7086. DOI: 10.1021/ja400897u (b) Gao, H.; Xu, Q.-L.; Keene, C.; Yousufuddin, M.; Ess, D. H.; Kürti, L. Angew. Chem., Int. Ed. 2016, 55, 566. DOI: 10.1002/anie.201508419 (c) Wang, J.-Z.; Zhou, J.; Xu, C.; Sun, H.; Kürti, L.; Xu, Q.-L. J. Am. Chem. Soc. 2016, 138, 5202. DOI: 10.1021/jacs.6b01458
- (a) Kobatake, T.; Fujino, D.; Yoshida, S.; Yorimitsu, H.; Oshima, K. J. Am. Chem. Soc. 2010, 132, 11838. DOI: 10.1021/ja1030134 (b) Ookubo, Y.; Wakamiya, A.; Yorimitsu, H.; Osuka, A. Chem. Eur. J. 2012, 18, 12690. DOI: 10.1002/chem.201201261 (c) Murakami, K.; Yorimitsu, H.; Osuka, A. Angew. Chem., Int. Ed. 2014, 53, 7510. DOI: 10.1002/anie.201403288
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!




















No comments yet.