作者:石油醚
导读:
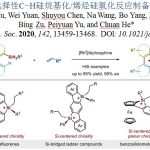
近日,中国科学院兰州化物所刘超(现任职于南京大学)/张鹏团队首次报道了烯烃与硼叶立德的立体选择性环丙烷化反应,为合成立体专一偕二硼官能化的环丙烷提供了一种模块化策略。在手性助剂的帮助下,合成的手性偕二硼基环丙烷具有极佳的对映选择性。基于硼基团强大的可转化能力,具有挑战性的含多季碳中心的环丙烷单元得以轻松构建,并具有极佳的立体选择性。对照实验表明,硼基团对于反应的化学选择性和立体选择性的控制都是必要的。这一研究成果近期发表在Angew. Chem. Int. Ed.杂志上,在读博士生方通昌为文章第一作者,刘超教授和张鹏研究员为文章通讯作者。该工作受到国家自然科学基金(22022113)的支持。
“Boron Ylide Enables Stereoselective Construction of gem-Diborylcyclopropanes
Tongchang Fang, Peng Zhang*, Chao Liu*
Angew. Chem. Int. Ed. 2024, e202415301 Doi: 10.1002/anie.202415301”
正文:
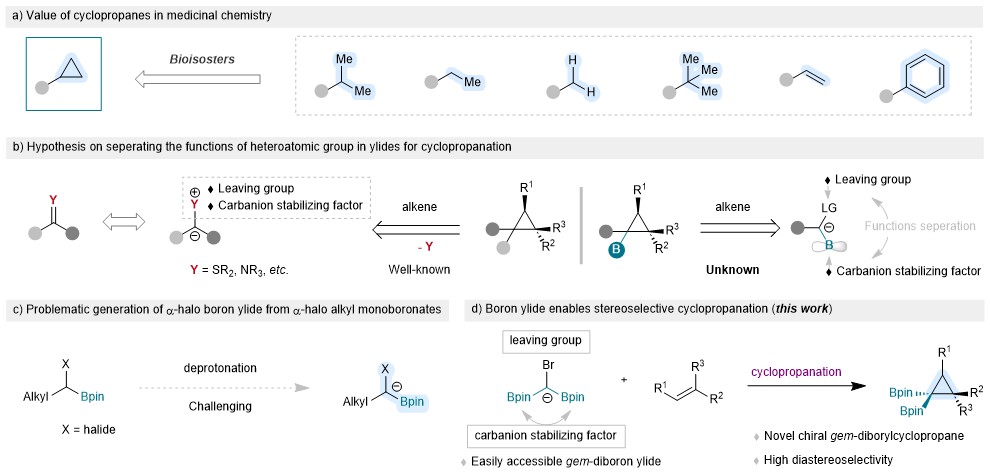 图1:反应背景与设计
图1:反应背景与设计
三元环,尤其是环丙烷,因其独特的物理化学性质而成为药物化学的基本框架。自20世纪60年代以来,环丙烷被战略性地纳入药理活性化合物的分子结构中,以实现特定的治疗目标。在药物设计中,环丙烷通常作为烷基、芳基和乙烯基的生物异构,从而有助于提高药效、减少脱靶效应、改善代谢稳定性和提高水溶性(图1a)。此外,环丙烷因其固有的环状应变性,经常被用作合成非常规分子的关键构件。环丙烷的价值毋庸置疑,但人们仍在孜孜不倦地寻求有效构建环丙烷或将其直接整合到复杂分子中的通用策略。这凸显了当前合成方法中的一个关键缺口,强调了创新合成策略的必要性,以充分发挥这些多用途环系统在合成和药物化学中的潜力。
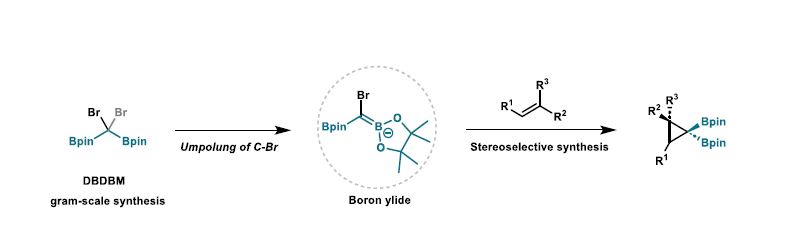
目前构建环丙烷的主要方法通常是[2+1]环化策略,其中主要是利用卡宾作为C1碳源的环化方法。与此同时,使用叶立德作为[2+1]环化反应的两亲性C1碳源显示出了独特的合成优势。叶立德结构中的杂原子官能团既是离去基团,又是邻位碳负离子的稳定因子。在环丙烷化过程中,这些宝贵的杂原子基团会被消除(图1b,左)。该课题组设想将这两种功能(离去基团和碳负离子稳定因子)分离开来,将可能实现有价值的杂原子官能团在最终分子中的有效保留。
中国科学院兰州化物所刘超(现任职于南京大学)团队长期致力于有机硼化学研究,近年来,该团队发展了一系列新型卤代偕二硼试剂(Chin. J. Org. Chem. 2023, 43, 777-780, Angew. Chem. Int. Ed. 2024, 63, e202315227),并基于此发展了非常规偕二硼试剂的模块化合成方法(图2)。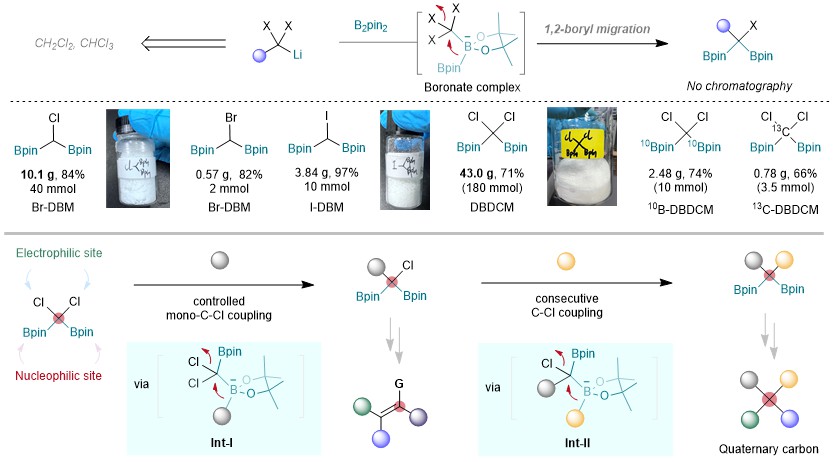
图2:硼-Matteson反应合成卤代偕二硼试剂
硼基团的空p轨道赋予了其稳定α-碳负离子的能力,显然,α-卤代烷基硼化合物满足了分离离去基团和碳负离子稳定因子功能的设计要求(图1b,右),但通过去质子化从α-卤代单硼酸酯生成硼叶立德具有挑战性(图1c)。最近,刘超课题组和其他研究小组证明了α-卤代偕二硼酸酯生成硼叶立德的可能性。这鼓励其进一步研究硼叶立德与烯烃的环丙烷化反应(图1d)。
在此,作者进一步开发了通过三溴甲基锂的1,2-硼迁移反应合成二硼二溴甲烷(DBDBM)的方法(图3a)。以甲基丙烯酸甲酯1a被用作环丙烷化反应的模型烯烃,基于已合成的硼叶立德前体,分别通过去质子化和锂卤交换策略对其反应性进行了筛选,结果表明DBDBM的锂卤交换是生成硼叶立德的最有效的方法(图3b)。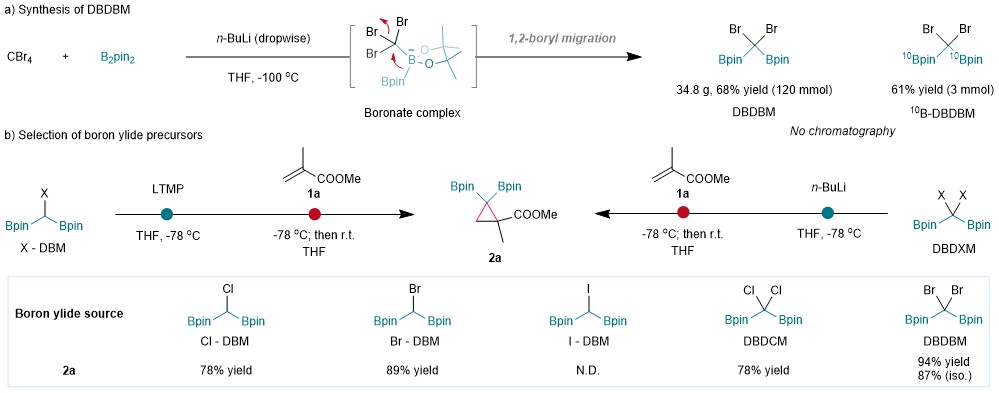
图3:硼叶立德前体的合成与筛选
随后探讨了不同烯烃在这种环丙烷化反应中的适用性(图4)。带有酯(2b-2i)、酰胺(2j)、氰基(2k)、磺酰基(2l)和膦酰基(2m)官能团的烯烃都能很好地与该反应相容。通过10B 标记的DBDBM将10B分子轻松引入到这些环丙烷分子中,凸显了该策略的实用性。在标准条件下,α-CF3取代的苯乙烯也能以50%的产率生成2n,同时还有45%的烯烃未转化。相比之下,α-CH3取代的苯乙烯1o没有产生任何环化产物,这表明了烯烃缺电子的重要性。此外,常见的脂肪族烯烃1p也不适用于环化反应。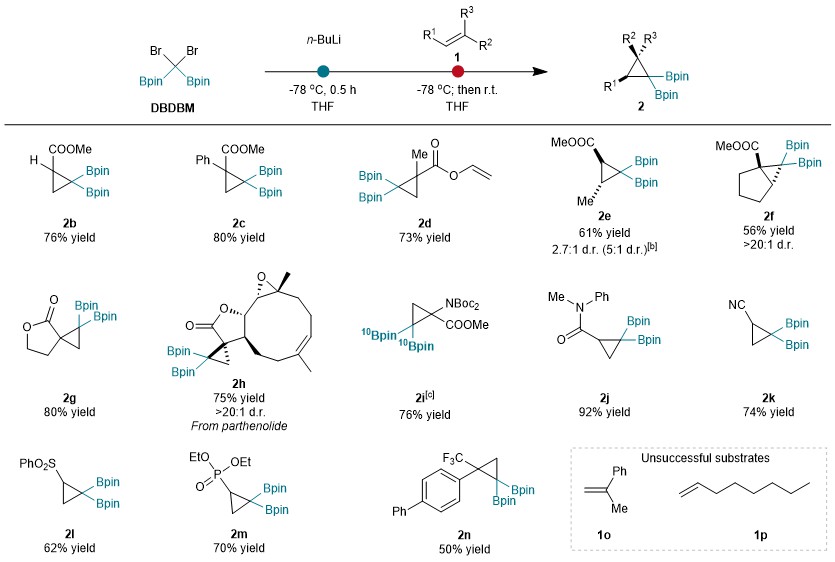
图4:烯烃兼容性探索
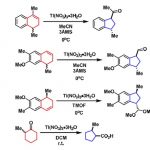
接下来作者进一步探索使用手性辅基以实现偕二硼基环丙烷的立体选择性合成(图5)。经过一系列筛选,Evans手性辅基有着很好的诱导效果,并通过手性辅基的立体专一转化,实现了环丙基甲酸酯和环丙基甲酰胺的高立体选择性合成,并且在反应后实现了手性辅基的回收。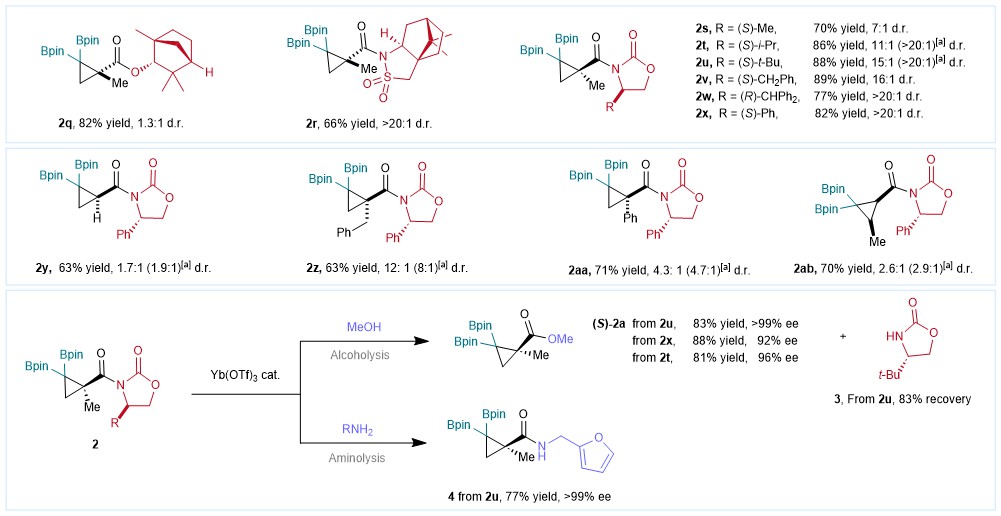
图5:立体选择性环丙化
为进一步证明其应用价值,作者以偕二硼基环丙烷作为合成砌块,进行了多种转化,其均保持了很好的立体选择性,并利用该课题组开发的胺化试剂,实现了药物分子-米那普伦7的立体选择性合成(图6)。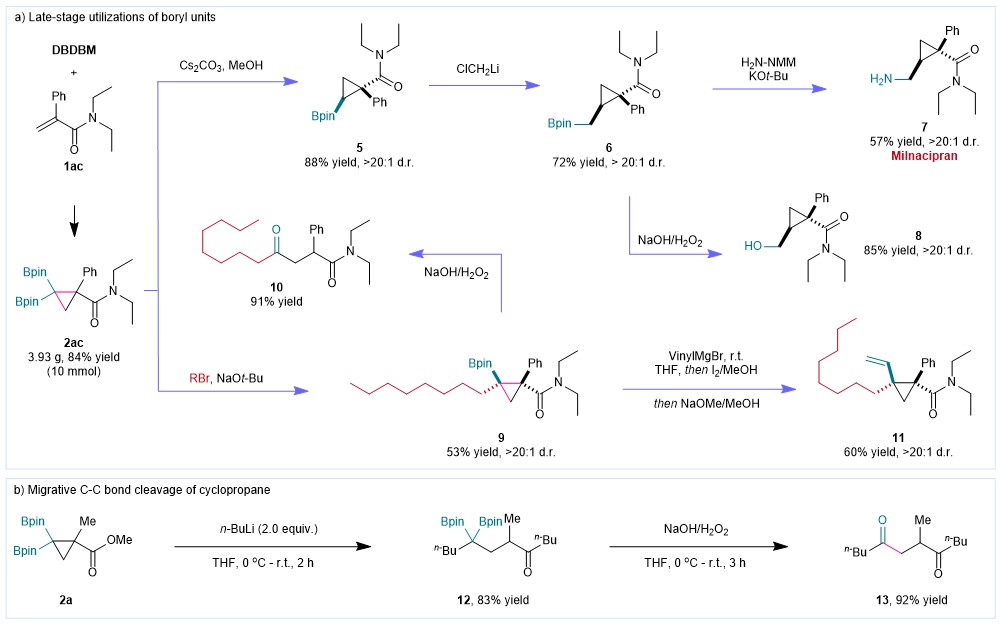
图6:合成应用
随后作者进行了一系列对照实验,以探究硼基团在环化反应中的重要性(图7)。将Bpin 基团改为甲基基团以生成碳负离子,并没有检测到的环化产物(图7a,式2),突出了Bpin 基团稳定作用的重要性。此外,异丙基硫叶立德和1w的Corey-Chaykovsky反应产生了相应的环丙烷产物,收率很高,但立体选择性却很低(1.8:1 d.r.)(图7a,式3),这突出表明硼基团在控制环丙烷化反应的立体选择性方面起着至关重要的作用。此外,还对具有相反构型的丙烯酸酯衍生物进行了环丙烷化反应(图7a,式4)。(E)-2-甲基丁-2-烯酸甲酯1ad可以生成环丙烷化产物2ad,收率为35%,d.r.为 4.6:1,而使用相反构型的烯烃(Z)-1ae则没有环丙烷化产物。这些结果表明,羰基氧原子与硼原子的预配位可能发生在硼基团对烯烃单元的亲核攻击之前(图7b)。首先,羰基氧与硼配位生成Int-A,随后“分子内”亲核进攻烯烃,生成六元烯醇中间体Int-B,随后的分子内环化反应生成了偕二硼基环丙烷。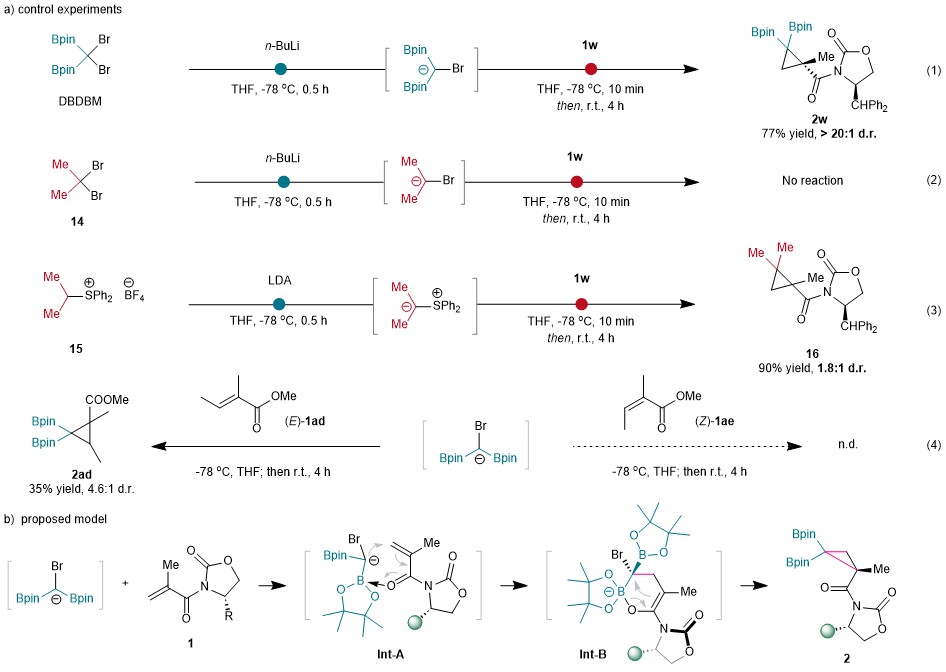
图7:反应机理探索
接下来,作者尝试捕获硼叶立德(图8)。加入甲醇后,形成了甲氧基取代的偕二硼甲烷17,证明了甲醇质子化硼叶立德的过程中生成了溴代偕二硼甲烷和甲醇锂。同样,含NH的烯烃18也没有生成所需的环化产物,硼叶立德对NH进行去质子化后,发生了1,2-N迁移,生成了氮取代的偕二硼甲烷19。与酮20发生硼-Witting反应生成四取代溴硼烯烃21也证明了硼叶立德的生成。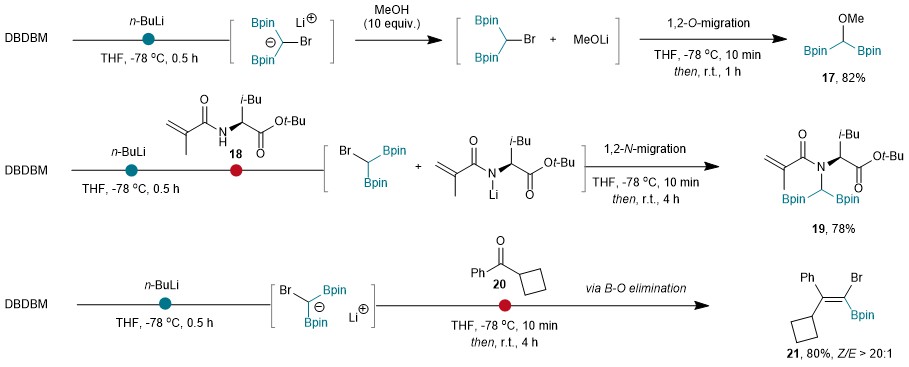
图8:硼叶立德的捕获
综上,以DBDBM为硼叶立德前体与烯烃的环丙化反应提供了一种获得各种偕二硼基环丙烷的模块化策略,为合成复杂的环丙烷奠定了基础。实验结果表明,硼基团对于反应的进行和立体选择性的控制至关重要。
(非常感谢刘超教授对Chem-Station的支持)





















No comments yet.