作者:石油醚
导读:
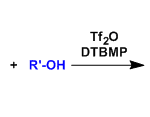
近日,苏黎世联邦理工学院Erick M. Carreira教授团队在J. Am. Chem. Soc.上,以 “Total Synthesis of (+)-Euphorikanin A via an Atropospecific Cascade.” 为题,报道了 (+)-Euphorikanin A的全合成。 其中,关键步骤主要涉及:跨环Aldol反应、半缩酮形成以及半频哪醇重排(Transannular aldol addition reaction, hemiketal formation, and subsequent semipinacol rearrangement)构建(+)-euphorikanin A的全部骨架; 位阻异构选择性闭环烯烃复分解(Atroposelective ring-closing olefin metathesis)构建(Z)-双环[7.4.1]十四烯酮骨架。
“Total Synthesis of (+)-Euphorikanin A via an Atropospecific Cascade.
Moritz J. Classen, Bilal Kicin, Vincent A. P. Ruf, Alexander Hamminger, Loélie Ribadeau-Dumas, Willi M. Amberg, and Erick M. Carreira* J. Am. Chem. Soc., 2023, ASAP. doi: 10.1021/jacs.3c11000”
正文
天然产物(+)-euphorikanin A(1)是由兰州大学(Scheme 1)的张占欣教授及其同事于2016年从中国传统中药 Euphorbia kansui中分离获得一种重排型ingenane天然产物[1]。目前,Carreira[2]和贾彦兴教授[3]分别以19步和30步完成了(+)-Euphorikanin A的全合成。近日,Erick M. Carreira教授团队报道了 (+)-Euphorikanin A的全合成,并发表于J. Am. Chem. Soc.上。
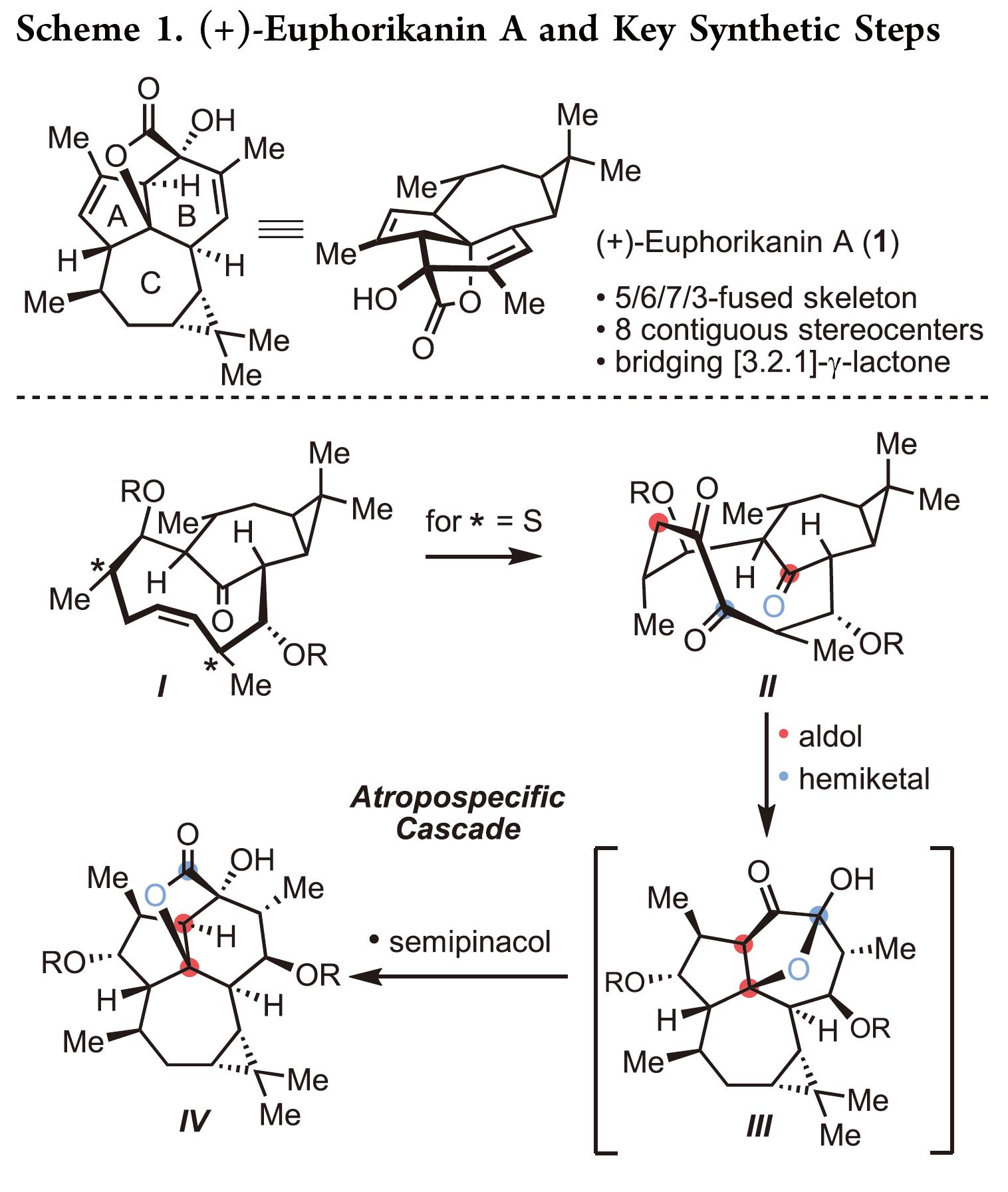
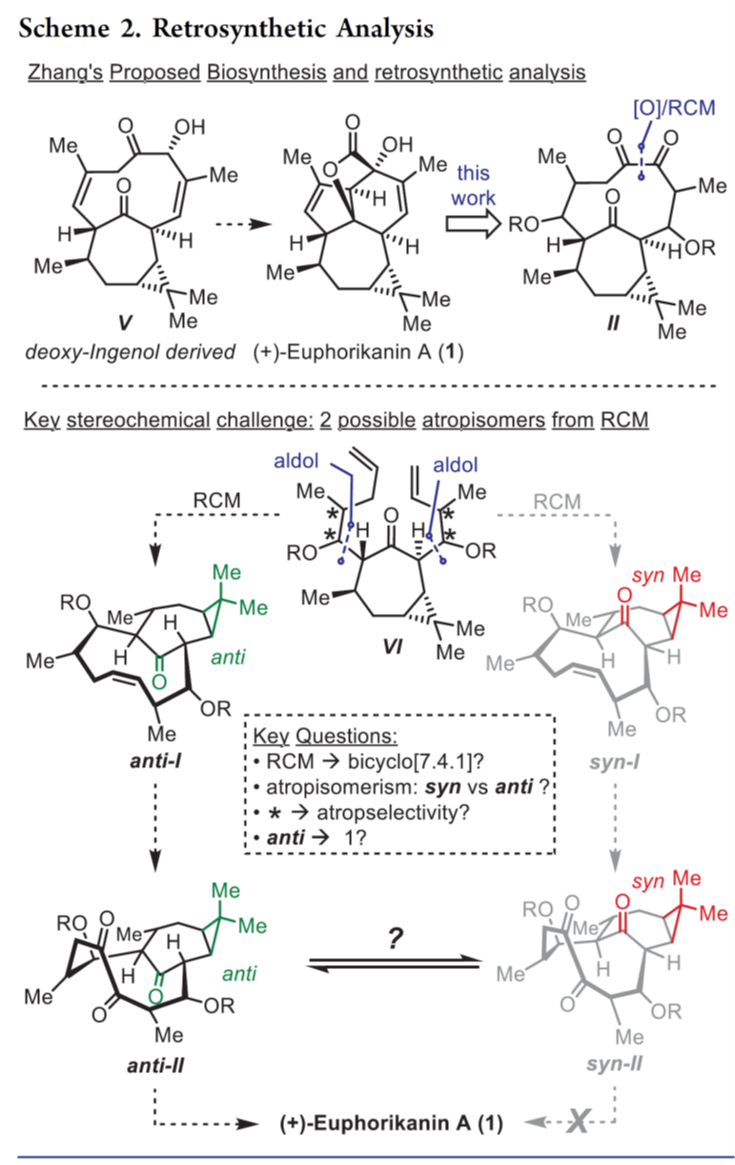
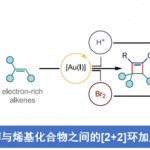
天然产物(+)-euphorikanin A(1)具有5/6/7/3-稠合的四环骨架并包含八个连续的立体中心,同时还在羟基取代的 Cα-桥头上具有桥环 [3.2.1]-γ-内酯。受Zhang和同事提出的生物合成途径启发[1]以及上述结构,作者对(+)-euphorikanin A(1)进行了相关的逆合成分析(Scheme 2),即VI的闭合环复分解组装烯烃获得中间体I, I的双键发生官能团变化构建II中的1,2-二酮。最后,关键的中间体II经串级反应快速有效地合成天然产物(1)。值得注意的是,双环[7.4.1]体系作为两种可能的阻转异构体存在,如anti–I[4]和syn–I所示(Scheme 2)。基于作者的分析,anti–II和(1)分别与环丙烷和桥内酮或γ-内酯之间存在anti-关系,进而引出了一些有趣的问题:(1)是否可以依靠RCM来提供双环[7.4.1]十四烷酮;(2)是否存在对一种阻转异构体的偏好,如果是,它们是否可以相互转化? (3) 环癸烯形成中的对位选择性会受到侧链构型的影响吗? (4) anti–II会参与级联反应导致 生成天然产物(1) 吗?
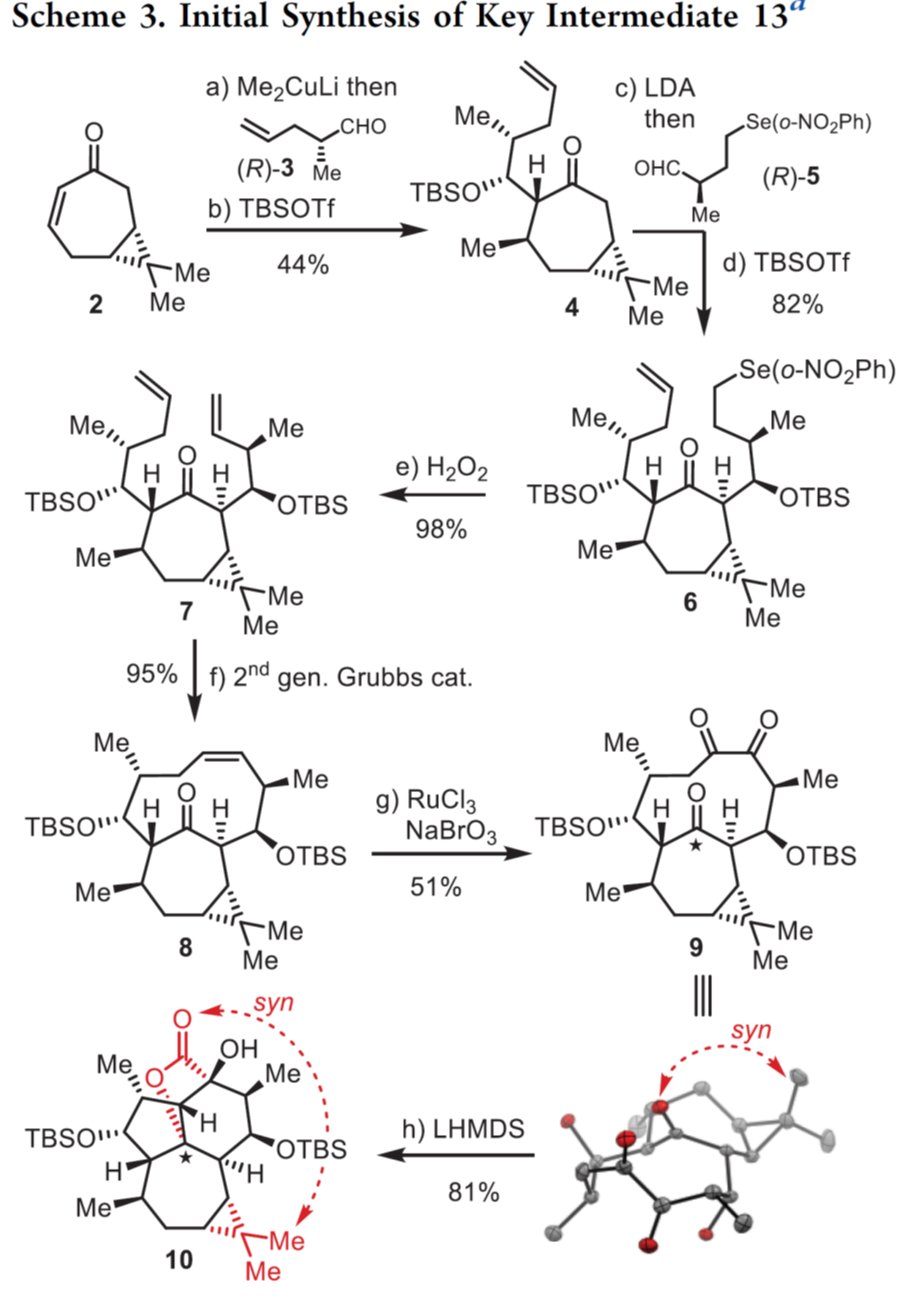
首先,作者对中间体13进行了合成,如Scheme 3所示。

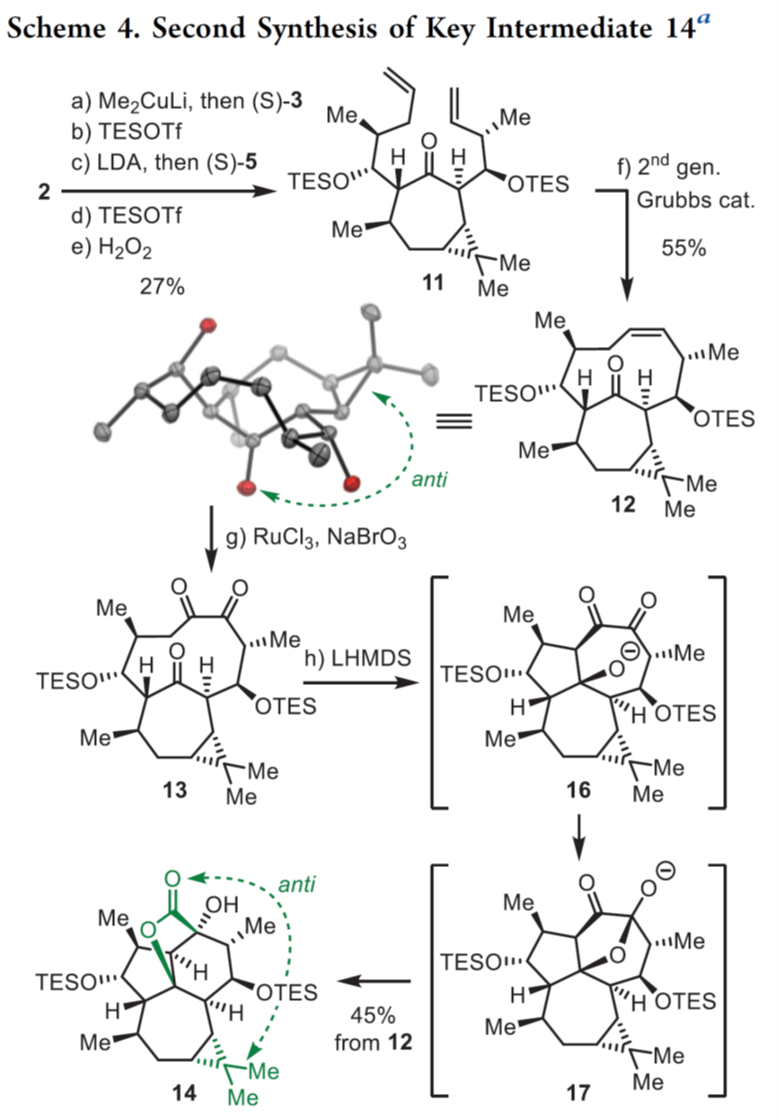
随后,作者关键的中间体14进行了合成尝试,如Scheme 4所示。

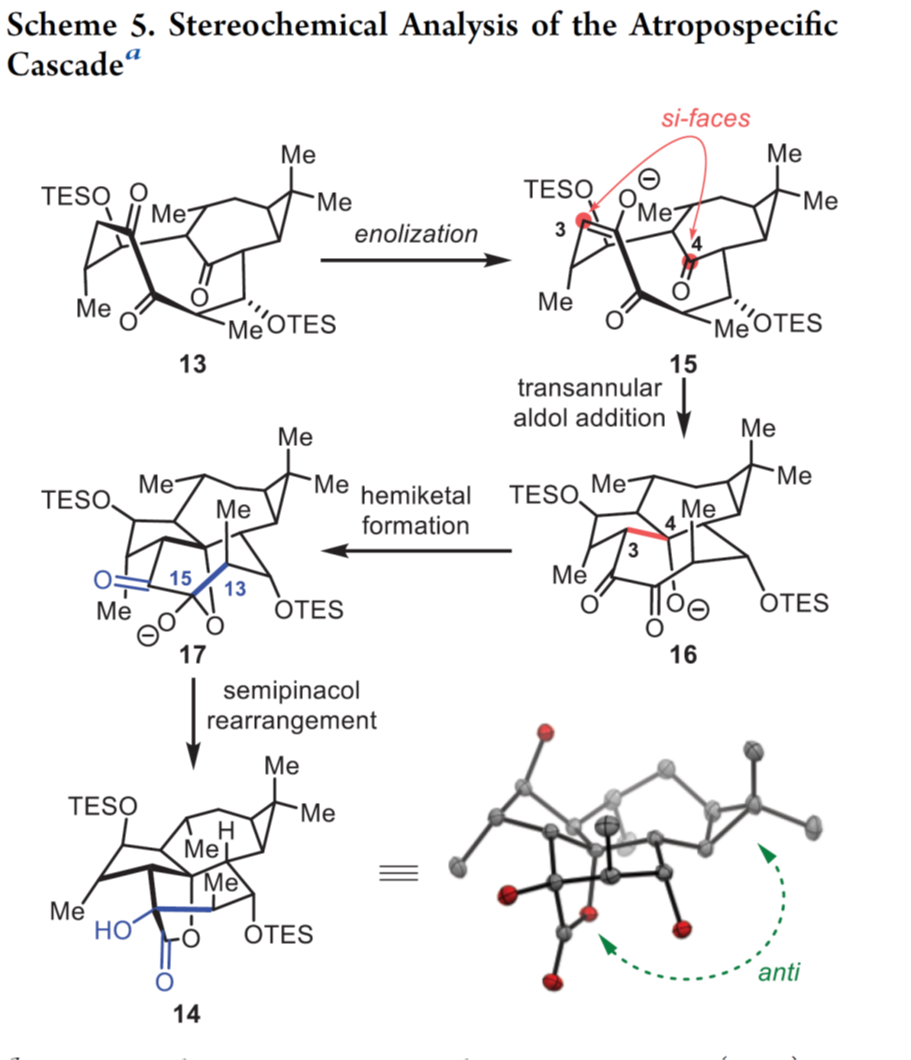
接下来,作者对合成14的串联反应的立体化学过程进行了探索,如Scheme 5所示。
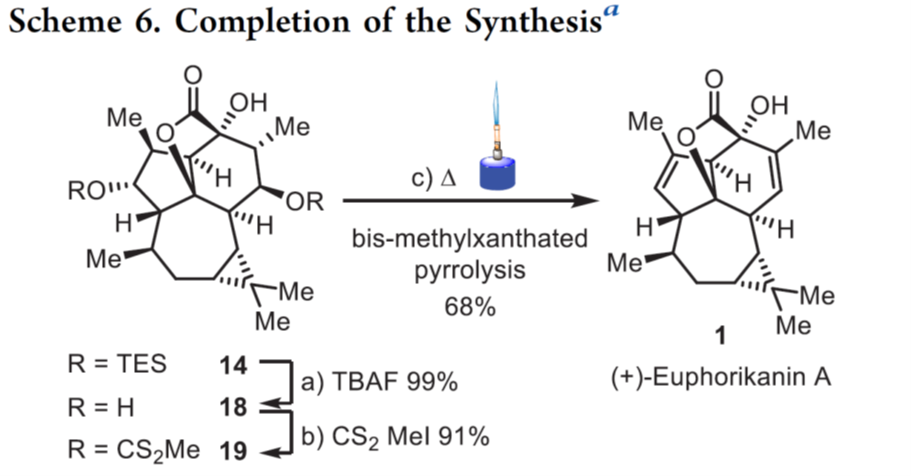
最后,作者对天然产物1进行了全合成 [6],如Scheme 6所示。

总结, Erick M. Carreira教授团队报道了 (+)-Euphorikanin A的全合成。 其中,关键步骤主要涉及:跨环Aldol反应、半缩酮形成以及半频哪醇重排(Transannular aldol addition reaction, hemiketal formation, and subsequent semipinacol rearrangement)构建(+)-euphorikanin A的全部骨架; 位阻异构选择性闭环烯烃复分解(Atroposelective ring-closing olefin metathesis)构建(Z)-双环[7.4.1]十四烯酮骨架。
参考文献:
- [1] D.-Q. Fei, L.-L. Dong, F.-M. Qi, G.-X. Fan, H.-H. Li, Z.-Y. Li, Z.-X. Zhang, Org. Lett. 2016, 18, 2844. doi:10.1021/acs.orglett.6b01093.
- [2] M. J. Classen, M. N. A. Böcker, R. Roth, W. M. Amberg, E. M. Carreira, J. Am. Chem. Soc. 2021, 143, 8261. doi:10.1021/jacs.1c04210.
- [3] Z. Chen, K. Zhao, Y. Jia, Angew. Chem. Int. Ed. 2022, 61, e202200576. doi:10.1002/anie.202200576.
- [4] R. W. Alder, S. P. East, Chem. Rev. 1996, 96, 2097. doi:10.1021/cr940246k.
- [5] J. D. Winkler, B. C. Hong, J. P. Hey, P. G. Williard, J. Am. Chem. Soc. 1991, 113, 8839. doi:10.1021/ja00023a037.
- [6] B. Ma, Y. Zhao, C. He, H. Ding, Angew. Chem. Int. Ed. 2018, 57, 15567. doi:10.1002/anie.201809076.
- [7] C. Wentrup, Angew. Chem. Int. Ed. 2017, 56, 14808. doi:10.1002/anie.201705118.
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载.















No comments yet.