随着有机化学中的明星反应-aldol反应的这系列的介绍,相信大家也对aldol反应的影响力有了一定的了解。
上一篇第三弹中我们主要介绍了手性辅助基的使用(Evans Aldol反应)的强大。在这第四回中,让我们来一起看一下催化剂在不对称aldol反应中发挥的作用。该方向其实早在1990~2000年代的时候发展的特别迅速。
与手性辅助基相比,该方法由于对底物的一般性不是很广,所以直到现在还在进一步研究中。由于实例太多,在这里我们就挑几个代表的阐述一下。
金属催化剂催化的不对称Aldol反应
● 不对称向山Aldol反应
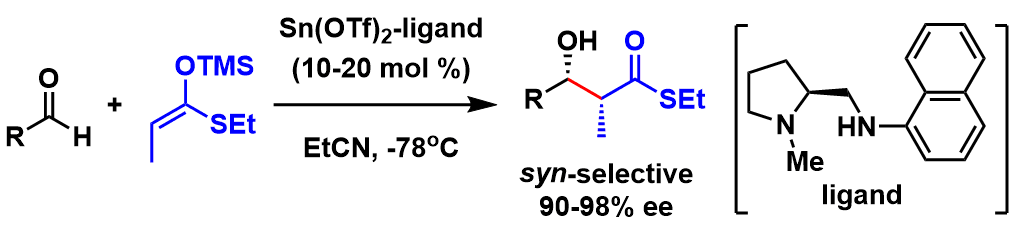
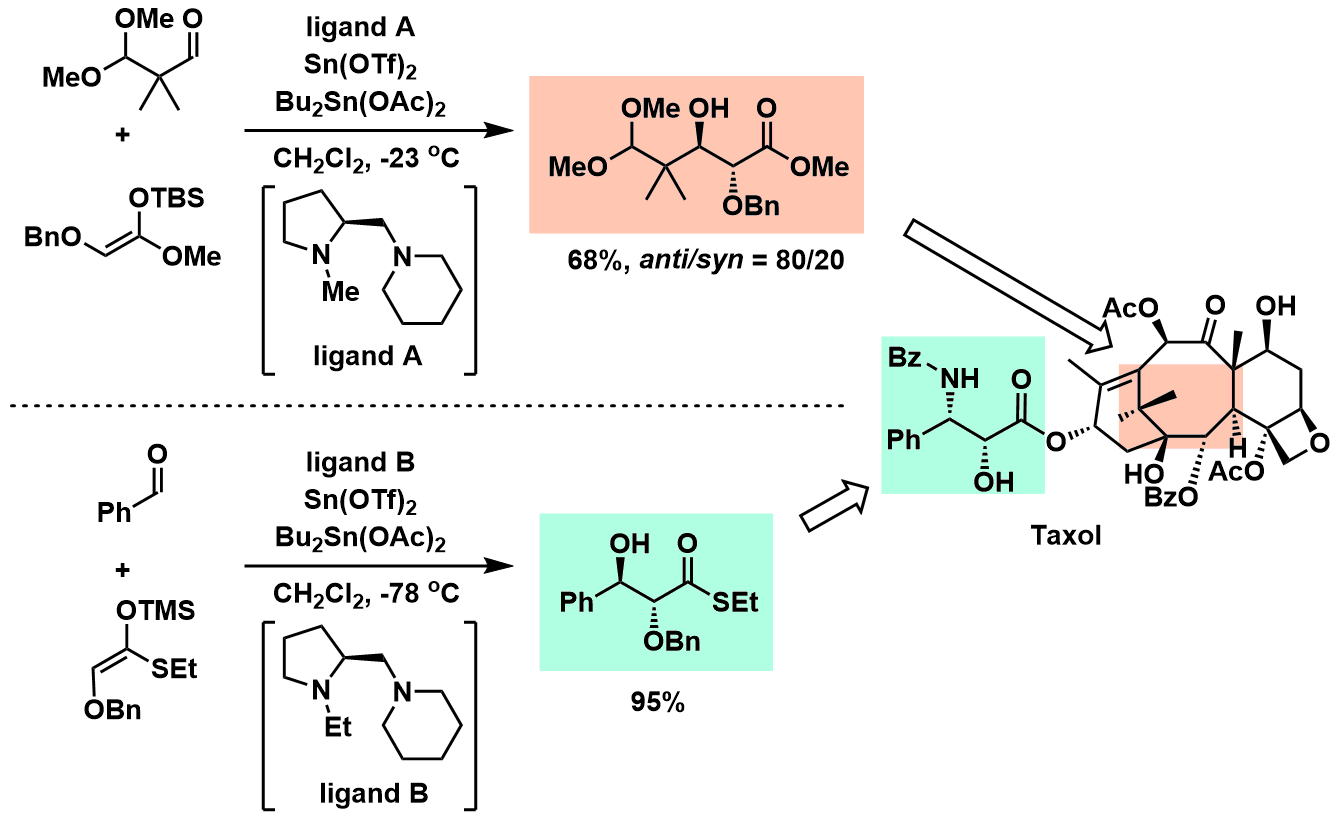
对于催化不对称aldol反应来说,不得不提到它的先驱向山光昭,向山开发出的不对称催化剂揭开了催化不对称aldol反应的序幕。该方法利用三氟甲磺酸锡(II)和脯氨酸衍生的手性配体联用,最终得到了高选择性的aldol加成产物(图1)[1]。 并且在这之后,向山研应用该方法全合成了天然产物紫杉醇(图2)[2]。
图1:向山催化不对称aldol反应
图2:紫杉醇的全合成应用
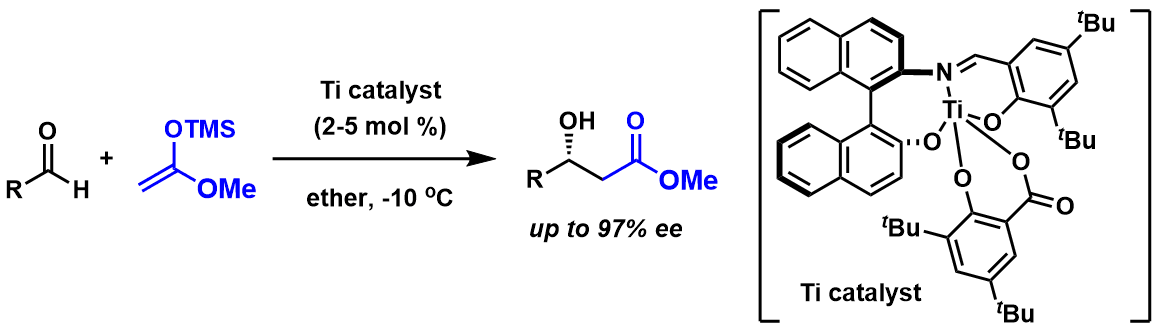
对于α位无取代基的缩醛donor底物,由于立体位阻起不到多大的作用,上回我们介绍的Evans Aldol反应中也提到该类底物的対映选择性普遍很难控制。而对于这类反应实现突破的是Eric M. Carreira(ETH的全合成大牛),他们组开发出了下图中的高位阻的Ti不对称催化剂,该催化剂作为路易斯酸作用,最终攻克了这一难题(图3)。
图3:Carreira催化剂催化的不对称Aldol反应
直接的不对称Aldol反应
在向山法中,我们可以预见反应中会生成与底物等量的含硅的副产物,从原子效率的层面上看,这也是向山法的一大缺陷。而aldol反应在基本原理上其实只是随着proton的移动而进行的反应。所以如果不形成硅代烯醇路线直接进行Aldol反应(direct aldol reaction)的话,那么废弃物也就大大减少了。在当时,由于这一个原子经济・环境调和性上来说,直接Aldol反应仅仅局限在酵素(醛缩酶)上,还没有开发出一种人工催化剂实现这个反应。
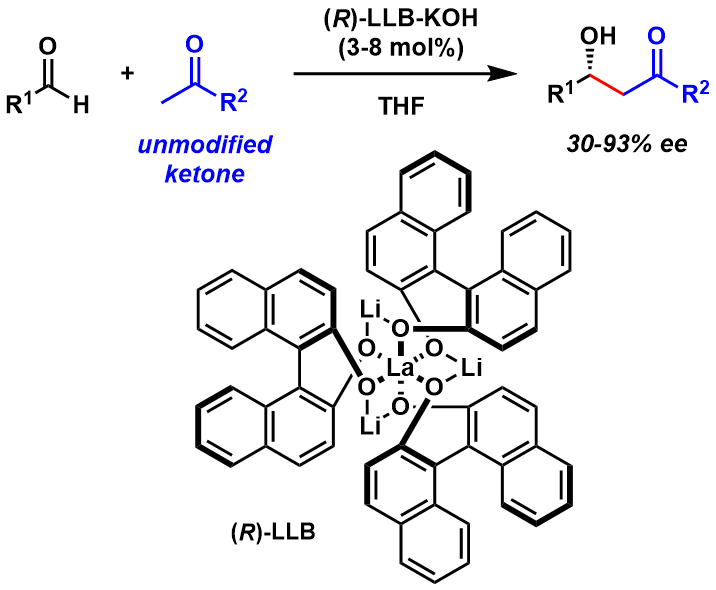
直到东京大学的柴崎正勝研究室开发出了下图所示的镧催化剂后,首次实现了直接的催化Aldol反应[4a]。在那之后又报道了添加KOH(LLB-KOH)的改良法(图4)[4b]。
该方法的发现可谓是打破了一直以来利用硅化烯醇进行Aldol反应的格局,给了世界一个新的视角,开启了Aldol反应研究的新篇章。在这之后的很多研究都是或多或少受到了该方法的启发跟影响。
图4:柴琦的直接催化不对称Aldol反应(世界首次)
水系溶剂中的不对称Aldol反应
有机化学由于需要用到很多有毒溶剂,所以一般来说如果能把反应在水溶液中进行的话,那么对环境的影响或者未来工业应用上是十分有利的。另外还可以应用到很多生物关联的实验中,大大扩大反应应用性。
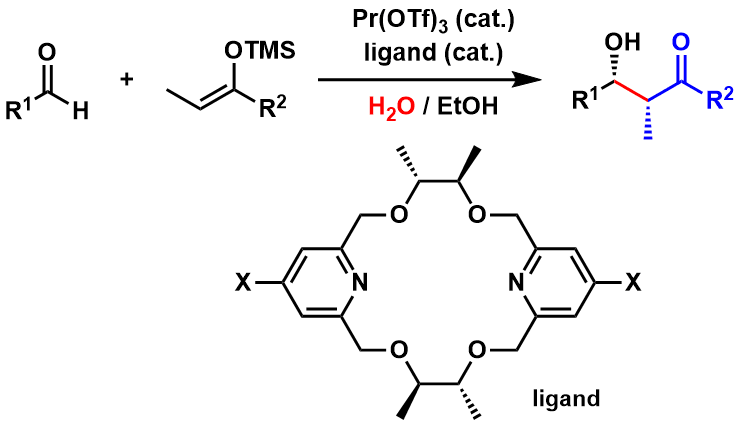
东京大学的小林修等人,也是世界首次成功开发出了在水溶液中也可以进行的催化向山Aldol法[5]。一般来说路易斯酸对氧的亲和性比较大,在水中容易失活,因而被认为是无法实现的,而小林修确打破常规,利用独自开发的稀土类金属三氟甲磺酸盐作为催化剂,化不可能为可能。
图5:小林等人实现的在水溶液中进行的催化不对称Aldol反应
酮作为亲电试剂进行的催化不对称Aldol反应
酮在作为亲电子试剂参与不对称Aldol反应的话,由于酮自身的反应性比较低,而且不对称面选择性差,另外副反应容易发生,与醛的情况相比具有相当大的难度。
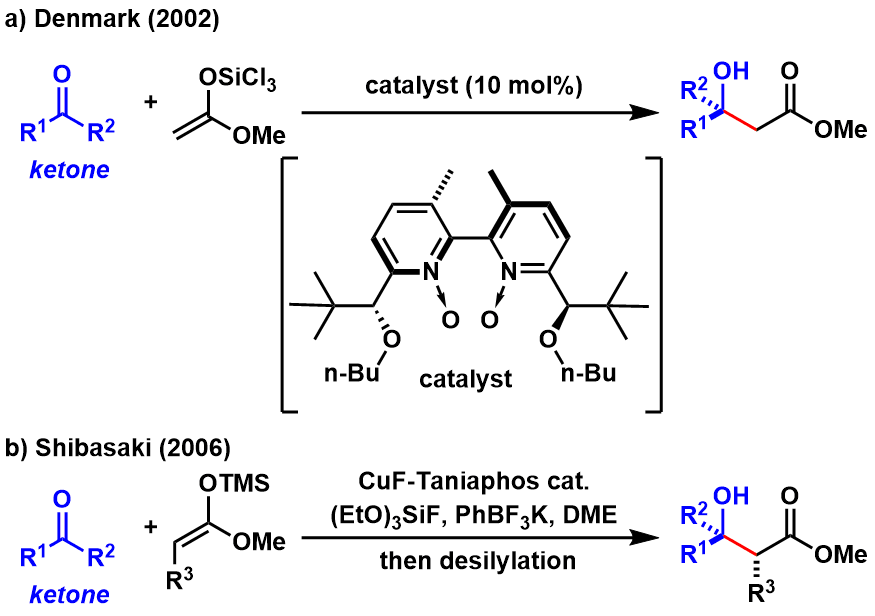
伊利诺伊大学的S.E.Denmark等人开发的手性双氮氧催化剂,在催化三氯甲硅烷基乙烯酮缩醛与酮的aldol反应中,得到了很好的结果,这也拉开了酮与缩醛的催化不对称Aldol反应的序幕 [6a]。在这之后,也就是2006年,柴琦等人又改进了条件,再次扩大了底物的一般性。
图6: 非活性化酮的催化不对称Aldol反应
接着就是有机催化剂的时代
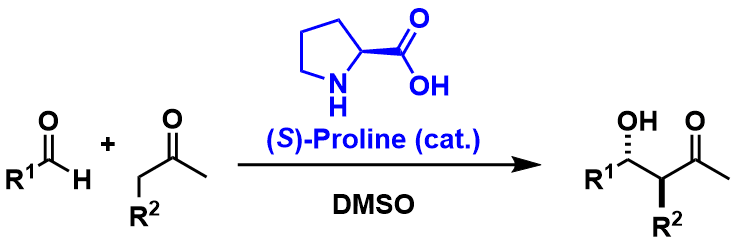
当时scripps研究所的List・Barbas・Lerner等人其实一开始着眼于抗体催化剂的研究,在这研究中他们发现在生物体中单一的氨基酸・脯氨酸居然可以催化Aldol反应[7]。2000年在这千禧年该发现被报道后,一系列围绕脯氨酸催化的研究相继被展开,可以说是有机合成化学史的一次革命!
该反应正如下图中的反应式所示,除了催化剂跟溶剂,其他添加剂啊保护基啊一概不需,那么又是得提到这个原子效率的利用率了,明显在这层面上是别的条件再也无法匹敌的了。另外脯氨酸又便宜,取用简单,相比于金属催化剂又安全无毒,所以是一个十分环保廉价的最理想的催化条件。
同年,MacMillan又开发出了亚胺催化剂,这两种催化剂可谓是当年有机界的热点话题。这两个催化剂的发现就像在燎原上点了一把火,从那以后有机催化剂的研究就开始蔓延到全世界,直到现在依然是很火的研究课题。
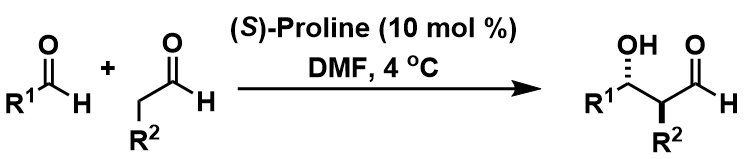
另外利用脯氨酸同样可以实现两种醛之间的手性交叉Aldol反应[8]。(图6)本反应的难点在之前也说过了,主要就是自我缩合与聚合的副反应并发,一直是一个很大的难点。当然这一点也奠定了有机分子催化剂在有机化学中的地位。
图6: 醛之间的交叉型不对称催化Aldol反应
正因为有了这么多的研究人员一步步的努力,一步步的改良,一步步的发现才实现了催化不对称Aldol反应的出世。而从那以后催化剂的开发也成为了一大热门。但是研究没有终点,直到现在Aldol反应的研究还在继续深入着。最前沿的研究潮流的话,已经不再注重于立体控制方向,提高该反应的应用性的研究近年来比较热。也就是说如何利用新型催化剂对目前还无法实现的反应试剂,或者底物的一般性扩展上实现突破,已经成为该研究的主题。
下一回(最终回)的介绍中,让我们一起来看一下一些前沿实例。
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!
関連文献
- (a) Mukaiyama, T.; Kobayashi, S.; Uchiro, H.; Shiina, I. Chem. Lett. 1990, 129. doi:10.1246/cl.1990.129 (b) Kobayashi, S.; Fujishita, Y.; Mukaiyama, T. Chem. Lett. 1990, 1455. doi:10.1246/cl.1990.1455
- Mukaiyama, T.; Shiina, I. et al. Chem. Eur. J. 1999, 5, 121. [DOI]
- Carreira, E. M. et al. J. Am. Chem. Soc. 1994, 116, 8837. DOI: 10.1021/ja00098a065
- (a) Yamada,Y. M. A.; Yoshikawa, N.; Sasai, H.; Shibasaki, M. Angew. Chem. Int. Ed. Engl. 1997, 36, 1871. doi:10.1002/anie.199718711 (b) Yoshikawa, N.; Yamada, Y. M. A.; Das, J.; Sasai, H.; Shibasaki, M. J. Am. Chem. Soc. 1999, 121, 4168. DOI: 10.1021/ja990031y
- (a) Kobayashi, S.; Hamada, T.; Nagayama, S.; Manabe, K. Org. Lett. 2001, 3, 165. DOI:10.1021/ol006830z (b) Hamada, T.; Manabe, K.; Ishikawa, S.; Nagayama, S.; Shiro, M.; Kobayashi, S. J. Am. Chem. Soc. 2003, 125, 2989. DOI: 10.1021/ja028698z (c) 濱田知明, 眞鍋敬, 小林修 有機合成化学協会誌, 2003, 61, 445. doi:10.5059/yukigoseikyokaishi.61.445
- (a) Denmark, S. E.; Fan, Y. J. Am. Chem. Soc. 2002, 124, 4233. DOI: 10.1021/ja025670e (b) Denmark, S. E.; Fan, Y., Eastgate, M. D. J. Org. Chem. 2005, 70, 5235. DOI: 10.1021/jo0506276 (c) Oisaki, K.; Zhao, D.; Kanai, M.; Shibasaki, M. J. Am. Chem. Soc. 2006, 128, 7164.DOI:10.1021/ja061815w
- (a) List, B.; Lerner, R. A.; Barbas, C. F., III J. Am. Chem. Soc. 2000, 122, 2395. DOI:10.1021/ja994280y (b) Notz, W.; List, B. J. Am. Chem. Soc. 2000, 122, 7386. DOI:10.1021/ja001460v (c) List, B.; Pojarliev, P.; Castello, C. Org. Lett. 2001, 3, 573. DOI:10.1021/ol006976y (d) Sakthivel, K.; Notz, W.; Bui, T.; Barbas, C. F., III J. Am. Chem. Soc. 2001,123, 5260. DOI: 10.1021/ja010037z
- Northrup, A. B.; MacMillan, D. W. C. J. Am. Chem. Soc. 2002, 124, 6798. DOI: 10.1021/ja0262378