导读
近日,北京大学杨震/张仲超团队在J. Am. Chem. Soc.中发表论文,首次报道了Janthinoid A的14步不对称全合成,同时整个合成不使用任何保护基。其中,反式十氢萘(trans-decalin)结构通过环氧化物引发的正离子π-环化反应构建,而刚性的氧杂双环[3.2.1]辛z(oxabicyclo[3.2.1]octane)结构则通过Fe(ClO4)3介导的氧化串联环化反应构建。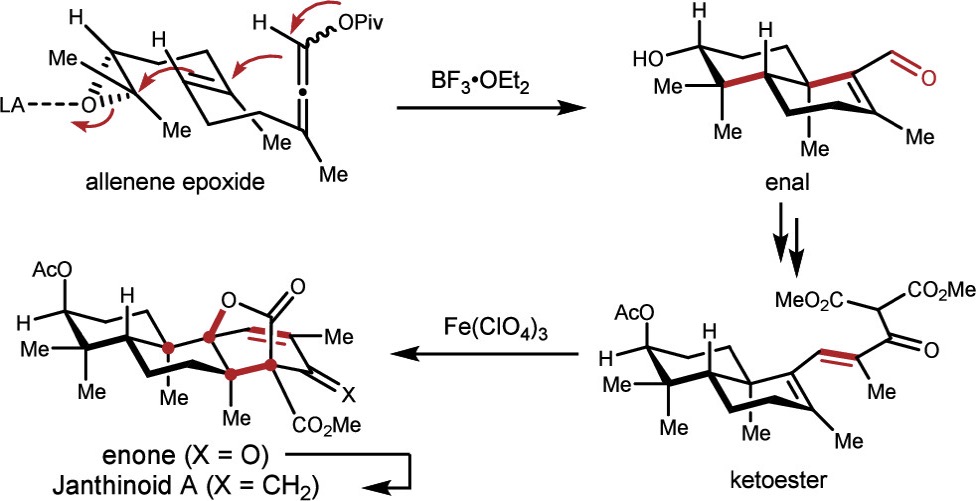
Asymmetric Total Synthesis of Janthinoid A
F. Tang,# Z. Zhang,*,# Z. Song, Y. Li, Z. Zhou, J. Chen, Z. Yang*
J. Am. Chem. Soc. 2025, ASAP. doi:10.1021/jacs.4c17480.
正文
由3,5-Dimethylorsellinic acid(DMOA)衍生的meroterpenoids数量已经超过200多种(Figure 1),其多样性的结构和独特的生物活性也使得该类meroterpenoids受到广泛关注。Porco、Jr.、Maimone、Newhouse、Li 和 Xie 等研究团队已成功完成了多种重要 DMOA 衍生的meroterpenoids的全合成,包括 simplicissin (2),berkeleyone A (3),andrastin D (4) 及一些相关的同系物。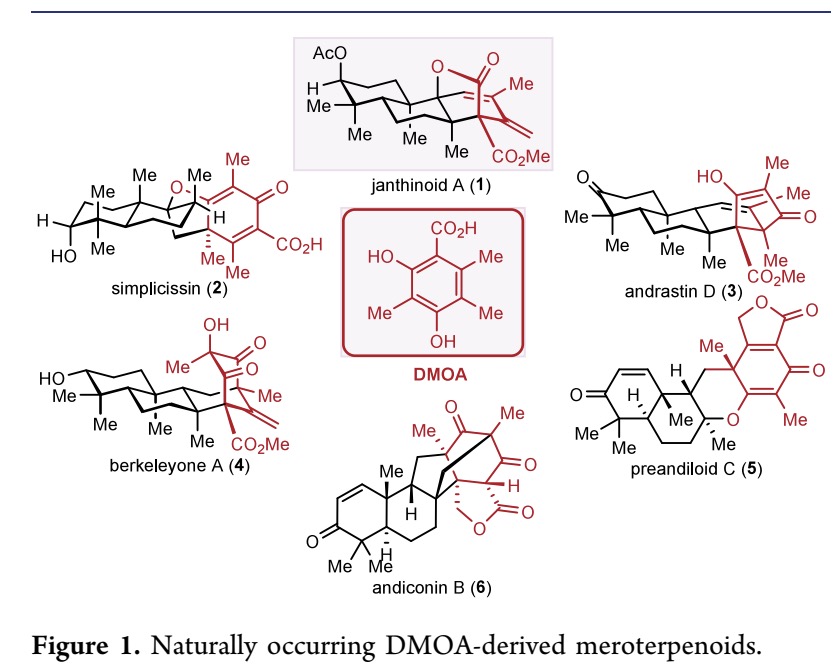
2021年,Zhang 团队从烟草内生真菌 Penicillium janthinellum TE-43 中分离出了一种新型 DMOA 衍生的tri-nor-meroterpenoid janthinoid A (1) [1]。Janthinoid A (1) 具有高张力的氧杂双环[3.2.1]辛烷(oxabicyclo[3.2.1]octane)骨架,同时包含四个连续的四级碳立体中心,并且存在一个刚性的内酯结构。Janthinoid A在体内对NSCLC细胞A549表现出抗肿瘤活性,其结构通过核磁光谱(NMR)分析和单晶 X 射线衍射解析确定。
由于刚性氧杂双环[3.2.1]辛烷(oxabicyclo[3.2.1]octane)骨架在化学选择性、区域选择性和立体化学控制等方面的挑战,作者旨在开发一种新颖且简洁的策略,以构建这一独特骨架,并完成 janthinoid A (1) 的全合成。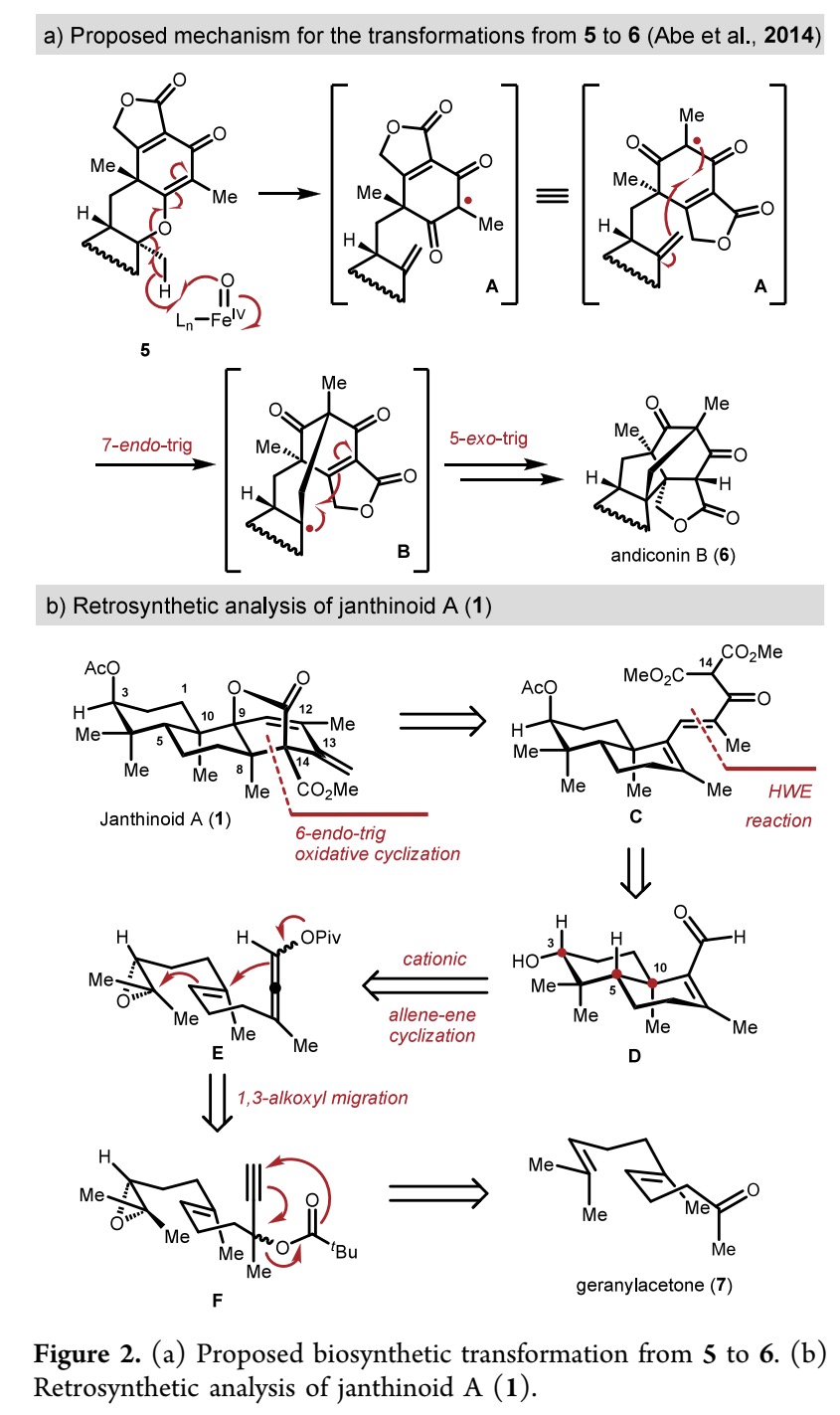
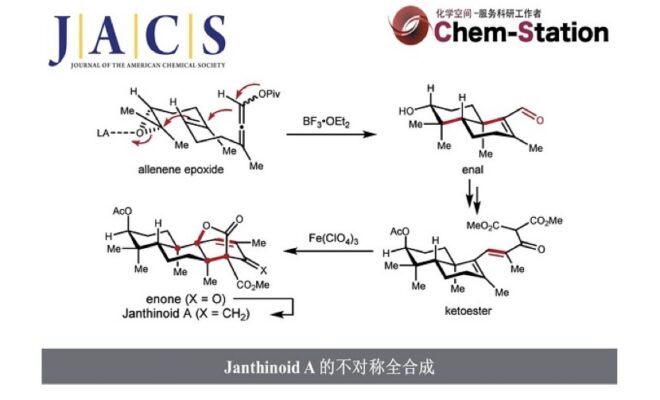
2014年,Abe 团队提出 andiconin (6) 可由 preandiloid C (5) 生物合成,其中涉及非血红素Fe依赖性氧化酶(Fe-dependent oxygenase-initiated)介导的经中间体 A 和 B的自由基串联环化(Figure 2a)[2]。在本研究中,作者报道了以无保护基策略完成了 janthinoid A 的14 步全合成。
通过逆合成分析,作者设想氧杂双环[3.2.1]辛烷骨架可通过酮酯 C 的一系列氧化、双键异构化、6-endo-trig 自由基环化及分子内的氧化内酯化(oxidative lactonization) 构建,而反应的位点选择性则取决于 C14 质子的酸性(Figure 2b)。作者计划由反式十氢萘(trans-decalin)醛 D通过 Horner−Wadsworth−Emmons(HWE)反应 和缩合反应构建化合物 C,而化合物 D 则可通过一种新颖的策略从炔丙酯 E 立体选择性的合成,该策略涉及分子内1,3-acyloxy 迁移及后续的环氧化物引发的正离子 π-环化反应(经中间体 F)。炔丙酯 F 可由香叶基丙酮(geranylacetone)合成。
作者首先研究了从香叶基丙酮(7)出发,不对称合成反式十氢萘醛 11(Scheme 1)。作者的目标是设计一种新策略来合成decalin 体系,以C3−C4 环氧化物的手性来控制整个过程的立体化学,一步从联烯-烯化合物(allene-ene)10 得到具有三个新的立体中心的醛 11。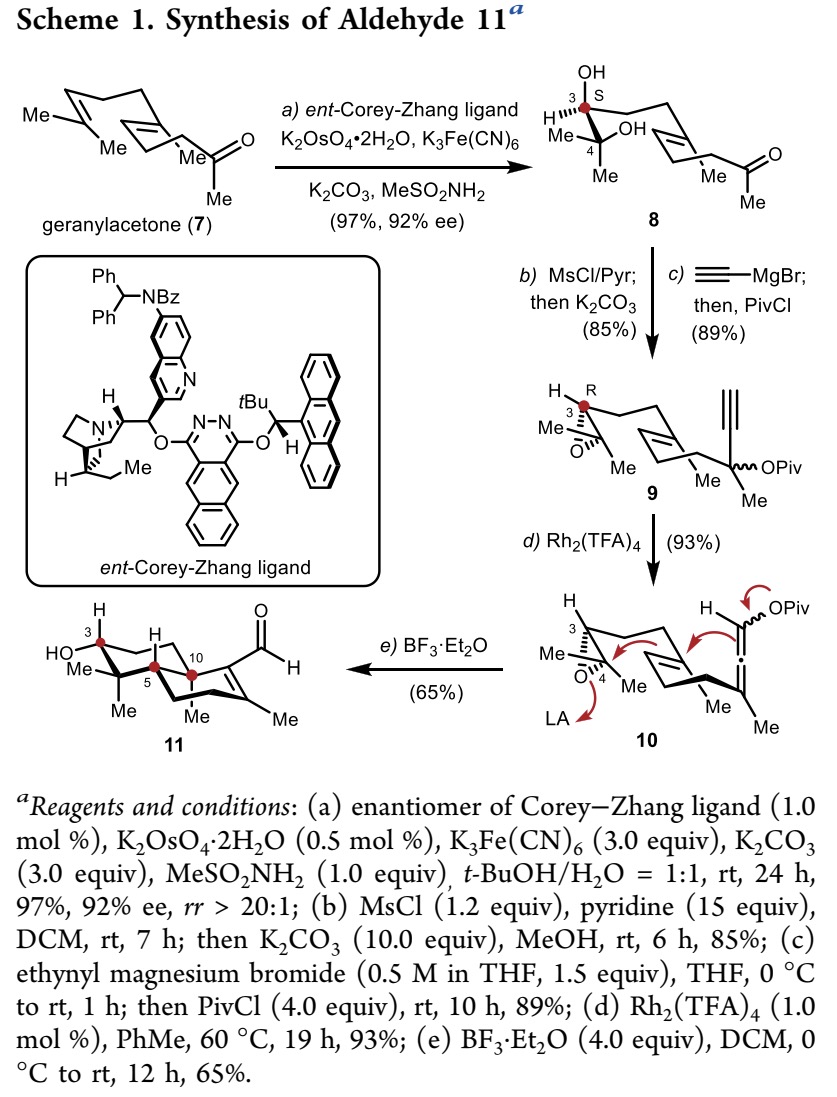
为了确保醛11中 C10 立体中心为 R 构型,作者使用ent-Corey−Zhang 配体对香叶基丙酮(7)进行了立体选择性的双羟化反应,得到二醇8,其中 C3 处为 S 构型,收率 97%,对映选择性为 92%[3]。随后,二醇 8 选择性的与 MsCl/吡啶反应,再经 K2CO3/甲醇处理后可立体选择性的得到环氧化物9。所得到的酮9经 Grignard 反应和酰化反应后得到环氧化物10,三步反应收率为77%。
接下来,作者计划将 9 中的炔丙酯基团转化为相应的联烯结构,进一步通过Lewis酸介导的环氧化物引发正离子π-环化反应合成醛11。为此,作者用催化量的Rh2(TFA)4(1.0 mol%)处理9,以93%的收率得到联烯-烯化合物10。当化合物 10 用 BF3·Et2O(4.0 equiv)在DCM中处理时,可以以65%的收率得到醛11,实现了一种简洁新颖的反式十氢萘醛 11 的合成策略。
在高效且可规模化合成醛11后,作者开始尝试制备酮酯18(Scheme 2)。为此,化合物11经过DMP 氧化/HWE 反应,可以以69%的总收率得到单一的区域异构体酮酯14。随后,酮酯14 经过 K-selectride 处理可以以81%的收率转化为醇 15,随后在氢氧化锂的条件下水解酯基,得到羟基酸 16。化合物14和16的结构通过单晶 X 射线衍射得到确认。随后,羟基酸化合物 16中的羟基经过酰化反应,可以得到 17。之后,羧酸17转化为相应的酰氯,再与 1,3-二甲氧基-3-氧代丙-1-烯-1-醇钾(potassium 1,3-dimethoxy-3-oxoprop-1-en-1-olate)反应,以70%的收率得到三羰基化合物18。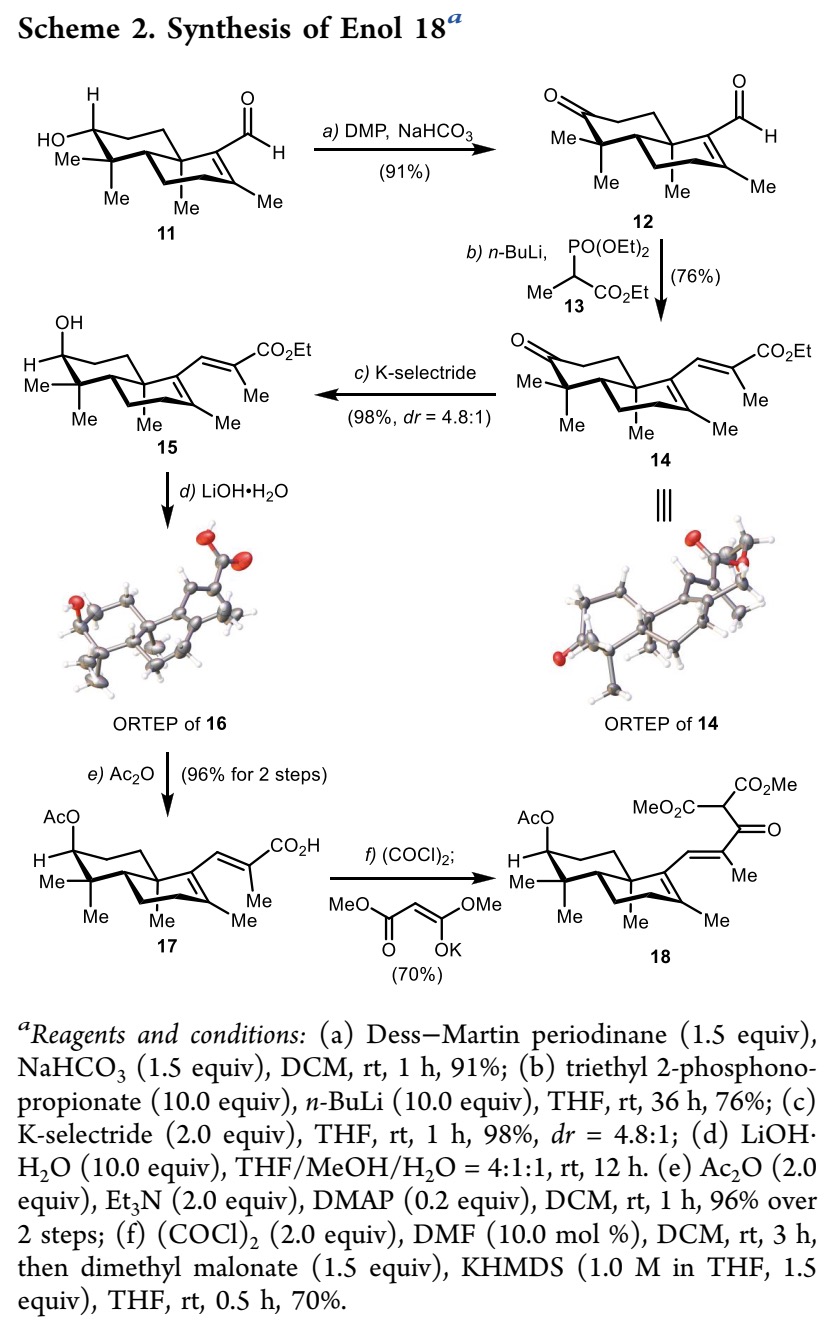
作者随后研究了关键的区域选择性和立体选择性构建氧杂双环[3.2.1]辛烷骨架反应(Table 1)。当酮酯18在常见的氧化环化(oxidative cyclization)条件(Mn(OAc) 3 和 Cu(OAc)2)下反应时,并未观察到预期的环化产物19 (entry 1)。尝试在MeCN和 DCM中用 Mn(OAc)3 和 Cu(OAc)2 氧化 18 也未发生反应(entries 2 和 3)。然而,在 DCM 中加入 TfOH (1.0 equiv) 并使用 Mn(OAc)3 进行氧化时,可以成功得到目标产物 19,但收率仅为20%(entry 4)。随后,作者通过单晶 X 射线衍射分析确定了19的结构(Scheme 3)。后续对Mn(OAc)3反应条件系统性的优化,并未使产率得到提升。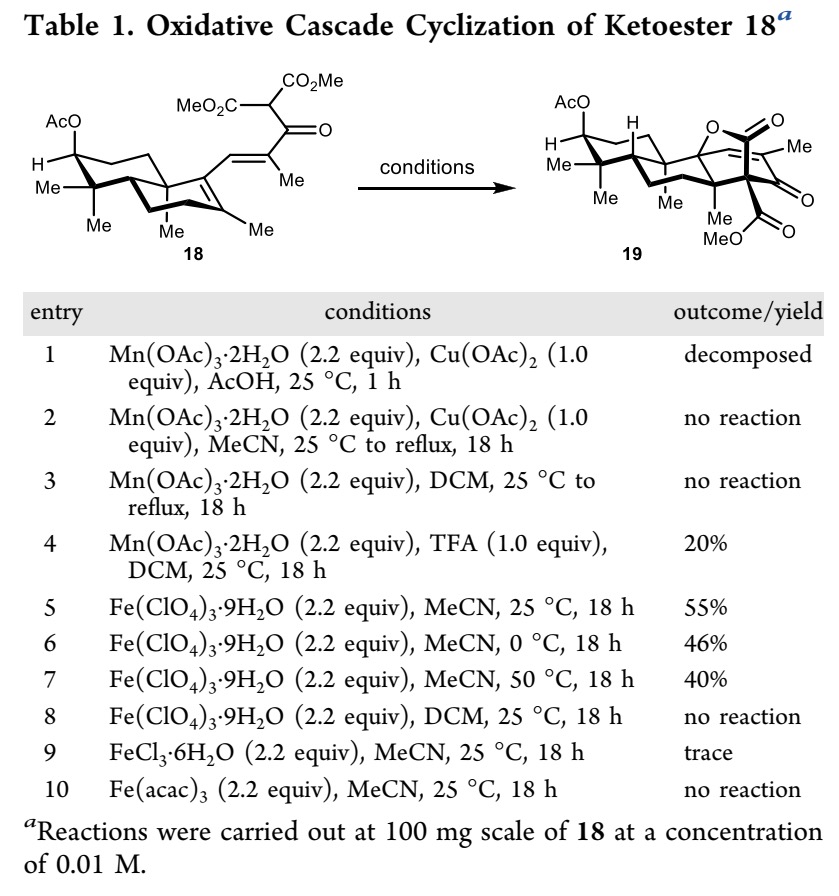
由于酸性 Fe(ClO4)3·9H2O作为高效的氧化剂已被报道用于复杂分子的合成中,因此作者尝试用 Fe(ClO4)3·9H2O 来介导18发生环化反应19[4]。当酮酯18在CH3CN中用Fe(ClO4)3·9H2O 处理,同时在25°C反应18小时,可以以55%的收率得到目标环化产物19(entry 5)。随后,作者尝试在不同温度下进行环化反应,但产率下降(entries 6 和 7)。此外,当使用DCM 作为溶剂进行反应时,由于溶解性差,未能发生反应(entry 8)。同时作者测试了其他铁类氧化剂,如FeCl3 和Fe(acac)3,但均未获得较好的结果(entries 9和10)。(关于该反应机理的简要讨论可以在补充信息中找到。)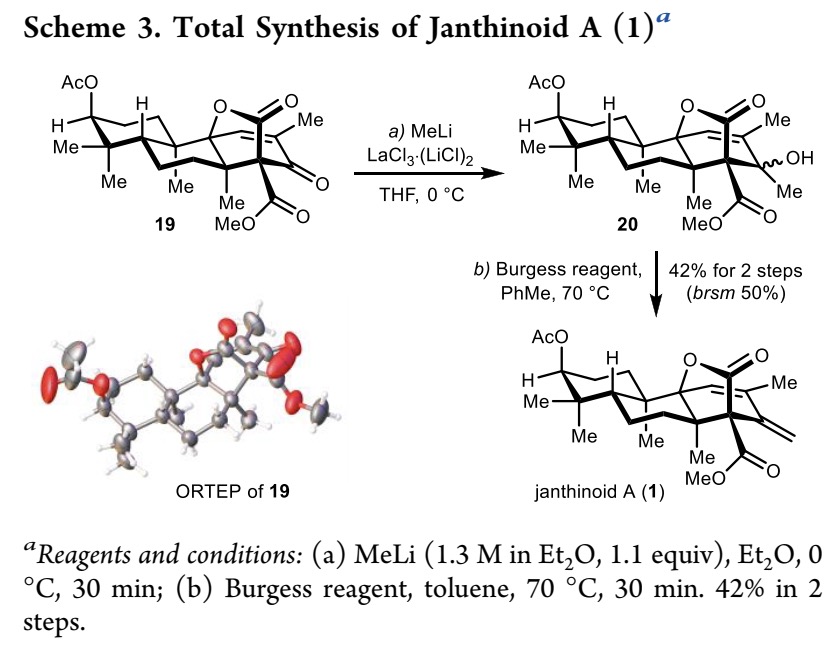
为了实现Janthinoid A (1) 的全合成,作者最后需要将19中的羰基转化为相应的亚甲基。化合物19在LaCl3·2LiCl 存在下,在0°C下用MeLi处理,可以得到三级醇20,随后在Burgess试剂的条件下脱水得到最终的目标产物1,两步总收率为42%(Scheme 3)。其结构可以通过光谱数据(1H NMR和13C NMR)来证实,同时,合成的Janthinoid A (1)旋光度数据与天然产物报道的数据吻合。
总结
杨震/张仲超团队首次实现了 Janthinoid A的不对称全合成,同时整个合成不使用任何保护基。以商品可得的香叶基丙酮为起始原料,经过14 步反应可以高效合成Janthinoid A。Lewis酸介导的正离子 allene-ene 环化和 Fe(ClO4)3促进的氧化环化反应分别为反式十氢萘醛11和氧杂双环[3.2.1]辛烷结构19的区域选择性和立体选择性构建提供了新策略。
参考文献
- [1] Li, X. D.; Su, J. C.; Jiang, B. Z.; Li, Y. L.; Guo, Y. Q.; Zhang, P. Org.Chem. Front. 2021, 8, 6196-6202, DOI: 10.1039/D1QO01066B.
- [2] Matsuda, Y.; Wakimoto, T.; Mori, T.; Awakawa, T.; Abe, I. J. Am. Chem. Soc. 2014, 136, 15326-15336., DOI: 10.1021/ja508127q.
- [3] (a) Corey, E. J.; Zhang, J. Org. Lett. 2001, 3, 3211-3214, DOI: 10.1021/ol016577i. (b) Boyko, Y. D.; Huck, C. J.; Ning, S.; Shved, A. S.; Yang, C.; Chu, T.; Tonogai, E. J.; Hergenrother, P. J.; Sarlah, D. J. Am. Chem. Soc. 2021, 143, 2138-2155, DOI: 10.1021/jacs.0c12569.
- [4] (a) Citterio, A.; Sebastiano, R.; Nicolini, M.; Santi, R. Synlett, 1990, 1990, 42-43, DOI:10.1055/s-1990-20980. (b) Citterio, A.; Cerati, A.; Sebastiano, R.; Finzi, C.; Santi, R. Tetrahedron Lett. 1989, 30, 1289-1292, DOI: 10.1016/S0040-4039(00)72739-0.
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载.
关注Chem-Station抖音号:79473891841
















No comments yet.