本文作者:杉杉
导读
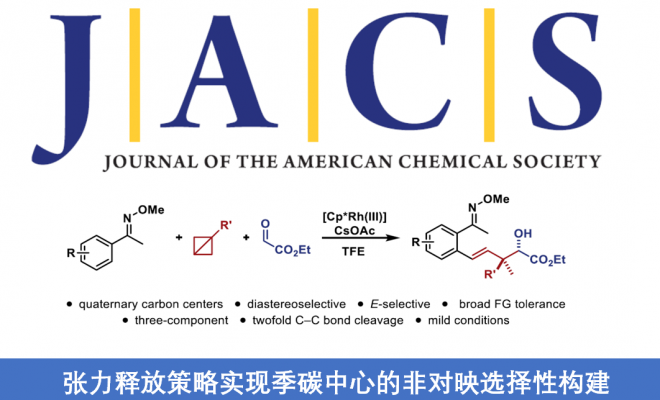
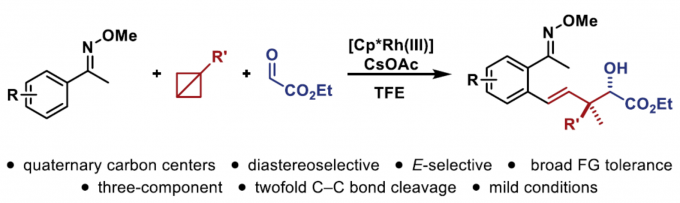
近日,德国明斯特大学Frank Glorius 教授课题组在JACS上发表论文,报道了一种张力释放(strain-release)策略,成功构建了具有季碳中心的化合物,具有极好的非对映选择性。同时,该反应涉及Cp*Rh(III)催化C-H活化生成有机金属配合物,然后在三组分反应中与具有张力的双环丁烷(BCBs)和前手性碳亲电试剂偶联。此外,合成的产物可进一步转化为具有价值的α-季碳β-内酯衍生物。初步机理研究表明,反应涉及σ-键插入和β-碳消除的双重C-C键断裂的串联过程。
Use of Strain-Release for the Diastereoselective Construction of Quaternary Carbon Centers
Tobias Pinkert, Mowpriya Das, Malte L. Schrader, and Frank Glorius*
J, Am. Chem. Soc.2021, 143, 7648-7654.DOI: 10.1021/jacs.1c03492
正文
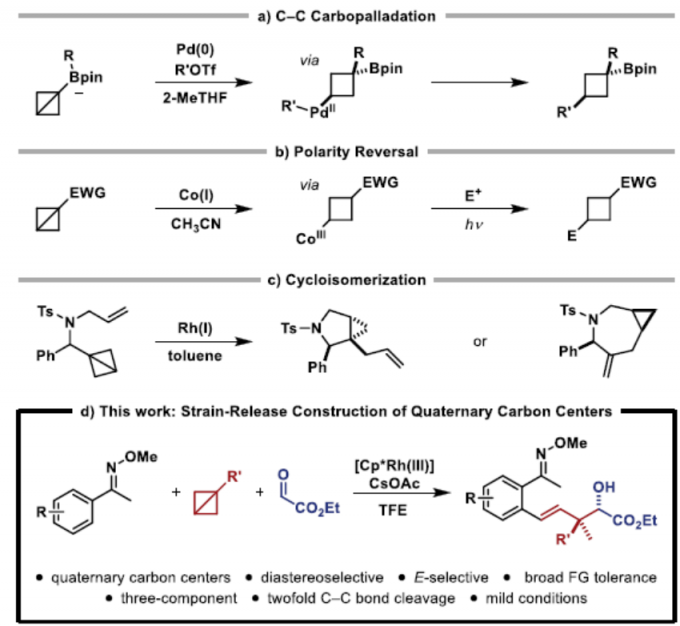
在过去的几十年中,张力释放策略在有机化学、材料科学和生物化学方面备受关注。因此,对于碳/氮原子之间具有桥联的化合物,如[1.1.1]丙炔、双环[1.1.0]丁烷(BCBs)或1-氮杂双环[1.1.0]丁烷已成为一类独特的化合物。同时,由于键长和键角扭曲、扭转张力等因素,从而导致其相对不稳定。自2016年Baran课题组[1]报道了通过张力释放策略构建C-N键以来,其他的课题组也陆续对其进行相关的研究。2019年,Aggarwal课题组[2]通过C-C键的碳钯化反应,从而进一步扩展了BCB的范围,再经交叉偶联反应即可获得具有价值的双官能化硼酸环丁酯(Figure 1a)。同时,为了克服缺电子BCBs固有的亲电反应性,Gryko等[3]报道了一种极性反转方法,通过Co(I)催化光诱导Co(III)-烷基配合物均相裂解以生成亲核自由基,可与亲电试剂偶联得到双取代的环丁烷(Figure 1b)。然而,对于过渡金属催化BCBs的反应却很少被研究。Wipf等[4]提出了一种过渡金属催化BCBs反应的机理,即BCBs可能经历Rh(I)催化的环异构化-环丙烷化串联过程,从而形成吡咯烷和氮杂环庚烷(Figure 1c)。因此,仍需开发一种新颖的金属催化BCBs方法。在此,德国明斯特大学Frank Glorius 教授课题组提出了一种张力释放策略,成功构建了具有季碳中心的化合物,具有极好的非对映选择性(Figure 1d)。
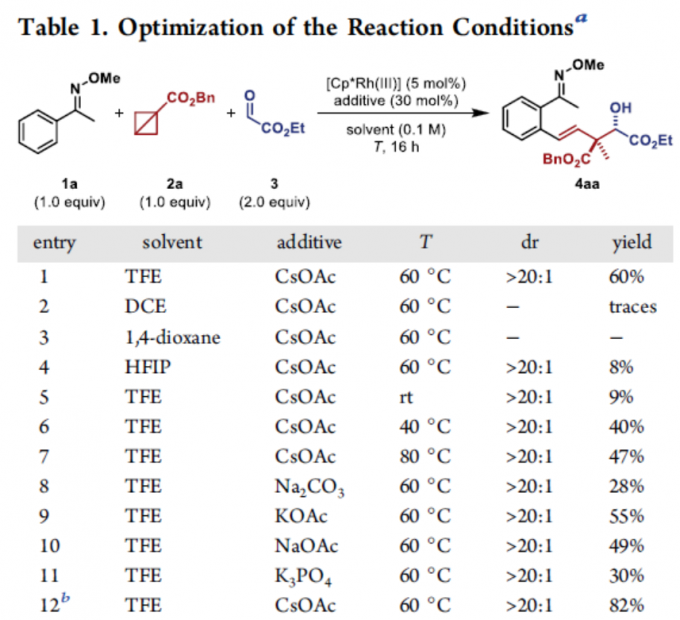
首先,作者以肟醚1a、苄基BCB酯2a和乙醛酸乙酯3作为模型底物,进行了相关反应条件的筛选(Table 1)。反应的最佳条件为:以[Cp*Rh(CH3CN)3](SbF6)2为催化剂,CsOAc为碱,可在TFE溶剂中60 °C反应,从而获得82%收率的目标产物4aa,dr > 20:1。
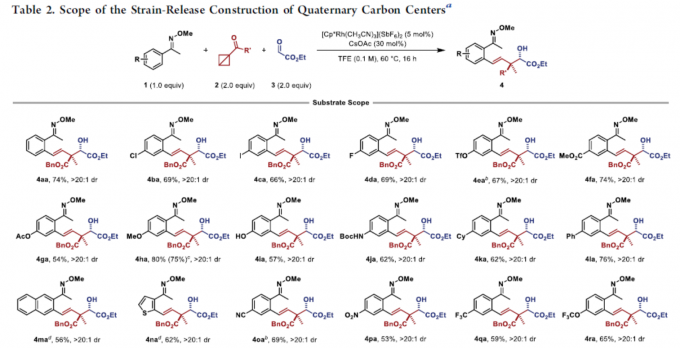
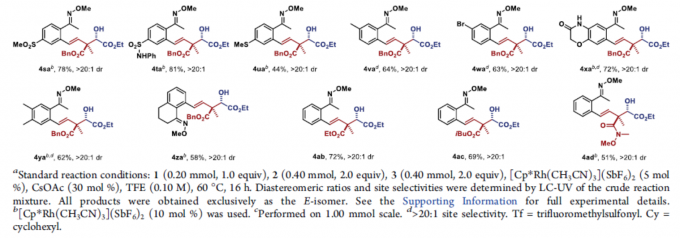
在获得上述最佳反应条件后,作者开始对肟醚底物1和BCB酯底物2进行了扩展(Table 2)。肟醚底物1的芳基上含有卤素(4ba–4da和4wa)、三氟甲磺酸酯(4ea)、酯基(4ga)、给电子取代基(4ha–4ja)、缺电子取代基(4oa–4ua)、萘基(4ma)、噻吩基(4na)以及具有空间位阻的取代基(4ka和4la),均可顺利反应。同时,对于二取代的底物,以中等至良好的收率获得相应的产物4xa和4ya。对于具有较大空间位阻的底物,也可顺利反应,获得产物4za。此外,其它的BCB酯也与体系兼容,如4ab,4ac和4ad。
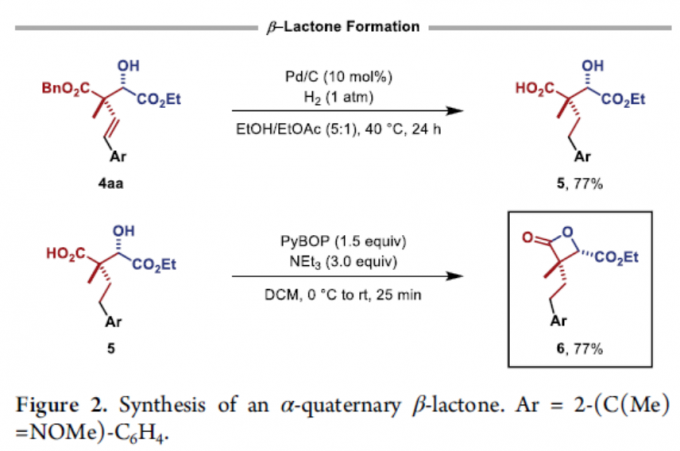
为了进一步证明反应的实用性,作者将产物进行了进一步的衍生化(Figure 2)。当使用Pd/C作为催化剂,化合物4aa可进行脱苄基化和氢化反应,获得羧酸5。同时,羧酸5可在PyBOP和NEt3条件下进一步反应,获得具有α-季碳中心的β-内酯化合物6,且未发生异构化。
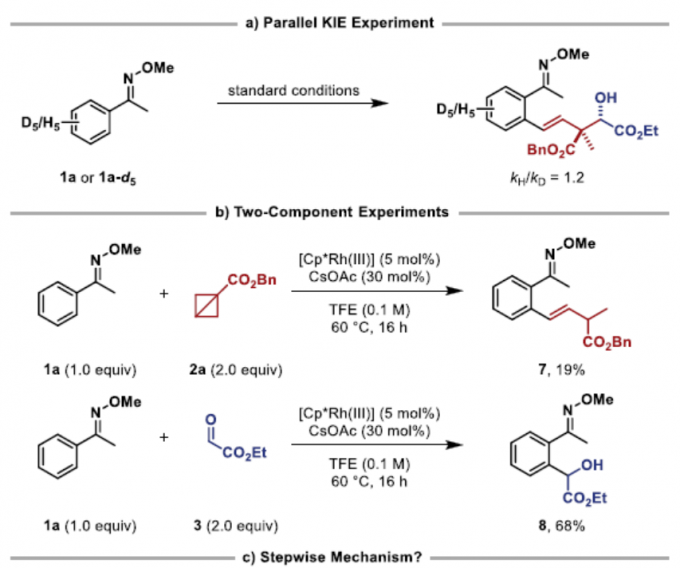
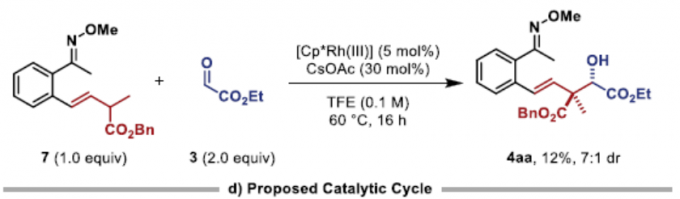
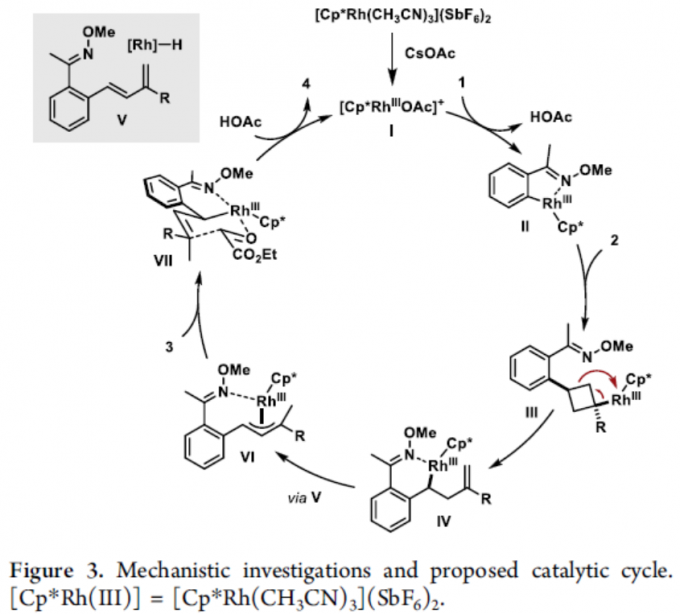
为了进一步了解反应的机理,作者进行了相关的对照实验(Figure 3)。首先,通过两个平行KIE实验(KIE值为1.2)表明,C-H活化过程可能不是速率确定步骤(Figure 3a)。同时,在两组分实验中,如1a和2a反应可获得19%收率的烯烃化的产物7,1a和3反应可获得68%收率的醇8(Figure 3b)。这些结果表明,反应可能涉及初始的重排-烯化反应和随后的羟醛加成机理。然而,当烯烃7和醛3在标准条件下反应时,仅获得收率且dr较低的产物4aa(Figure 3c)。因此,逐步机理也不太可能进行。基于上述的讨论,作者提出了一种可能的反应机理(Figure 3d)。首先,[Cp*Rh(CH3CN)3](SbF6)2和CsOAc通过配体交换,形成配合物I。紧接着,肟醚1配位至金属中心,并且通过C-H活化而形成铑环中间体II。BCB酯2与金属中心缔合,并插入Rh-C键中,得到Rh-环丁基中间体III。随后,中间体III经β-碳消除生成中间体IV,可进一步转化为π-烯丙基配合物VI(涉及syn–β-负氢消除和重新插入的串联过程)。同时,在经椅式过渡态VII时,π-烯丙基配合物VI可异构化为相应的σ-烯丙基中间体,从而导致立体化学选择性。最后,通过加氢脱金属化可获得产物4,并再生催化剂I,从而完成催化循环。
总结
德国明斯特大学Frank Glorius 教授课题组报道了一种张力释放策略,使用Cp*Rh(III)为催化剂,成功实现了BCBs的三组分反应,从而合成一系列具有季碳中心的化合物。同时,该反应具有良好的非对映选择性、广泛的底物范围、良好的官能团耐受性、温和的反应条件等特点。此外,合成的产物可进一步转化为具有α-季碳中心的β-内酯衍生物。初步机理研究表明,反应涉及C-C σ-键的插入、β-碳消除以及通过六元过渡态进行烯丙基化的串联过程。























No comments yet.