上一期小编介绍了由日本Hokkaido大学药学部 (Faculty of Pharmaceutical Sciences, Hokkaido University, 北海道大学薬学部)的Yonemitsu (米光 宰, Yonemitsu Osamu)研究室发展的Yonemitsu三组分缩合方法学[1]。该方法学为各类亲核性杂环化合物的区域选择性官能团化开辟了一种全新的方法。然而,对于部分底物,可能需要采用具有较强毒性与腐蚀性的TiCl4试剂以及具有潜在致癌性的DCM作为溶剂,造成一定程度的环境问题。此外,还有部分底物,必须对第一步的Knövenagel缩合产物进行分离纯化,因此,具有较差的pot-economy。从而使该方法学在工业中的应用受到限制。为使该反应符合绿色化学的设计理念,提高反应的pot-economy,进而更好地适应工业生产,近期,诸多课题组对Yonemitsu三组分缩合方法学所采用的的催化剂、溶剂等反应条件进行了进一步改进。本期小编将对Yonemitsu三组分缩合方法学的近期研究进展进行详细介绍。
概要
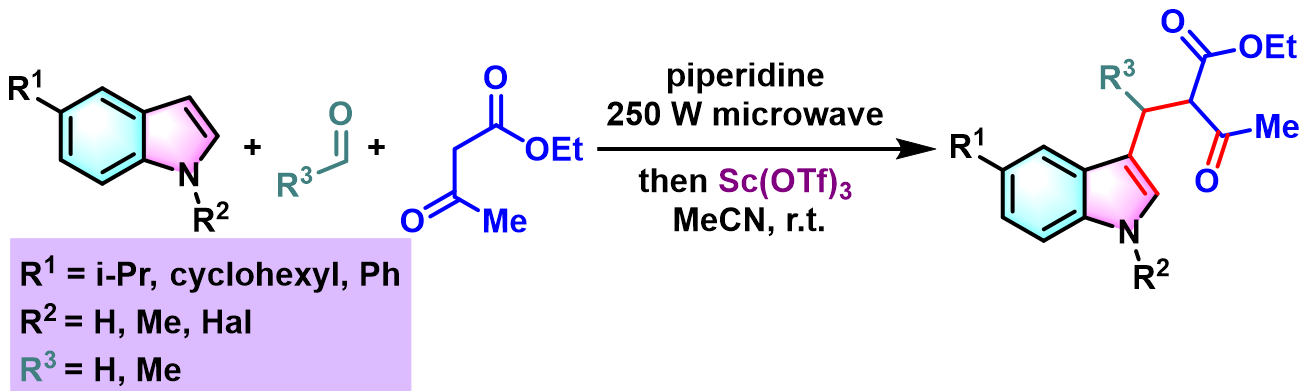
2014年,A. Tolomelli小组发现在微波辐射条件下,采用催化量的三氟甲磺酸钪促进的Yonemitsu三组分缩合,可以使催化剂用量进一步降低,并极大缩短了反应时间 (针对第一步的Knövenagel缩合)。同时,可以避免Knövenagel中间体的分离与纯化,具有良好的pot-economy[2]。
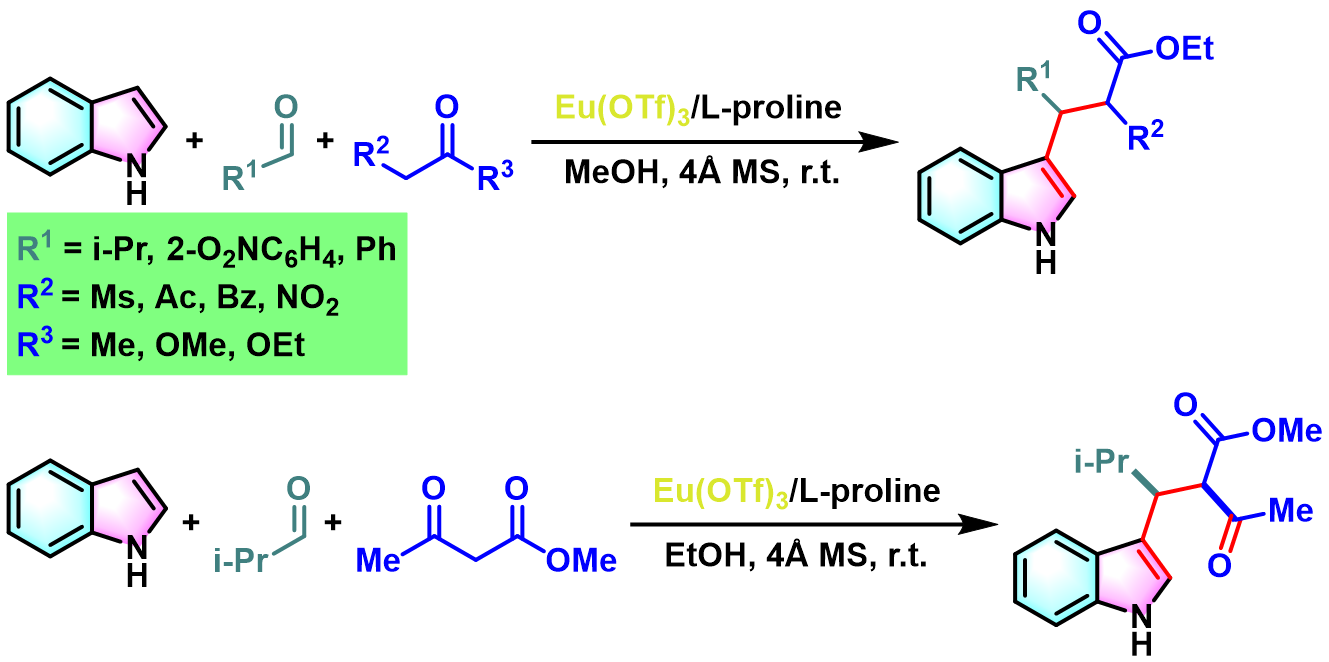
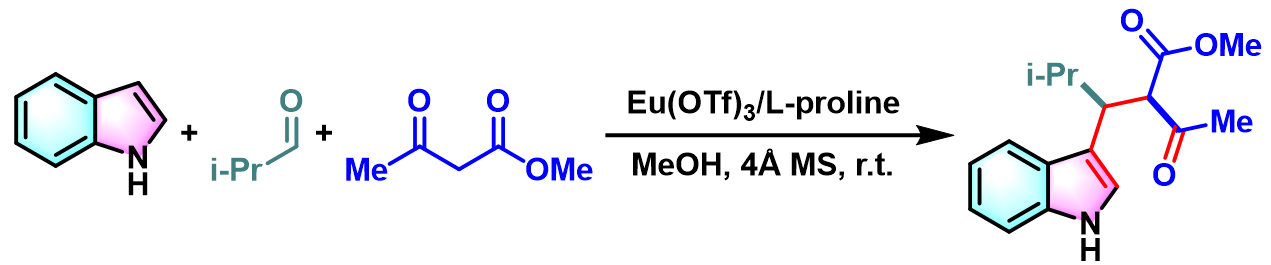
与此同时,A. Renzetti研究表明,通过L-proline与三氟甲磺酸铕催化体系促进的Yonemitsu三组分缩合,同样可以获得优良的收率与较高的非对映选择性[3]。同时,避免了腐蚀性试剂TiCl4与TiCl2(OiPr)2的使用,对环境更加友好[3]。
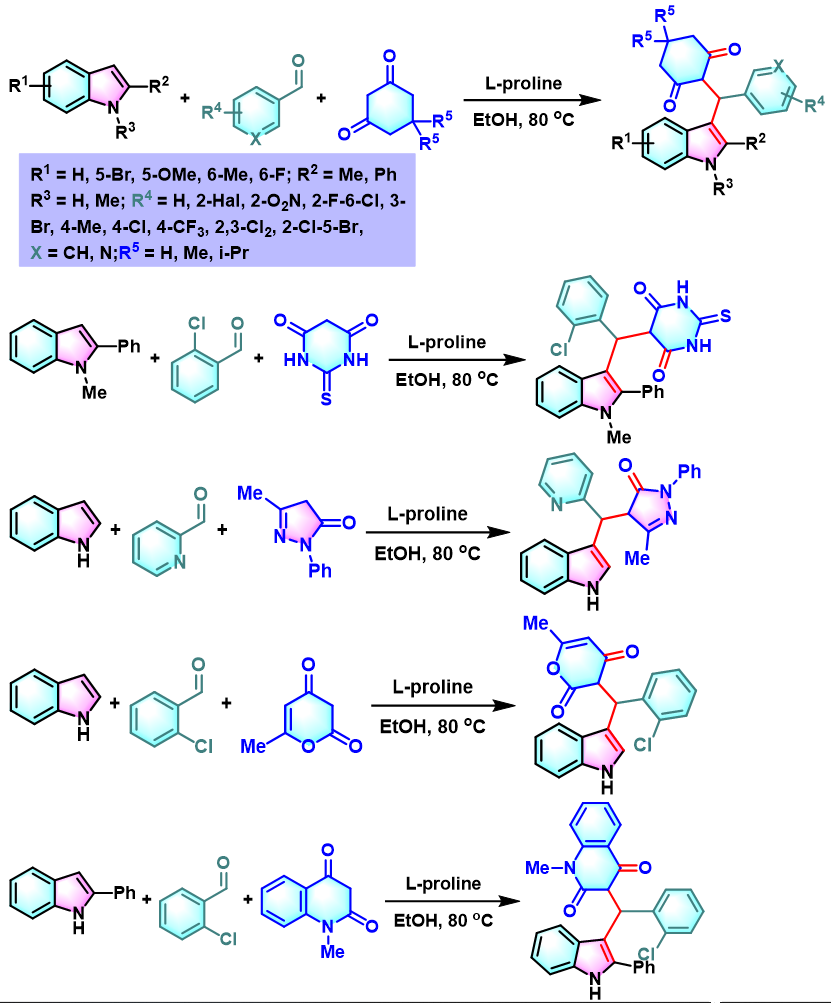
接下来,Gu发现,采用手性的L-脯氨酸,可以将Yonemitsu三组分缩合的应用范围进一步扩展至噻吩、杂环芳香醛及各类环状活泼亚甲基化合物,并获得较高的收率[4]。
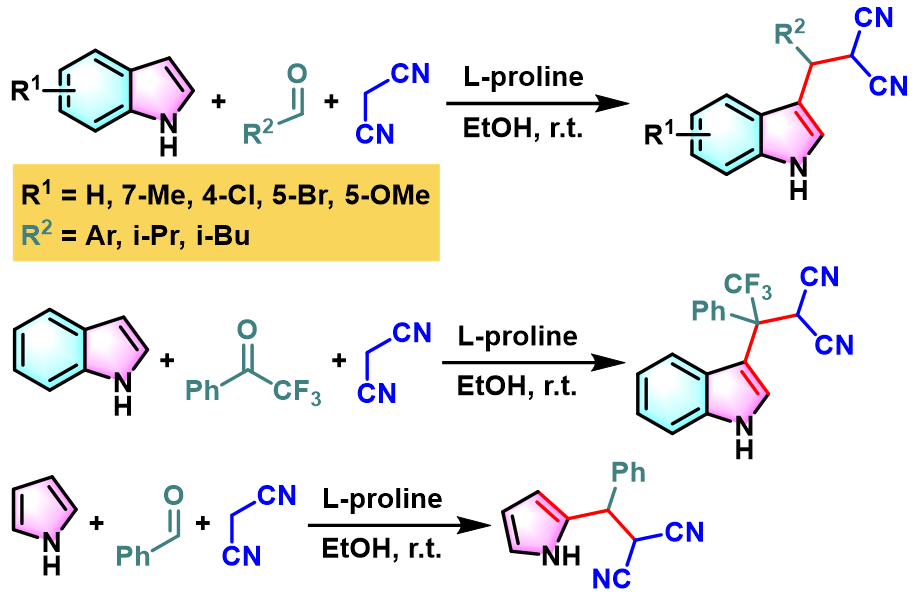
之后,Y. He与Z. Guan进一步将L-脯氨酸催化的条件应用于取代吲哚与芳香醛及丙二腈的三组分缩合,以温和的反应条件与优良的收率获得3-吲哚衍生物[5]。同时,作者发现该反应条件对于吡咯与三氟甲基苯乙酮同样适用。
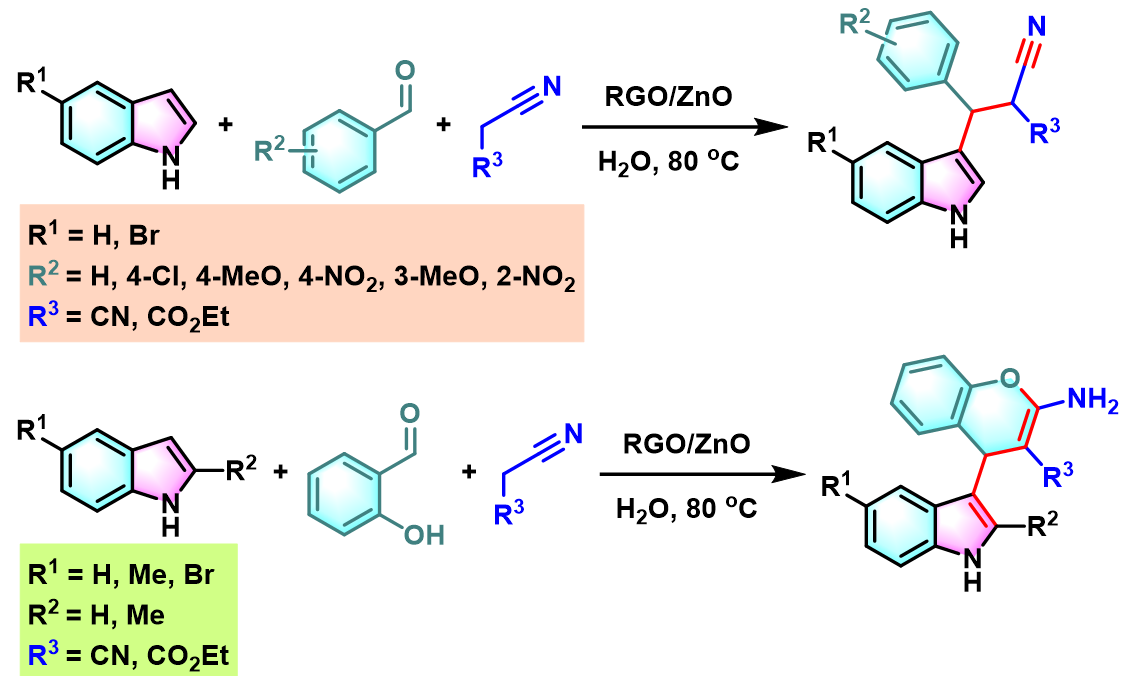
2015年D. S. Rawat通过RGO (reduced graphene oxide)/ZnO纳米粒子异相催化剂,顺利完成水相条件下,取代吲哚与芳香醛及丙二腈或氰基乙酸乙酯之间的Yonemitsu三组分缩合[6]。
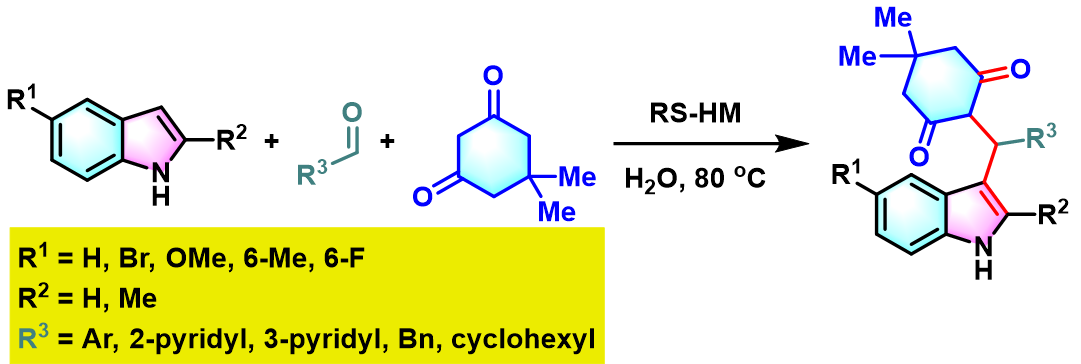
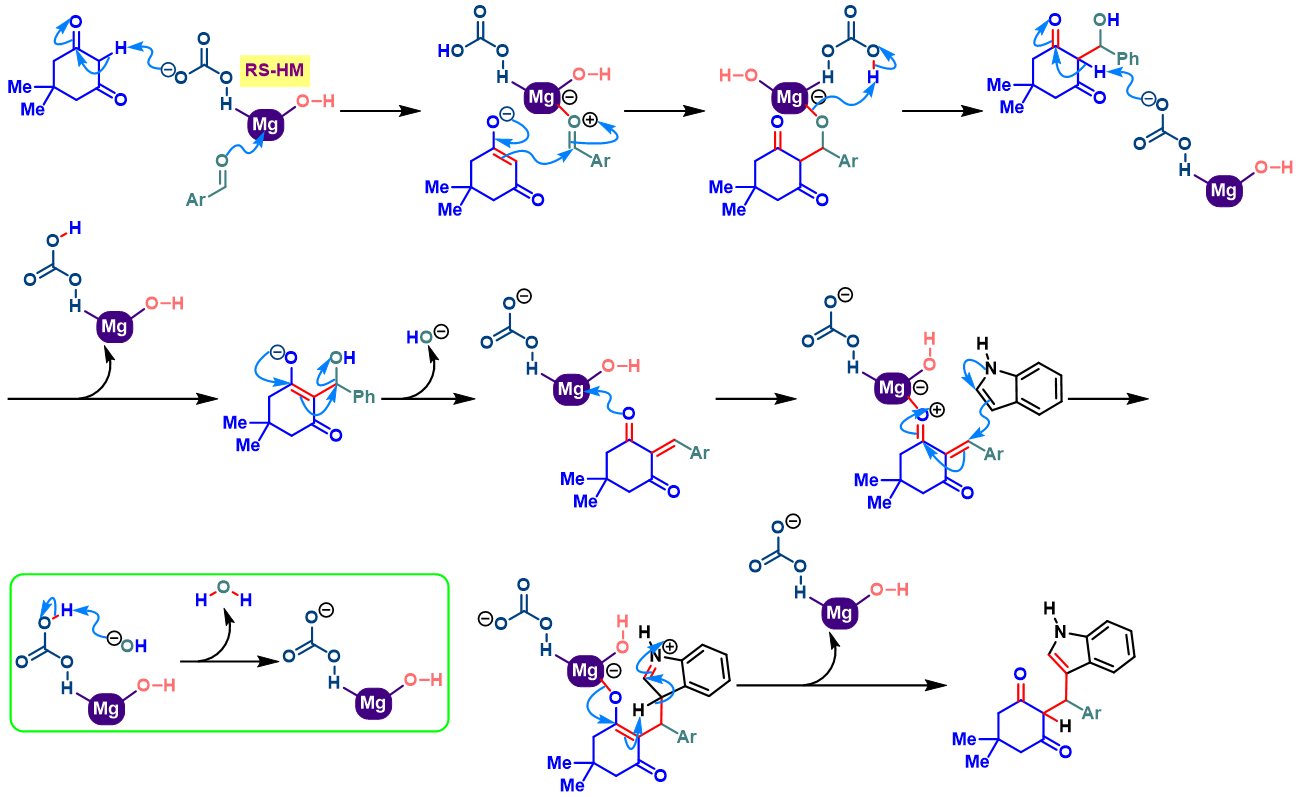
同时,D. S. Rawat采用新发展的异相RS-HM (rectangular thin sheet hydromagnesite)催化剂,成功实现了吲哚、醛及dimedone之间的Yonemitsu三组分反应[6]。研究表明,采用该催化剂参与的缩合过程具有优良的产率与原子经济性,反应完成后,处理更加简便易行,环境更为友好。
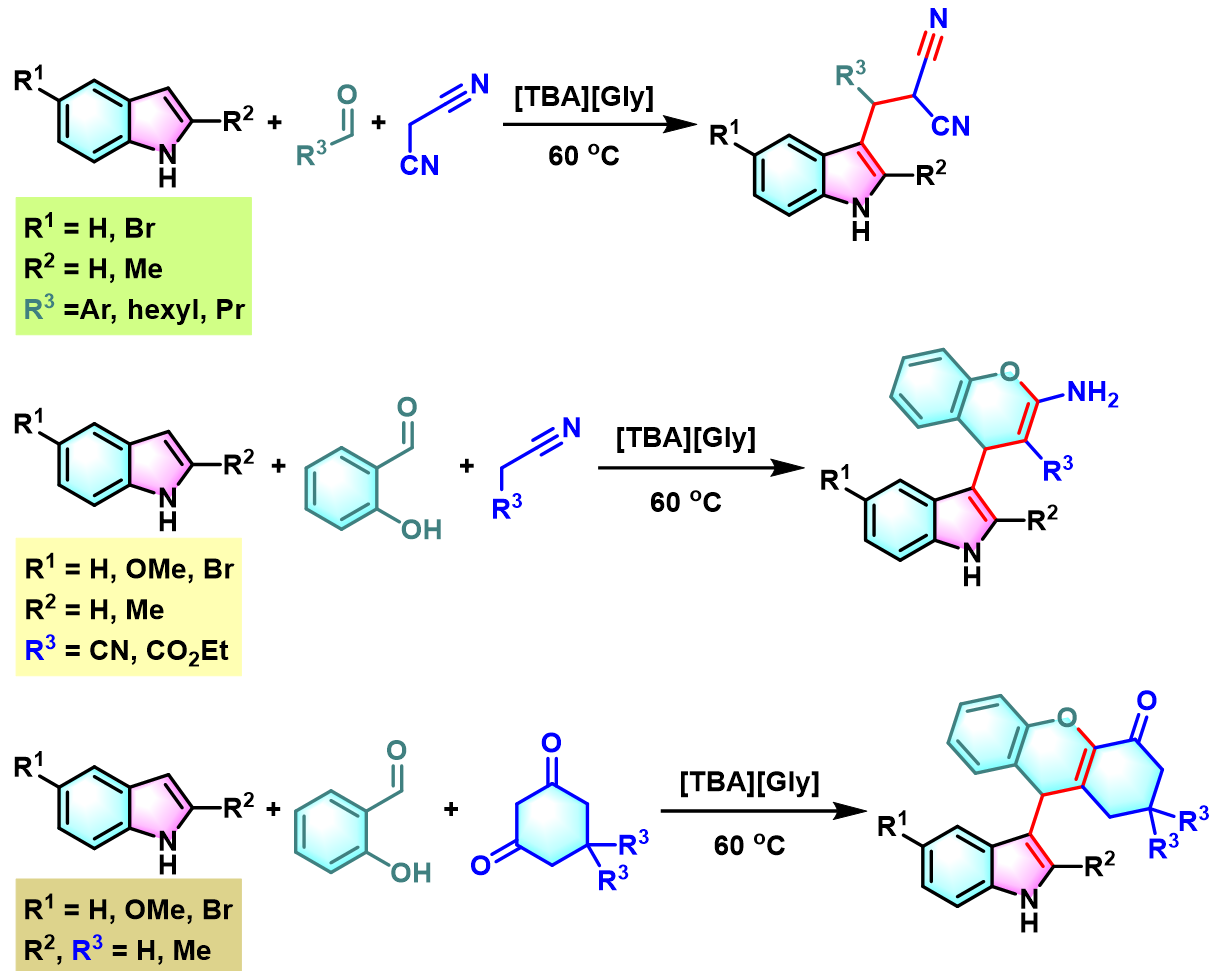
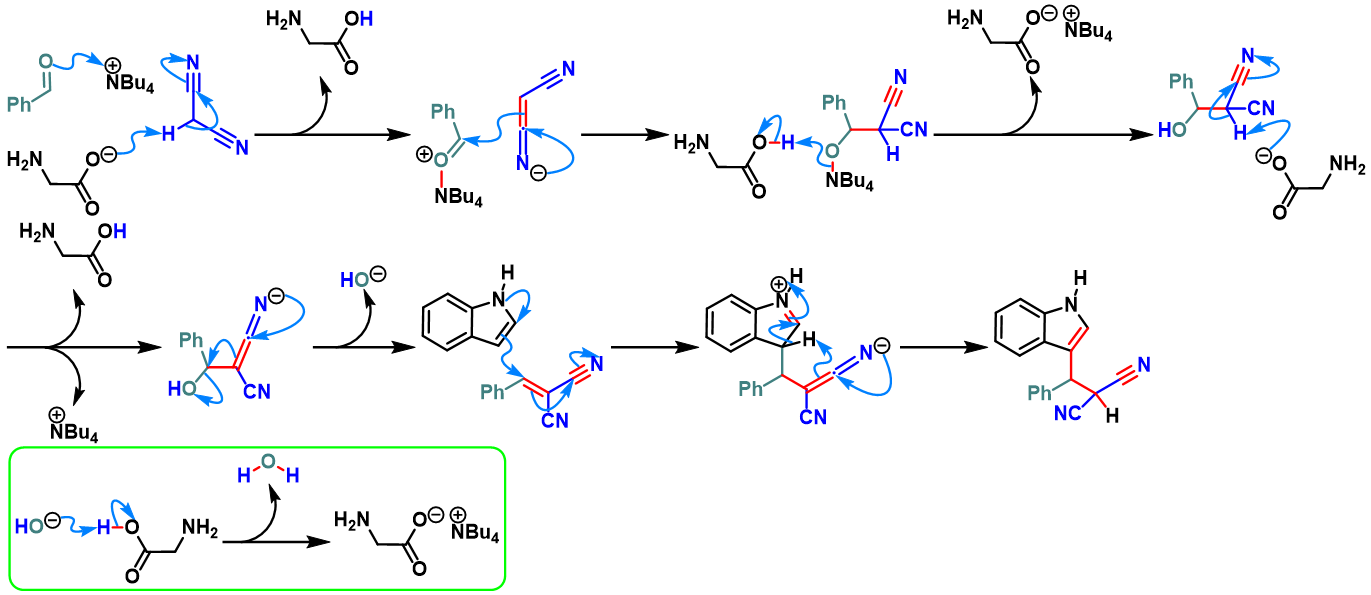
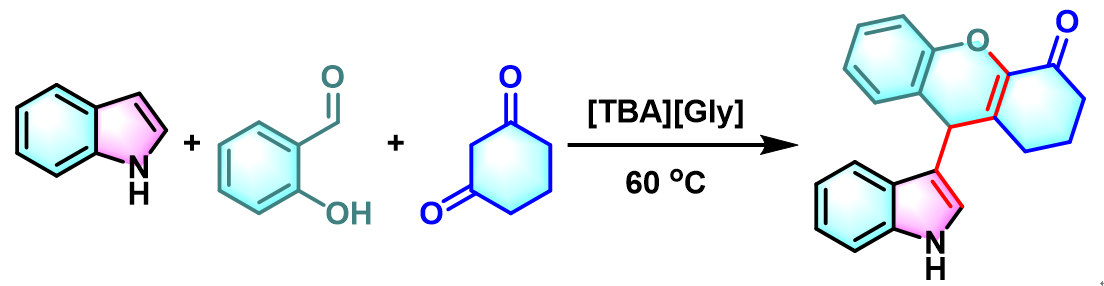
之后,D. S. Rawat开发出能够有效循环利用且可以生物降解的离子液体有机催化剂[TBA][Gly] (tetrabutylammonium glycinate),顺利完成吲哚与芳香醛或脂肪醛及丙二腈之间的无溶剂Yonemitsu三组分缩合[8]。
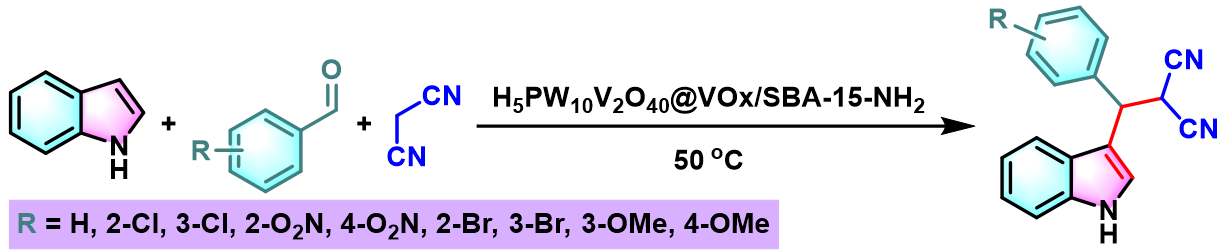
2017年,R. Tayebee研究观察到,采用异相的无机-有机杂化纳米多孔催化剂 (inorganic-organic hybrid nanoporous catalyst),即Keggin结构的杂多酸 (heteropolyacid Keggin structure) H5PW10V2O40@VOx/SBA (Santa Barbara Amorphous, SBA为高稳定性的mesoporous silica sieve)-15-NH2, 同样能够有效地完成取代吲哚与芳香醛及丙二腈之间的无溶剂Yonemitsu三组分缩合[9]。同时,该催化剂能够循环使用,反应条件更加温和且经济友好。
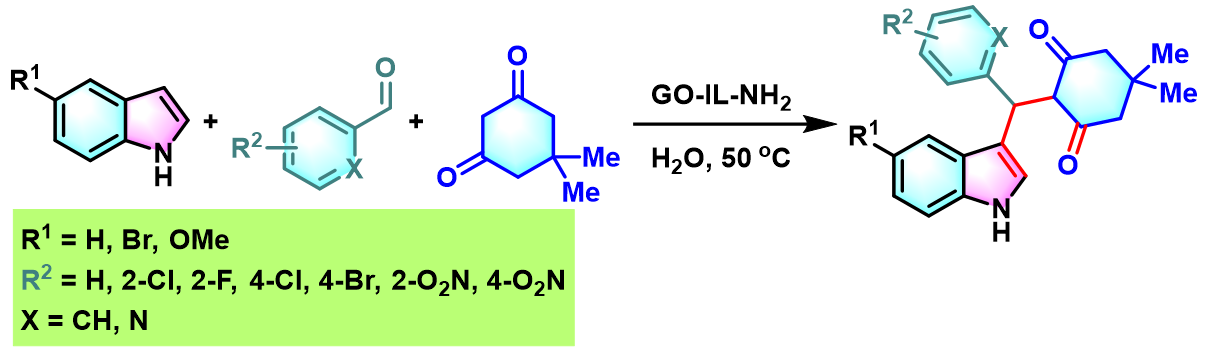
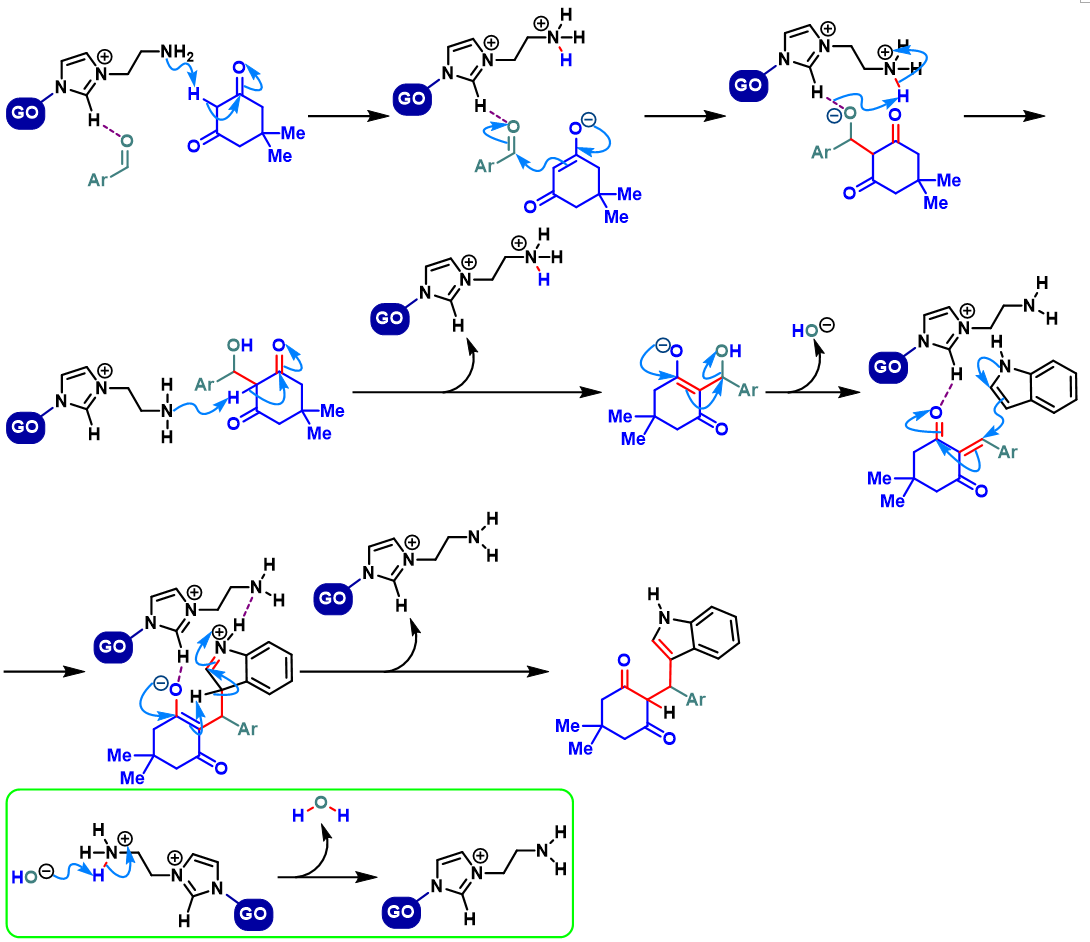
同时,S. Mozumdar将新合成的异相GO (graphene oxide)IL-NH2催化剂成功应用于吲哚与芳香醛或杂环芳香醛及dimedone之间的Yonemitsu三组分缩合[10]。
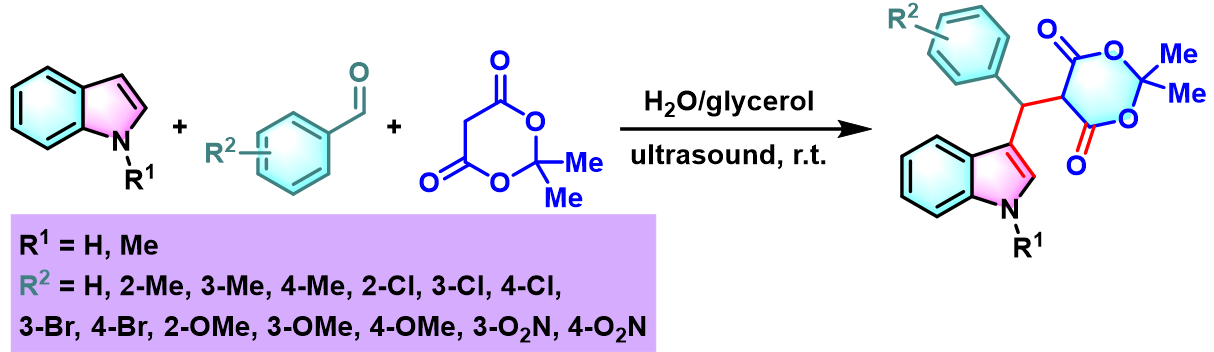
随后,C. Lv发现,采用甘油/水体系,在超声波辐射条件下,同样能够有效地实现吲哚与醛及Meldrum酸之间的Yonemitsu三组分反应。该反应过程中无需使用催化剂,更加简便实用。同时,具有良好的底物应用范围及中等至优良的反应收率[11]。
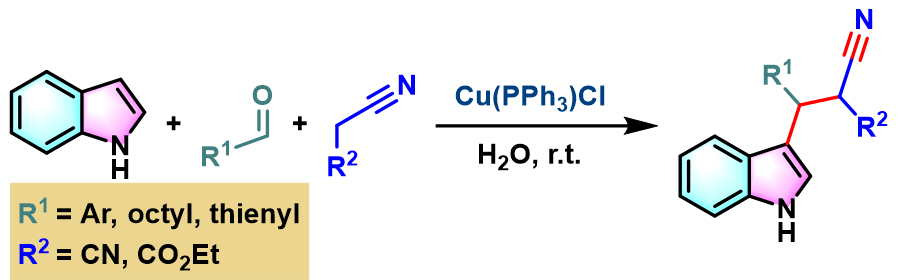
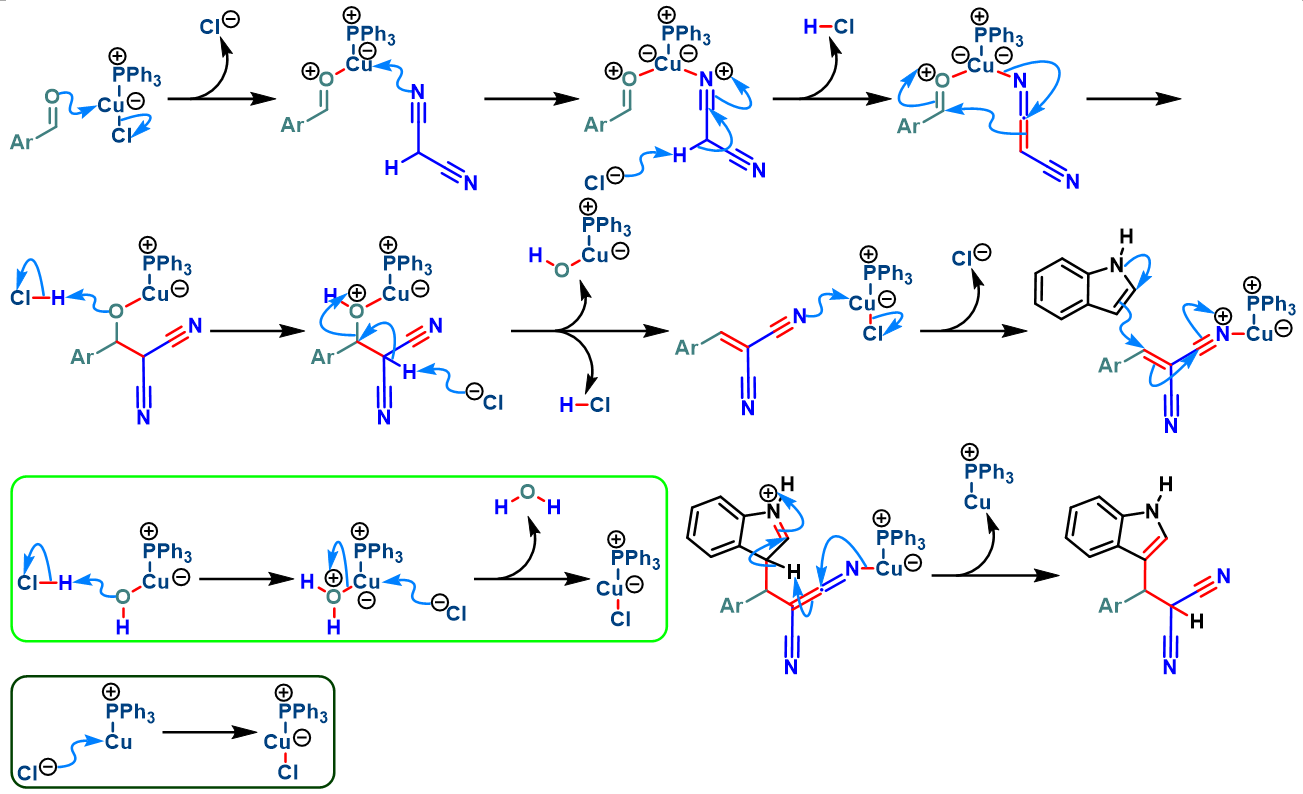
2018年,A. Beatriz进一步发现,通过新发展的Cu (I)催化剂,能够更为快速地在水相环境中完成芳香醛与吲哚及活泼亚甲基化合物之间的Yonemitsu三组分缩合[12]。
同时,E. Sabzi合成出新的具有tiny mesh-like结构的β-CD.NS (β-cyclodextrin-based nanosponges) 多孔三维纳米催化剂 (porous three-dimensional nanocatalyst),并顺利完成吲哚与芳香醛及各类活泼亚甲基化合物之间的Yonemitsu三组分缩合[13]。
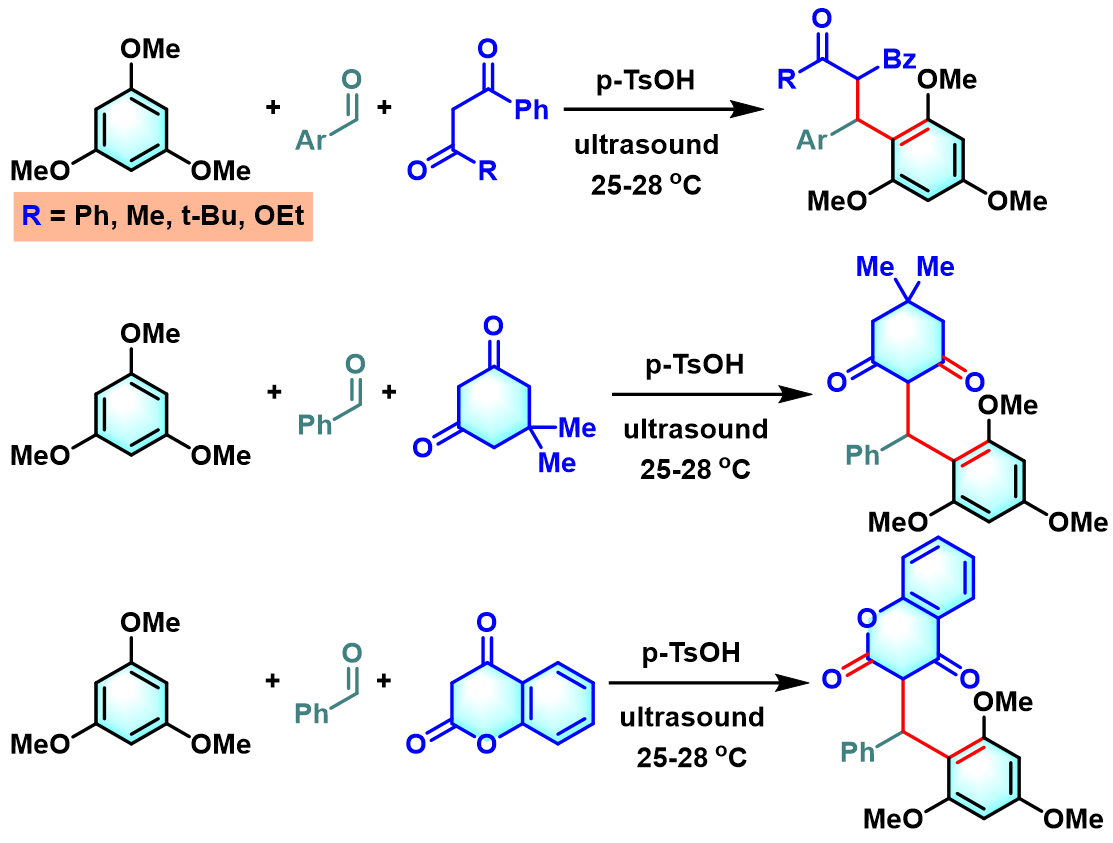
2019年,P. N. Chatterjee通过超声辐射及对甲苯磺酸存在的条件下,进一步将底物范围扩展至其它富电子芳香化合物[14]。
基本文献
- [1] Y. Oikawa, H. Hirasawa, O. Yonemitsu, Tetrahedron Lett. 1978, 20, 1759. doi: 10.1016/0040-4039(78)80037-9.
- [2] A. Viola, L. Ferrazzano, G. Martelli, S. Ancona, L. Gentilucci, A. Tolomelli, Tetrahedron 2014, 70, 6781.doi: 10.1016/j.tet.2014.07.062.
- [3] A. Renzetti, E. Boffa, M. Colazzo, S. Gérard, J. Sapi, T. Chan, H. Nakazawa, C. Villani, A. Fontana, RSC Adv. 2014, 4, 47992. doi: 10.1039/c4ra08853k.
- [4] M. Li, A. Taheri, M. Liu, S. Sun, Y. Gu, Adv. Synth. Catal. 2014, 356, 537. doi: 10.1002/adsc.201300790.
- [5] Y. He, J. Cao, R. Li, Y. Xiang, D. Yang, Z. Guan, Tetrahedron 2015, 71, 9299. doi: 10.1016/j.tet.2015.10.027.
- [6] U. C. Rajesh, J. Wang, S. Prescott, T. Tsuzuki, D. S. Rawat, ACS Sustain. Chem. Engin. 2015, 3, 9. doi: 10.1021/sc500594w.
- [7] U. C. Rajesh, V. S. Pavan, D. S. Rawat, ACS Sustain. Chem. Engin. 2015, 3, 1536. doi: 10.1021/acssuschemeng.5b00236.
- [8] U. C. Rajesh, R. Kholiya, A. Thakur, D. S. Rawat, Tetrahedron Lett. 2015, 56, 1790. doi: 10.1016/j.tetlet.2015.02.058.
- [9] N. M. Ghohe, R. Tayebee, M. M. Amini, A. Osatiashtiani, M. A. Isaacs, A. F. Lee, Tetrahedron 2017, 73, 5862. doi: 10.1016/j.tet.2017.08.030.
- [10] C. Garkoti, J. Shabir, P. Gupta, M. Sharma, S. Mozumdar, New J. Chem. 2017, 41, 15545. doi: 10.1039/C7NJ03450D.
- [11] C. Lv, J. Wang, Y. Liu, W. Shan, Q. Sun, L. Shi, Res. Chem. Intermed. 2017, 43, 943. doi: 10.1007/s11164-016-2675-8.
- [12] A. N. Prasad, F. C. Braga, R. da S. Lopes, G. A. Casagrande, D. P. de Lima, A. Beatriz, Synth. Commun. 2018, 48, 104. doi: 10.1080/00397911.2017.1394467.
- [13] E. Sabzi, A. R. Kiasat, Cat. Lett. 2018, 148, 2654. doi: 10.1007/s10562-018-2484-3.
- [14] D. Paul, A. Borah, S. Khatua, P. N. Chatterjee. Asian J. Org. Chem. 2019, 8, 1870. doi: 10.1002/ajoc.201900352.
反应机理
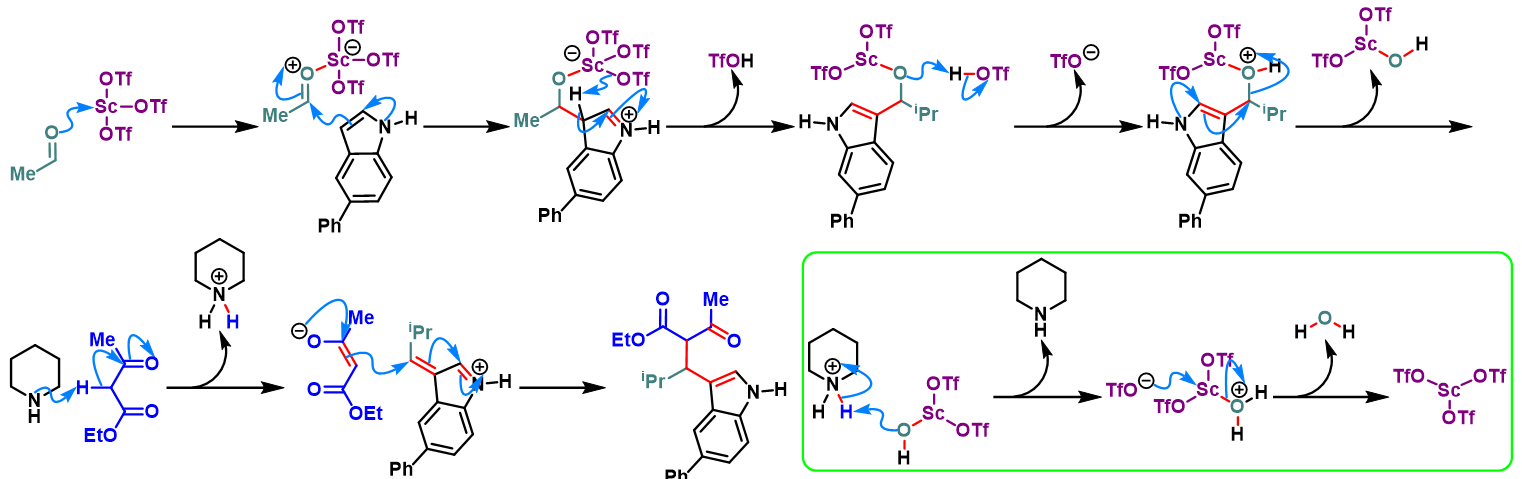
三氟甲磺酸钪促进的Yonemitsu三组分缩合[1]
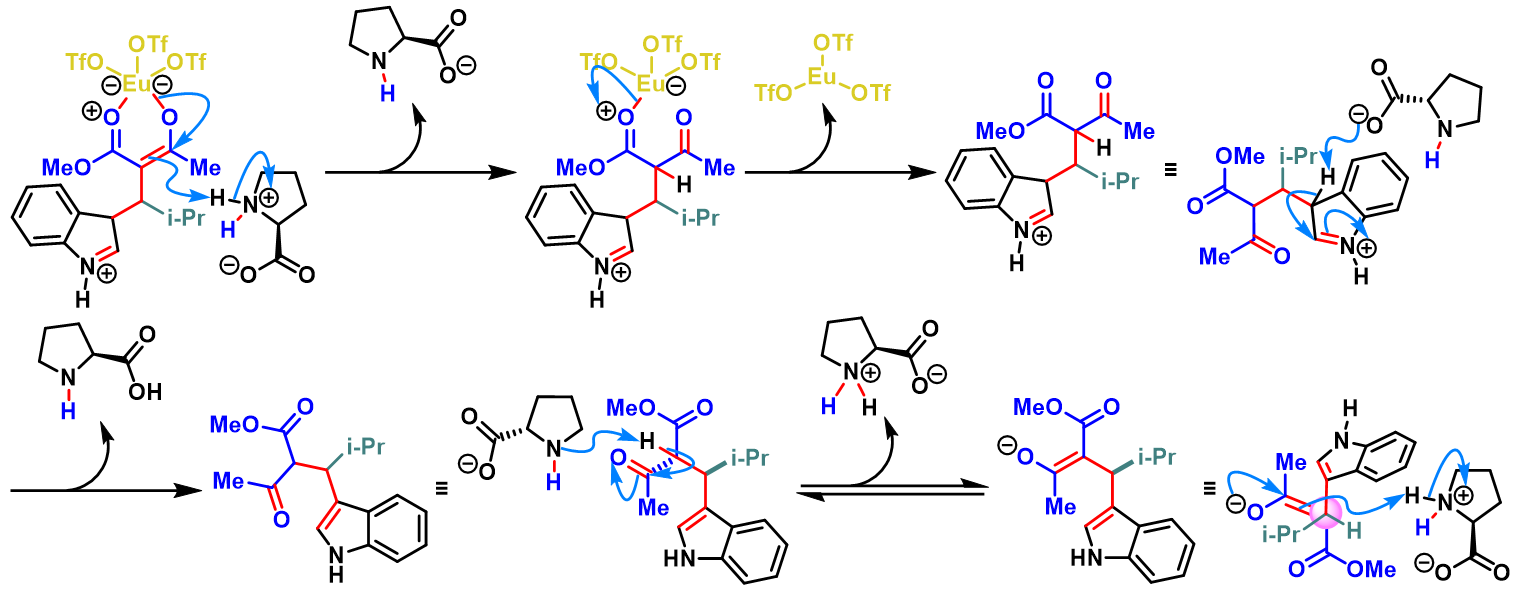
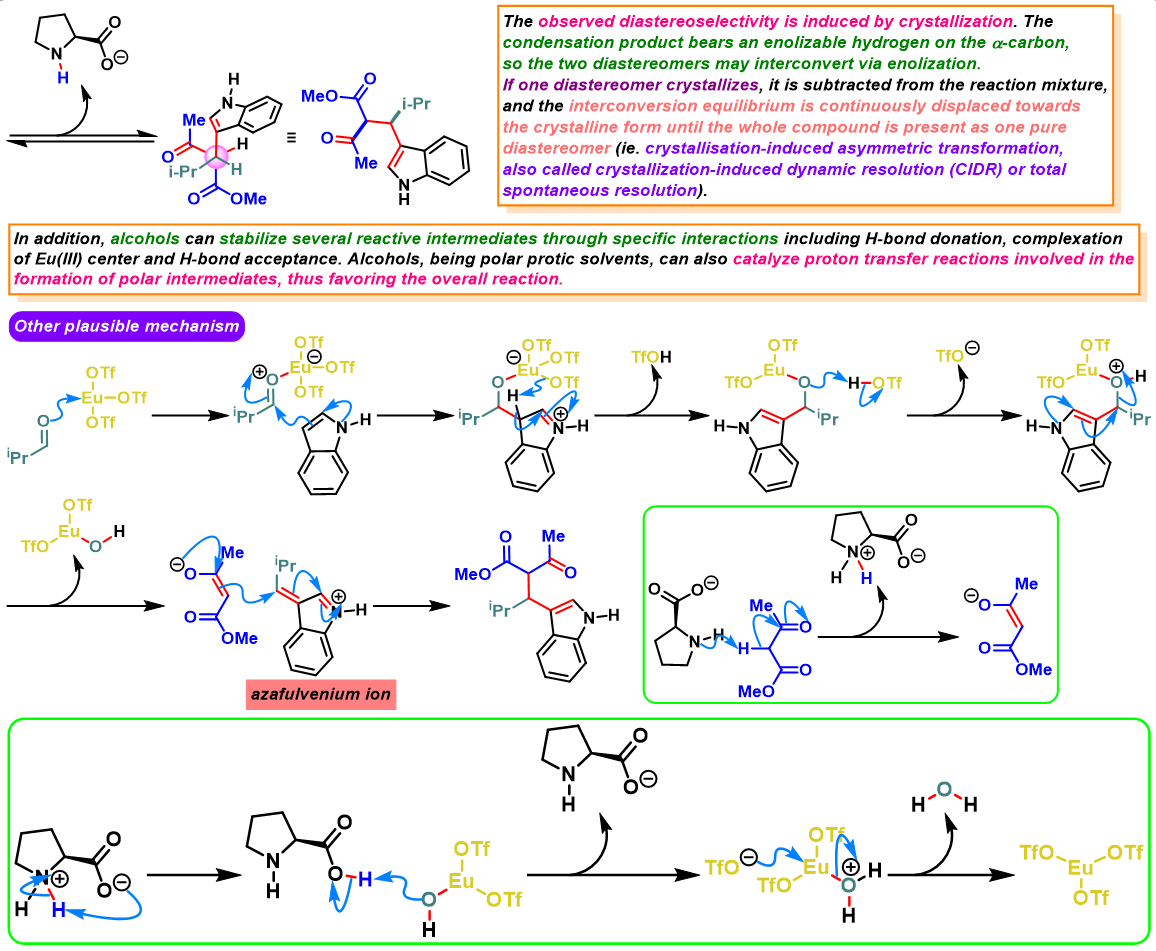
三氟甲磺酸铕催化的Yonemitsu三组分缩合[2]-[5]
RGO/ZnO纳米粒子催化的Yonemitsu三组分缩合[6]
RS-HM催化的Yonemitsu三组分缩合[7]
H5PW10V2O40@VOx/SBA-15-NH2催化的Yonemitsu三组分缩合[8]
[TBA][Gly]催化的Yonemitsu三组分缩合[9]
GO-IL-NH2异相催化的Yonemitsu三组分缩合[10]
Cu (PPh3)Cl催化的Yonemitsu三组分缩合[11]
参考文献
- [1] D. A. Evans, K. R. Fandrick, H. Song, K. A. Scheidt, R. Xu, J. Am. Chem. Soc. 2007, 129, 10029. doi: 10.1021/ja072976i.
- [2] A. Renzetti, E. Boffa, M. Colazzo, S. Gérard, J. Sapi, T. Chan, H. Nakazawa, C. Villani, A. Fontana, RSC Adv. 2014, 4, 47992. doi: 10.1039/c4ra08853k.
- [3] S. Caddick, K. Jenkins, Chem. Soc. Rev. 1996, 447. doi: 10.1039/CS9962500447.
- [4] N. K. Dutt, S. Sur, S. Rahut, J. Inorg. Nucl. Chem. 1971, 33, 1717. doi: 10.1016/0022-1902(71)80608-5.
- [5] G. F. Smith, Adv. Heterocycl. Chem., 1963, 18, 287. doi: 10.1016/S0065-2725(08)60752-7.
- [6] U. C. Rajesh, V. S. Pavan, D. S. Rawat, ACS Sustain. Chem. Engin. 2015, 3, 1536. doi: 10.1021/acssuschemeng.5b00236.
- [7] U. C. Rajesh, V. S. Pavan, D. S. Rawat, ACS Sustain. Chem. Engin. 2015, 3, 1536. doi: 10.1021/acssuschemeng.5b00236.
- [8] N. M. Ghohe, R. Tayebee, M. M. Amini, A. Osatiashtiani, M. A. Isaacs, A. F. Lee, Tetrahedron 2017, 73, 5862. doi: 10.1016/j.tet.2017.08.030.
- [9] U. C. Rajesh, R. Kholiya, A. Thakur, D. S. Rawat, Tetrahedron Lett. 2015, 56, 1790. doi: 10.1016/j.tetlet.2015.02.058.
- [10] C. Garkoti, J. Shabir, P. Gupta, M. Sharma, S. Mozumdar, New J. Chem. 2017, 41, 15545. doi: 10.1039/C7NJ03450D.
- [11] A. N. Prasad, F. C. Braga, R. da S. Lopes, G. A. Casagrande, D. P. de Lima, A. Beatriz, Synth. Commun. 2018, 48, 104. doi: 10.1080/00397911.2017.1394467.
反应实例
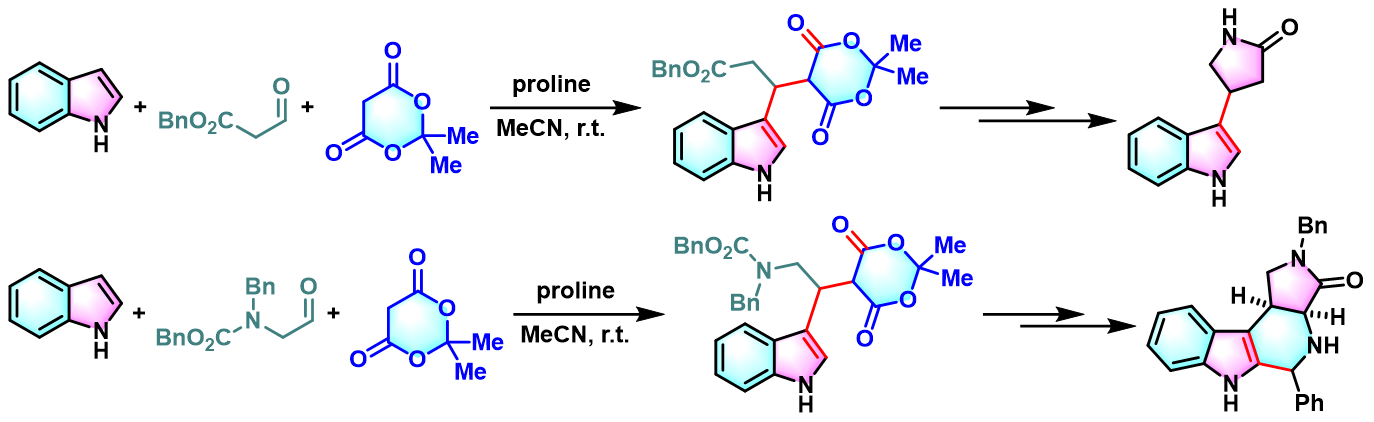
吲哚基取代-2-吡咯烷酮及其环状衍生物的合成[1]
3-取代吲哚的合成[2]
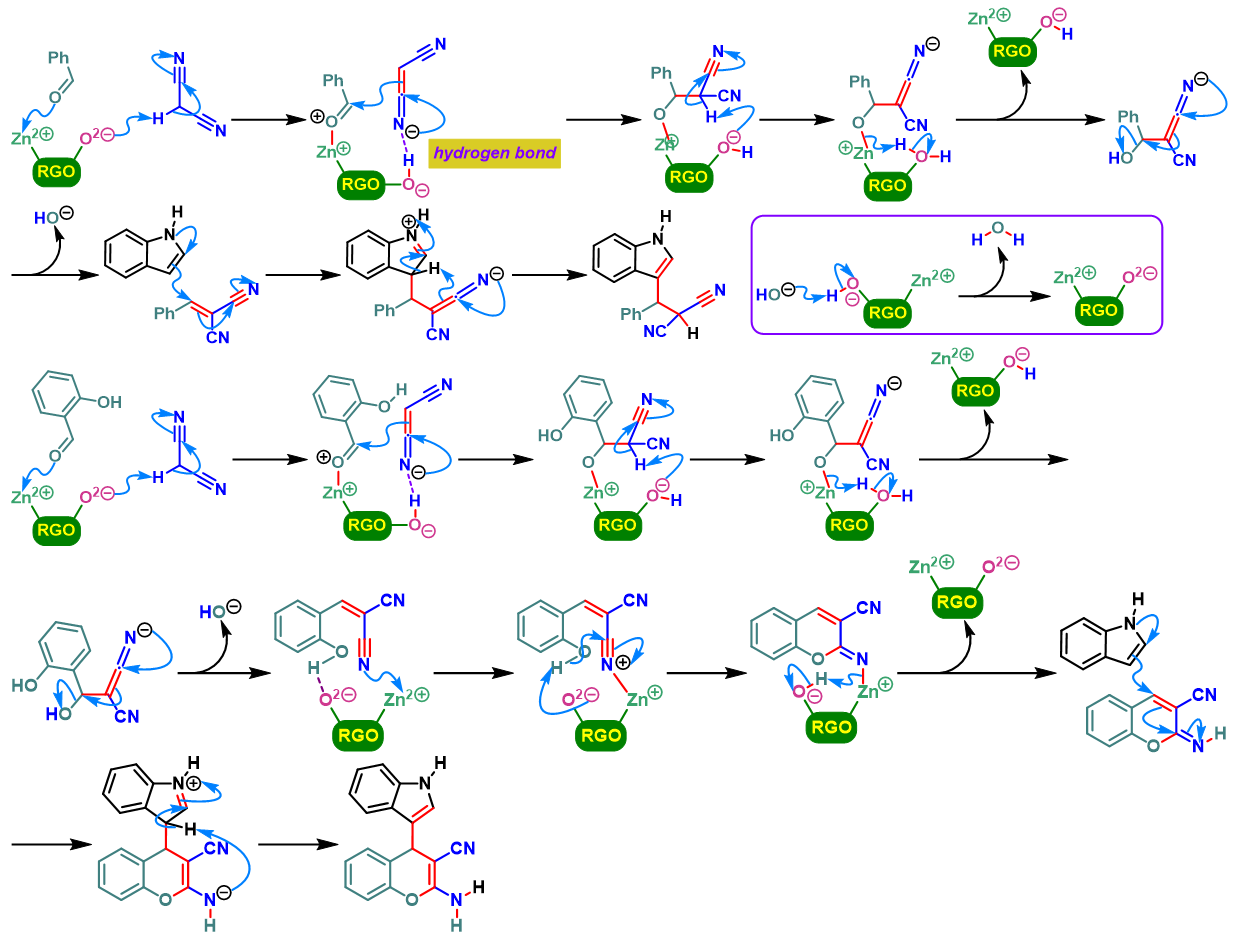
吲哚基4H-色烯的合成[3]
实验步骤
三氟甲磺酸钪促进的Yonemitsu三组分缩合
在微波反应瓶中,将丙二酸二甲酯 (1eq.)或乙酰乙酸乙酯 (1eq.)、醛 (1eq.)与哌啶 (0.15 equiv)进行混合。之后,将上述反应混合物在250W微波辐射功率下,搅拌7 min。7min后,将上述混合物冷却至室温,并加入适量乙腈进行稀释。随后,加入吲哚(1eq.)与三氟甲磺酸钪 (0.1eq.)。 继续维持在250W微波辐射功率下,将上述反应混合物搅拌20 min。 随后,再将反应混合物冷却至室温,并加入水进行稀释,随后,加入乙酸乙酯进行萃取。将合并的有机相通过无水硫酸钠干燥后,减压除去溶剂。粗产物通过硅胶柱色谱 (环己烷/乙酸乙酯 9:1v/v作为洗脱剂)分离纯化,获得相应缩合产物。
三氟甲磺酸铕催化的Yonemitsu三组分缩合
在室温及4 Å分子筛存在下,将L-脯氨酸 (0.1 eq)溶于适量醇溶剂中。随后。加入活泼亚甲基化合物 (1 eq.)与异丙醛 (1 eq.)。将上述混合物在室温下搅拌24h后,再加入吲哚 (1 eq.)与三氟甲磺酸铕 (0.1eq.)。继续将上述反应混合物进行搅拌,直至反应结束。反应结束后,将反应混合物通过硅藻土过滤,除去分子筛。再将合并的滤液进行减压浓缩后,获得粗产物。最后,将粗产物通过快速硅胶柱色谱或通过重结晶进行分离纯化,获得相应缩合产物。
RGO/ZnO纳米粒子催化的Yonemitsu三组分缩合
向圆底烧瓶中加入吲哚 (1eq.)、活泼亚甲基化合物 (1eq.)、醛 (1eq.)与RGO/ZnO催化剂 (0.05eq.)及适量水。之后,将上述反应混合物在适宜温度下 (室温或50 oC)进行搅拌,并通过TLC监控,直至反应结束。反应结束后,将水倒出,再加入适量乙醇。并通过离心分离,除去RS-HM/MgO催化剂。再将合并的上层乙醇相通过无水硫酸钠进行后,减压除去溶剂。粗产物通过重结晶 (乙醚或正己烷/乙酸乙酯作为溶剂)分离纯化,获得相应缩合产物。
RS-HM催化的Yonemitsu三组分缩合
向反应烧瓶中加入吲哚 (1eq.)、dimedone (1eq.)、醛 (1eq.)与RS-HM催化剂 (0.01eq.)及适量水。之后,将上述反应混合物在80 °C下进行搅拌,并通过TLC监控,直至反应结束。反应结束后,将水倒出,再加入适量乙醇。并通过离心分离,除去RS-HM催化剂。再将合并的上层乙醇相通过无水硫酸镁干燥后,减压除去溶剂。粗产物通过重结晶 (乙醇作为溶剂)分离纯化,获得相应缩合产物。
H5PW10V2O40@VOx/SBA-15-NH2催化的Yonemitsu三组分缩合
将H5PW10V2O40@VOx/SBA-15-NH2 (0.1eq.) 加入至醛 (1eq.)与吲哚 (1eq.)及丙二腈 (1.1 eq.)的混合物中。将上述混合物在80 °C下进行搅拌。并通过TLC (正己烷/乙酸乙酯 3:2v/v作为展开剂)监控,直至反应结束。反应结束后,向反应混合物中加入适量热乙醇溶剂,继续搅拌10 min。并迅速过滤,除去H5PW10V2O40@VOx/SBA-15-NH2催化剂。之后,将滤液冷却至5 °C,再将析出的固体通过正己烷进行过滤洗涤,获得相应缩合产物。
GO-IL-NH2异相催化的Yonemitsu三组分缩合
向圆底烧瓶中加入吲哚 (1eq.)、dimedone (1eq.)、醛 (1eq.)与GO-IL-NH2催化剂 (0.01eq.)及适量水。将上述反应混合物在50 oC下进行搅拌,并通过TLC监控,直至反应结束。反应结束后,将水倒出,再加入适量乙醇。并通过离心分离,除去GO-IL-NH2催化剂。将合并的上层乙醇相通过无水硫酸钠干燥后,减压除去溶剂。粗产物通过重结晶分离纯化,获得相应缩合产物。
Cu (PPh3)Cl催化的Yonemitsu三组分缩合
向反应烧瓶中加入吲哚 (1eq.)、活泼亚甲基化合物 (1eq.)、醛 (1eq.)与Cu(PPh3)Cl催化剂 (0.1eq.)及适量水。将上述反应混合物在室温下进行搅拌,并通过TLC监控,直至反应结束。反应结束后,加入乙酸乙酯进行萃取。将合并的有机相采用无水硫酸钠干燥后,减压除去溶剂。粗产物通过硅胶柱色谱 (正己烷/乙酸乙酯 9:1 v/v作为洗脱剂)分离纯化,获得相应缩合产物。
参考文献
- [1] M. Boisbrun, L. Jeannin, L. Toupet, J.-Y. Laronze, Eur. J. Org. Chem. 2000, 3051. doi: 10.1002/1099-0690(200009)2000:17<3051::aid-ejoc3051>3.0.co;2-3.
- [2] A. Renzetti, E. Boffa, M. Colazzo, S. Gérard, J. Sapi, T. Chan, H. Nakazawa, C. Villani, A. Fontana, RSC Adv. 2014, 4, 47992. doi: 10.1039/c4ra08853k.
- [3] U. C. Rajesh, R. Kholiya, A. Thakur, D. S. Rawat, Tetrahedron Lett. 2015, 56, 1790. doi: 10.1016/j.tetlet.2015.02.058.
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!






















No comments yet.