概要
Sasaki [4+3]环加成 (Sasaki [4+3] cycloaddition)是通过Lewis酸 (如SnCl4[1], Sc(OTf)3[2], EtAlCl2[3])催化条件下,进行的α-硅氧基丙烯醛 (captodative烯烃)与共轭二烯之间的[4+3] 环加成反应[1]-[3]。该反应由日本Nagoya大学应用有机化学研究所 (名古屋大学工学部応用有機化学科, Institute of Applied Organic Chemistry, Faculty of Engineering, Nagoya University)的Sasaki (佐佐木 正, Sasaki Tadashi)研究室在1982年首次报道[1]。Sasaki [4+3]环加成反应条件温和,具有良好的区域及立体选择性[1]-[4]。目前,该方法学已经开始应用于部分生理活性天然产物全合成过程中关键砌块的构建[5]。
基本文献
- [1] T. Sasaki, Y. Ishibashi, M. Ohno, Tetrahedron Lett. 1982, 23, 1693. doi: 10.1016/S0040-4039(00)87192-0.
- [2] M. Harmata, U. Sharma, Org. Lett. 2000, 2, 2703. doi: 10.1021/ol006281x.
- [3] R. A. Aungst, R. L. Funk, Org. Lett. 2001, 3, 3553. doi: 10.1021/ol016668f.
- [4] M. Harmata, Chem. Commun. 2010, 46, 8904. doi: 10.1039/C0CC03621H.
- [5] M. G. Nilson, R. L. Funk, J. Am. Chem. Soc. 2011, 133, 12451. doi: 10.1021/ja206138d.
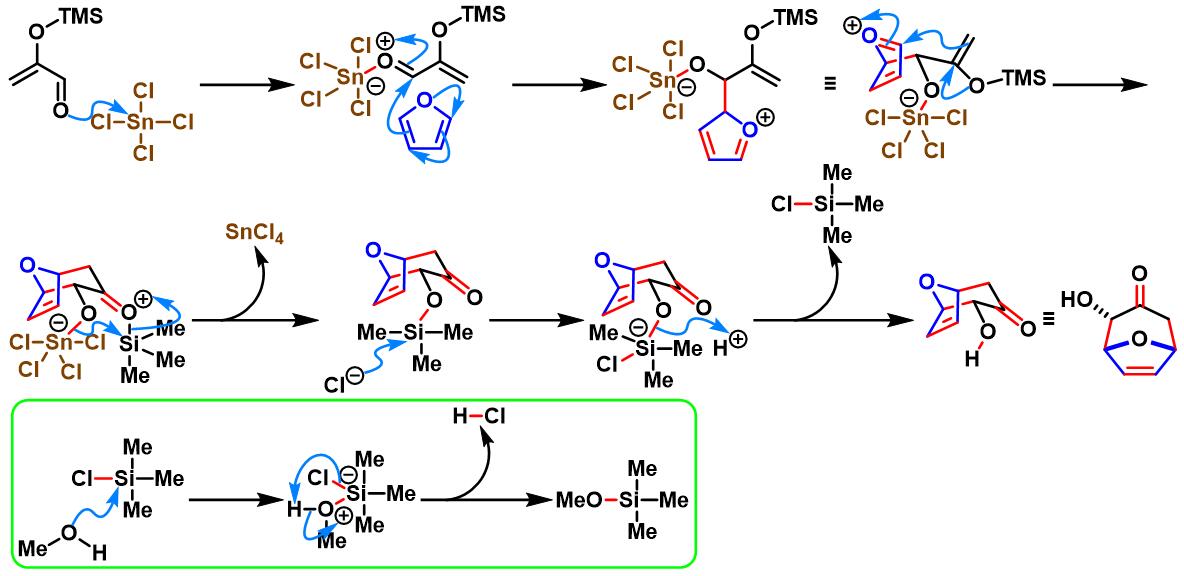
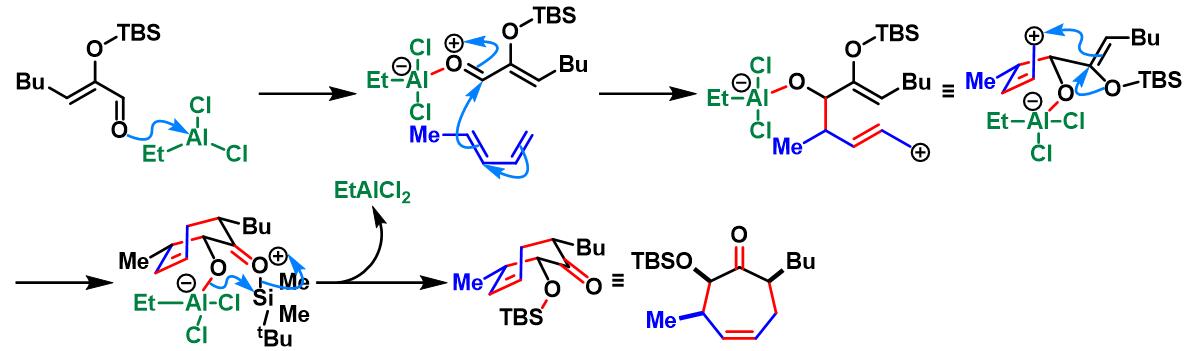
反应机理
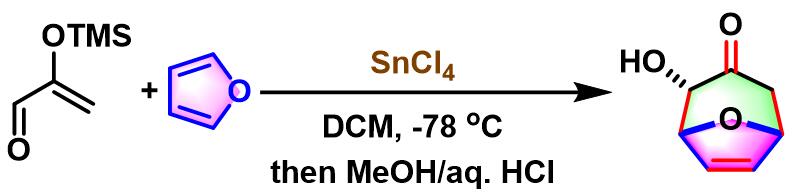
SnCl4催化的Sasaki [4+3]环加成
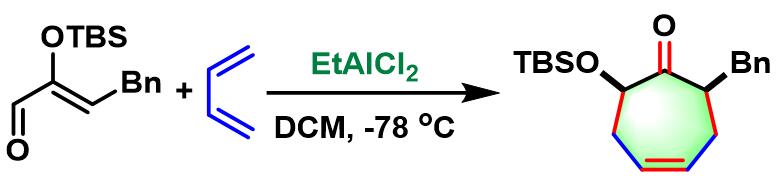
EtAlCl2催化的Sasaki [4+3]环加成
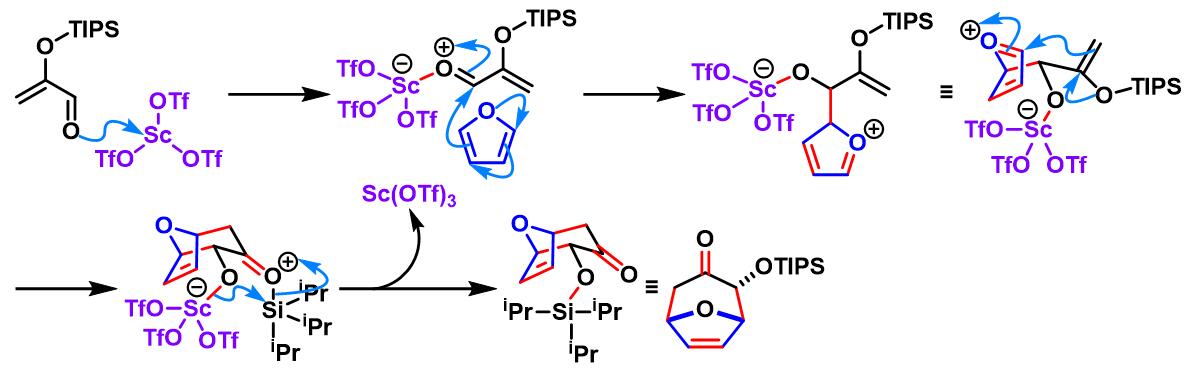
Sc(OTf)3催化的Sasaki [4+3]环加成
参考文献
- [1] J. A. Sáez, M. Arnó, L. R. Domingo, Org. Lett. 2003, 5, 4117. doi: 10.1021/ol035652h.
- [2] J. M. Burns, Org. Biomol. Chem. 2018,16, 1828. doi: 10.1039/C8OB00075A.
- [3] A. Saez, M. Arno, L. R. Domingo, Tetrahedron 2005, 61, 7538. doi: 10.1016/j.tet.2005.05.067.
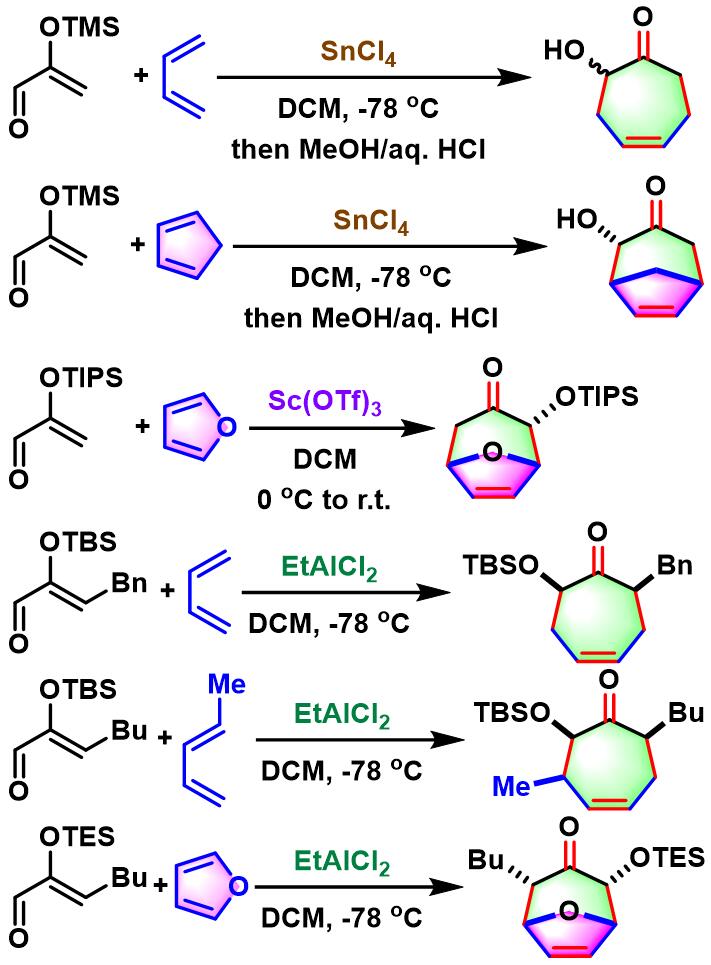
反应实例
SnCl4催化的Sasaki[4+3]环加成[1]
EtAlCl2催化的Sasaki[4+3]环加成[2]
rac-cortistatin J的全合成[3]
实验步骤
在-78 oC下,向α-硅氧基丙烯醛 (1 eq.)与共轭二烯 (1.5 eq.)的无水DCM溶液 (维持α-硅氧基丙烯醛浓度为0.33 M)中加入Lewis酸催化剂 (1 eq.)的无水DCM溶液 (维持催化剂浓度为1 M)。将上述反应混合物在-78 oC下继续搅拌,直至反应结束。反应结束后,将反应混合物进行减压浓缩。浓缩后,加入适量MeOH及1 M HCl搅拌30 min。30 min后,再将上述混合物倒入加有碳酸氢钠的冰水中进行中和。随后,再加入乙醚进行萃取。将合并的有机相通过无水硫酸钠干燥后,减压除去溶剂。粗产物通过硅胶柱色谱 (三氯甲烷作为洗脱剂)分离纯化,获得最终目标产物。
参考文献
- [1] T. Sasaki, Y. Ishibashi, M. Ohno, Tetrahedron Lett. 1982, 23, 1693. doi: 10.1016/S0040-4039(00)87192-0.
- [2] R. A. Aungst, R. L. Funk, Org. Lett. 2001, 3, 3553. doi: 10.1021/ol016668f.
- [3] M. G. Nilson, R. L. Funk, J. Am. Chem. Soc. 2011, 133, 12451. doi: 10.1021/ja206138d.
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!

















No comments yet.