译自Chem-Station网站日本版 原文链接:誤解してない? 電子の軌道は”軌道”ではない
翻译:炸鸡 校对:Jiao Jiao
前情回顾
在《轨道非轨道——原子“轨道”的真面目<上>》中,我详细解释了量子世界与宏观世界的不同,主要体现在两点上:量子世界里粒子的位置无法确定以及各个物理量无法被准确算出并带有误差。我们推导出了单个电子在受到库仑力下的Schrödinger方程(薛定谔方程)(下图)
图1. 单个电子在受到库仑力下的Schrödinger方程
轨道图
铺垫到此结束。让我们正式进入正题!对上图的Schrödinger方程进行求解,Schrödinger方程的解就是波函数,即描述电子方位的函数。
图2. 原子轨道图像
上面就是我们熟悉的轨道了,虽然轨道的表示形式五花八门,但最能反映本质和最易懂的就是图2那样的吧。轨道图公式化后的式子如下
(5)
根据Born近似,电子在某处的波函数的平方是电子在这一处的出现概率的概率密度。请注意是电子出现概率的概率密度,概率是建立多次试验上才成立的。于是产生来了一个问题——只看一个电子的话该怎么考虑概率呢?
这个问题的答案几乎没有教科书上详细记载过。我写这篇文章的目的之一也是为了回答这个一直被忽视的疑问。
轨道图像是统计概念
为了解决“只看一个电子的话该怎么考虑概率呢”的疑问,需要一点思考想象。接下来让我们做个小实验来定位在库仑力作用下的电子的位置。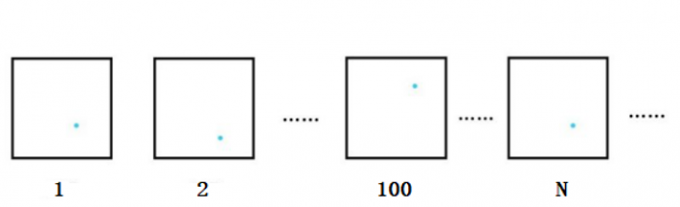
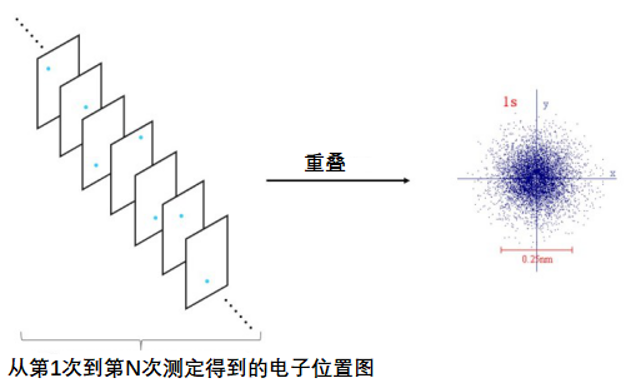
图3. 每次测量中电子出现位置图
图中蓝色的点即电子在每次实验里出现的位置。如前所述,测定得到的电子的位置是存在误差的。
虽然电子位置的模糊很困扰人,但这误差不是人力可以消除的。进行N次这种位置测定实验然后取极限,比如某一位置r=(x0,y0,z0)上电子总共出现的概率P(r)为
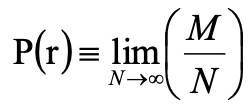 (6)
(6)
我们把这样得到的概率分布做成一张张图。图3中每张电子位置的图片叠放在一起就汇成了一张图[2]。
图4. 将单张电子出现位置图叠加在一起就显现出“轨道”的样子
重叠得到的“轨道”图和我们从前印象里的轨道大相径庭。
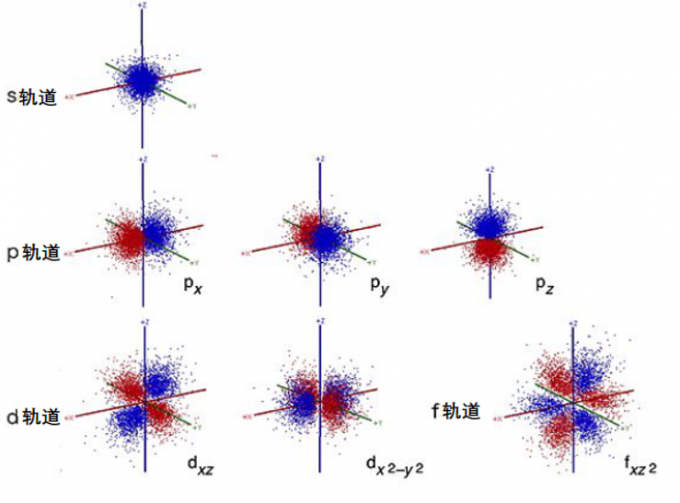
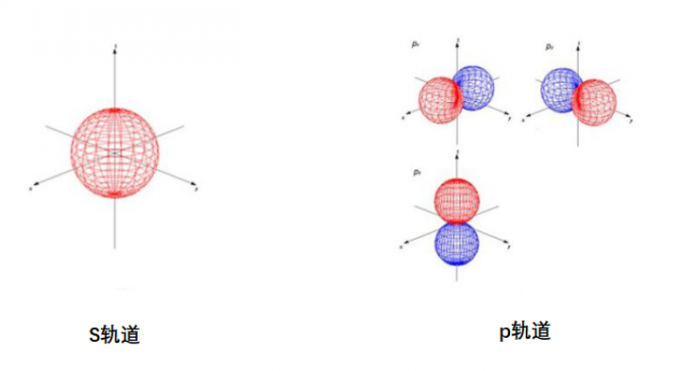
p轨道,d轨道的模拟也同这个s轨道的模拟一样。从这种每次实验的位置图叠加在一起得到轨道形状的手段不难理解原子轨道本质上是统计概念。所以图1中的轨道图是最能反映原子轨道的本质的。
除了图2里的轨道表现形式外,还有下图样式的表现形式,下图这类轨道图也很常见。通常称为轮廓表示法。
图5. 原子轨道的轮廓表示
轮廓划定了电子存在概率在90~95%[3],正如它的名字所表示的那样,轮廓图非常适合看清原子轨道的轮廓,但同时它又无法体现出轨道的统计性本质。也会有人看了图5那样的轨道图就误以为真实的原子轨道就如同图片上那样。图2虽然轨道的轮廓很模糊,但用了小点表示原子轨道,这样是最有助于看者领会原子轨道的统计性本质的。
轨道的本质
现在我们已经知道轨道是统计性概念。那么我们是不是可以说轨道在整个空间里都有广泛的分布呢?当然不可以。
- 多次测定电子的位置得到的电子分布图确实如图2和图5展示的那样
在我开始学习有机化学里的轨道理论的时候,我经常会误认为电子具有波动性这个词的意思是电子会以图5所示的形式在空间中分布的。但事实并非如此,不管在轨道范围的哪里,电子都是一个或两个。惊讶的是就连量子力学的奠基人之一的埃尔温·薛定谔也曾有过同样的误解。他误认为电子像云一样在空间中弥散分布。一些教科书上的用途也很容易让初学者产生这样的误解,这一点我们要特别注意。
那么,我们能把这个轨道图看作是电子运动的轨迹吗? 遗憾的是,也不能。尽管我们不能用肉眼看到电子是怎么运动的,但上一回中的Schrödinger表达式(2)学到了量子态不是连续变化的,如果量子态是连续变化的,那就不存在误差了。这听起来很麻烦,电子在每个瞬间都没有固定的位置。既然电子轨迹是不存在的,就不能把轨迹看作是电子轨迹。
- 电子没有固定的位置所以就不存在测定电子位置一说,如果非要测定电子的位置,也只能精确到在图2所示的范围内的某个点。将这些可以确定电子会出现的区域统一定义为轨道。
到了这里,我想你会明白我们一直以来所说的s轨道、p轨道、d轨道等轨道这个词与传统日常概念有多大的不同。
那么“把电子填充进轨道”这个行为该怎么解释呢?这种说法其实把轨道和电子之间的牵绊给割裂了,因为你如果不多次测定电子位置,你就不知道轨道在哪,这种“把电子填充进轨道”的说法乍一想其实有点奇怪。其实这是化学家想出来的妙招!
- 把经过多次测定的轨道范围默认为原本就存在的东西,然后将电子填充进去,这样做的结果是一样的(库伦场里有电子的前提下)
所以,“轨道是经过多次测量后确定的”这一前文的说法也不是百分之百正确,因为轨道实际上算是预先存在的。这个问题好比是先有鸡还是先有蛋的问题,对电子的位置测定确定了轨道(鸡下蛋),但是电子是存在在轨道上的(鸡蛋孵出小鸡)。读者们见仁见智,从哪个角度理解都可~
先辈化学家们真的足智多谋。如果一定要像物理学那样预先决定好某个体系(就像争鸡和蛋到底哪个现有),那么化学的优点——复杂性就完全无法讨论了。
化学处理多电子系的,而且不管怎么说反应的主角是电子。对于多以电子为媒介的化学来说只能这样做。无机化学等特有的空轨道等也正是因为采取了这个立场才成立的概念。而且,考虑到多电子系统在物理上无法严格处理,可以说化学是聪明的。通过使用预先承认这个轨道的立场和适当的近似,化学现在成为了结合理论,多原子分子,络合物等丰富的学术土壤。
轨道名称的历史背景[4]
今天所讲的原子轨道英文名为atomic orbital。分子轨道英文名为molecular orbital。请擦眼睛,它是orbital,而不是orbit。这一点我先讲一点历史背景。
现在学习的量子力学,是从被称为前期量子论的量子力学的黎明时期,Bohr提出的原子模型经过10多年的时间演变来的。这个Bohr的原子模型是在传统轨道上强行加入当时已知的量子理论的一部分,就像一个早期版本。因为这个时候还在考虑传统的轨道,所以可以用传统的轨道单词orbit这个词来命名。之后轨道的概念与我们的直观相反的波函数画了等号,于是用1s orbit,2s orbital……的函数词1s orbital function,2s orbital function……来代替成为轨道的新名词(orbit是名词,orbital是形容词)。
这个名称实在是太合理了。 因为在经典轨道中,如果量子数n被限制为自然数,则它与轨道半径一一对应。也就是说,由于电子的轨道是确定的,所以可以通过与自然数n的对应来计数。使用orbit这个代表经典轨道的词不是不可以,但是,量子论中的轨道既然是有偏差的,说到底只能以分布的形式来表示,那就只能以函数的形式来表示。因此,除了将其称为orbital function外别无他法。现在function被抽离出来,只剩orbital这个形容词被用来称为轨道。
但是,如此不同的概念却被同样被翻译成了轨道,有点带有误导性了。笔者个人觉得在翻译上应该体区分一下“轨道”和“轨道函数”比较好 。
~完~
参考文献
[1]清水明, 第1章 古典物理学の破綻 第2章 基本的枠組み「新版 量子論の基礎」サイエンス社, 2018年, pp10-14, 19-21. [2]原島鮮 第14章 水素類似原子 「初等量子力学(改訂版)」裳華房, 2018年. [3]JOHN McMURRY, 第1章 原子の構造:軌道 ORGANIC CEMISTRY Ninth Edition 東京化学同人, 2017年, pp4-5. [4]藤永茂 第3章 1中心1電子系 「入門分子軌道法 分子計算を手がける前に」講談社, 2008年, pp43-45本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载



















No comments yet.