本文作者:杉杉
导读
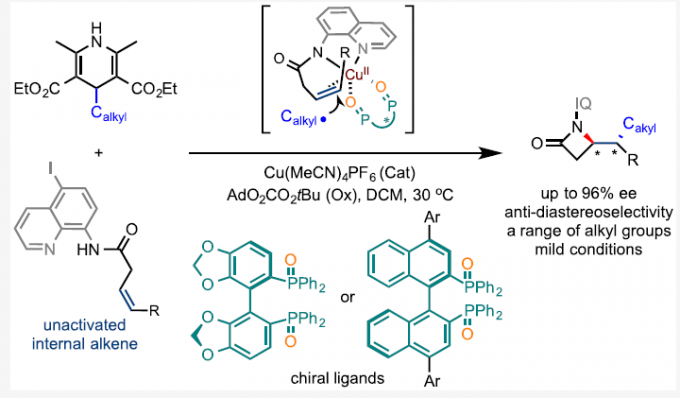
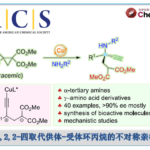
近日,南开大学陈弓和何刚团队在J. Am. Chem. Soc.发表论文,报道了一种Cu催化体系,可实现各种烷基自由基与未活化的内烯烃对映选择性加成反应,获得良好收率和优异对映选择性的具有两个连续立体中心的β-内酰胺衍生物。在该反应中,以氨基喹啉为导向基团,4-烷基汉斯酯为烷基供体,联芳基二膦氧化物作为手性配体。机理研究表明,烷基自由基对CuII配位烯烃的亲核加成是决定手性的步骤。其中,本课题组的陈弓、何刚、王浩为共同通讯作者。
Enantioselective Alkylamination of Unactivated Alkenes under Copper Catalysis
Zibo Bai, Heng Zhang, Hao Wang*, Hanrui Yu, Gong Chen*, and Gang He*
JAm. Chem. Soc.ASAP DOI:10.1021/jacs.0c12333
正文
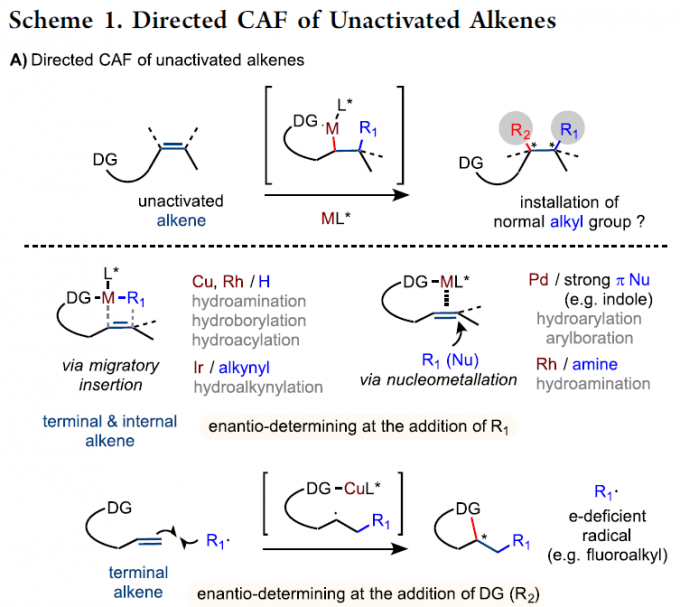
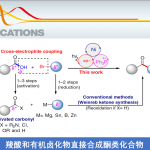
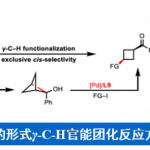
烯烃的催化不对称官能化(CAF),可简化立体选择性从而构建复杂碳骨架。其中,烷基的对映选择性加成最具价值,可快速构建烷基取代的立体中心。尽管在活化烯烃的不对称官能化方面已取得相当大的进步,但对于未活化烯烃的对映选择性反应,尤其是分子间反应,仍具有挑战。大部分文献报道[1],主要限于分子内末端烯烃的反应。由于区域和反应性控制问题,未活化内烯烃的对映选择性官能化更具挑战。最近,使用具有导向基团的底物已成为一种具有吸引力的策略,可实现金属催化未活化末端和内烯烃的对映选择性官能化[2],如通过迁移插入或亲核金属化将R1基团加成至双键以形成烷基金属中间体,然后被进一步官能化或质子化(Scheme 1A)。近年来,通过铜催化自由基介导的未活化末端烯烃的对映选择性双官能化反应作为一种新手段。在此类反应中,大多数涉及烯烃对缺电子自由基的非立体选择性捕集,以生成新的烷基自由基,然后与杂原子连接的导向基团反应形成对映体控制的环化产物。尽管目前已取得一定的进展,但烯烃的碳官能化反应仍仅限于芳基、酰基、炔基和特殊烷基的加成,常规的烷基向未活化烯烃的对映选择性加成仍具有挑战。本文主要报道在铜催化下,通过烷基自由基的对映选择性加成从而实现未活化烯烃的不对称双官能化反应。
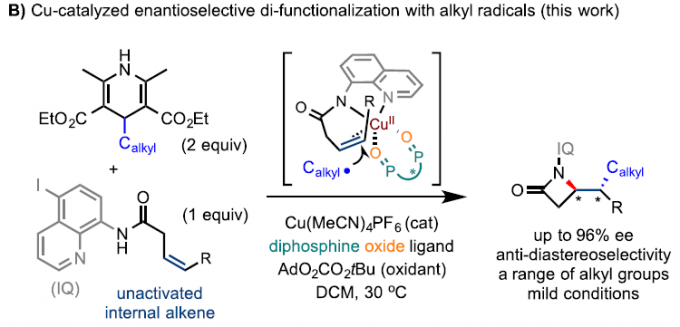
在过去的几年中,Engle课题组[3-5]报道了Pd催化未活化烯烃(酰胺连接的双齿氨基喹啉导向基团)与各种偶联底物的官能化反应(Scheme 1B)。这些反应的途径通常涉及烯烃的氨基喹啉导向基团控制,形成动力学上有利的钯环中间体,然后将其质子化或与合适的亲电试剂反应以生成单官能或双官能化产物。本课题组和Engle课题组[5]发现,使用单齿恶唑啉(MOX)配体可以通过对映选择性的方式进行某些碳官能化反应。然而,不对称碳官能化主要限于π型亲核试剂的加成,如吲哚或烯醇盐。最近,Zhao课题组[6]报道了Cu催化下烯烃与苄基的碳胺化反应。同时,由甲基芳烃(如甲苯)的原位进行抽氢反应产生的苄基自由基再与烯烃加成,形成螯合的CuIII-金属环,经过分子内的C-N还原消除,即可得到β-内酰胺产物。
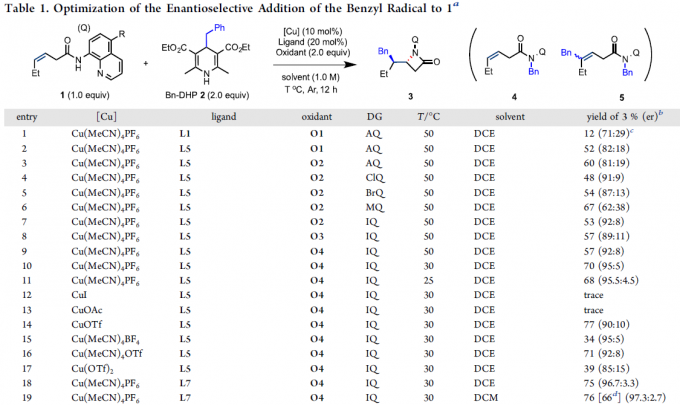
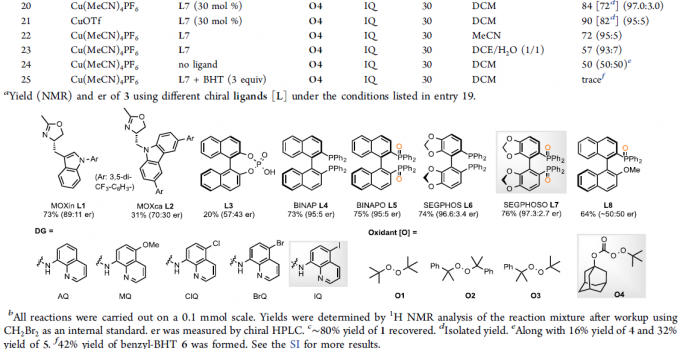
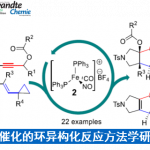
首先,作者以N-喹啉基-顺-3-己烯酰胺1和烷基试剂2作为模型底物,进行了相关反应条件的筛选(Table 1)。当以Cu(MeCN)4PF6为铜盐,以SEGPHOSO氧化物L7为配体,IQ为导向基团,O4为氧化剂,可在DCM溶剂中获得76%收率和97.3:2.7 er的目标产物3。
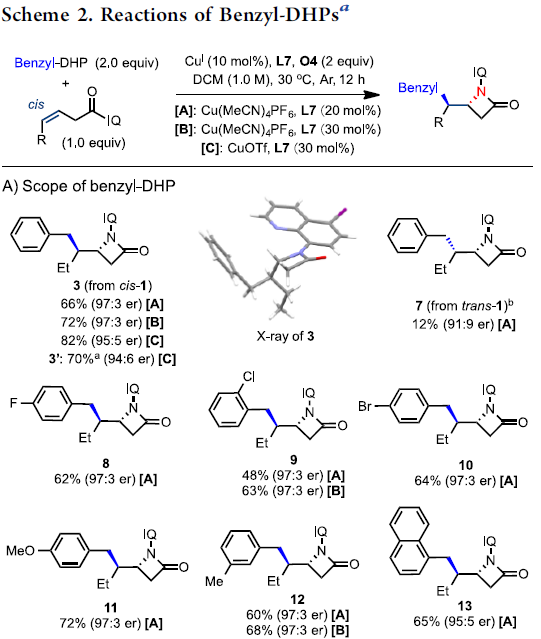
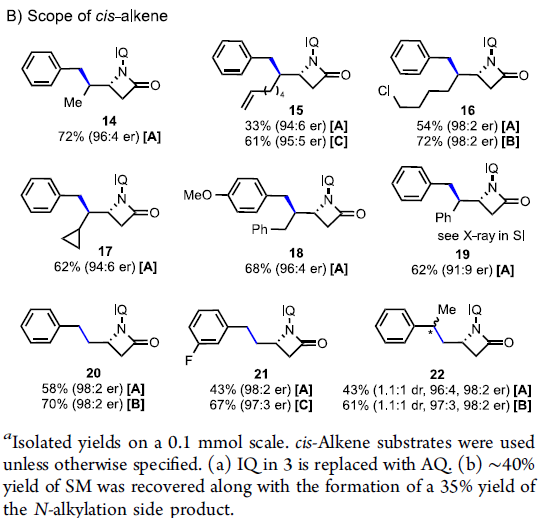
在获得上述最佳反应条件后,作者开始对底物进行了扩展(Scheme 2)。在对4-苄基汉斯酯的扩展时发现(Scheme 2A),苯环上带有各种取代基的4-苄基汉斯酯,均能以良好的收率、单一的非对映选择性和高对映选择性(高达98:2 er)获得所需的β-内酰胺产物8–13。其次,在对二取代顺式烯烃底物扩展时发现(Scheme 2B),带有不同末端R基团的多种顺式烯烃底物,均能以高收率和较高er值获得相应的β-内酰胺产物14–22。
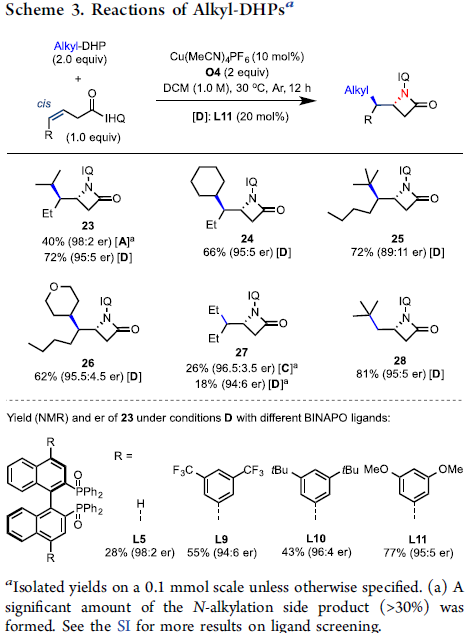
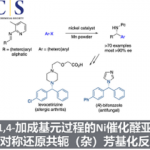
随后,作者也对普通的烷基自由基进行了扩展(Scheme 3)。在标准条件下,普通的烷基自由基也能以优异的立体选择性得到产物23,但也形成了大量的N-烷基化副产物。通过对配体的再次筛选后发现,当使用L11配体时,可有效抑制副反应的发生,从而将收率从40%提高至72%。通常,仲和叔烷基自由基(如24和25)均与体系兼容,而伯烷基自由基(如27中的乙基)具有较差的反应结果。同时,末端烯烃3-丁烯酰胺与普通的烷基自由基的反应也给出了良好的结果(如28),而与反烯烃的反应仍以低产率进行(<10%)。
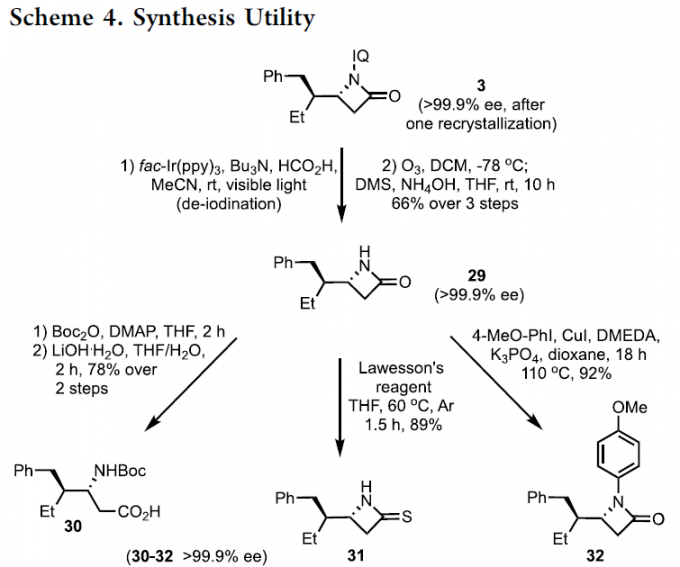
紧接着,作者对反应的实用性进行了研究(Scheme 4)。首先,克级实验获得60%收率和97:3 er的产物3,可通过结晶将ee提高至99.9%以上。其次,IQ导向基团可高效去除得到29。Boc活化29的内酰胺环,然后用LiOH水解,得到β-氨基酸30。同时,29可与Lawesson试剂反应,获得手性β-硫内酰胺31。其次,29可在Cu催化下与芳基碘化物进行N-芳基化反应,以高收率得到32。
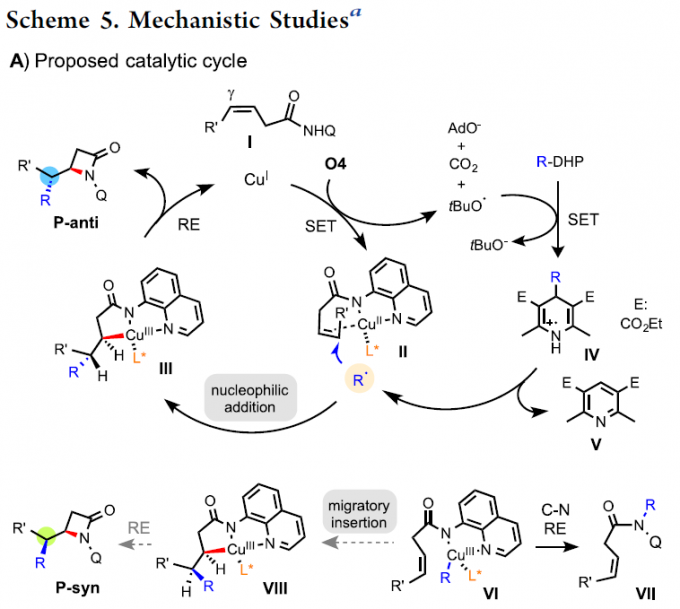
最后,作者提出了一种可能的自由基反应机理(Scheme 5)。首先,CuI催化剂与氧化剂O4进行单电子转移氧化,得到叔丁氧自由基和CuII,后者与烯烃底物I和二氧化膦配体形成配合物II。随后,叔丁氧自由基与R-DHP反应,生成亲核性的烷基自由基R·、吡啶V和叔丁氧基阴离子。紧接着,烷基自由基R·与配合物II进行亲核(Wacker型)加成,形成五元CuIII-金属杂环III。最后,III经分子内还原消除,得到β-内酰胺产物P-anti,并再生CuI。此外,R·还可以加到CuII中以形成烷基-CuIII中间体VI,其通过RE得到N-烷基化产物VII。作为替代途径,VI的R基团可以通过双键进行迁移插入以形成VIII,从而获得具有非对映选择性的产物P-syn。
总结
本文主要报道了一种将氨基喹啉导向基团和联芳基二膦氧化物手性配体相结合的体系,成功实现铜催化烷基自由基与内烯烃的对映选择性加成反应,获得复杂的β-内酰胺衍生物,这是以前方法所不能实现的。同时,与以前报道的Cu催化自由基对末端烯烃的不对称加成不同,Cu在烷基自由基对内烯烃的加成时就实现对映体控制,从而能够在烯烃的两个碳原子上进行立体控制以构建相邻的立体中心。
参考文献
[1] Selected examples of the enantioselective functionalization of unactivated alkenes: (a) Thalji, R. K.; Ellman, J. A.; Bergman, R. G. Highly Efficient and Enantioselective Cyclization of Aromatic Imines via Directed C−H Bond Activation. J. Am. Chem. Soc. 2004, 126, 7192−7193. (b) Han, X.; Widenhoefer, R. A. Platinum-Catalyzed Intramolecular Asymmetric Hydroarylation of Unactivated Alkenes with Indoles. Org. Lett. 2006, 8, 3801−3804. (c) Cong, H.; Fu, G. C. Catalytic Enantioselective Cyclization/Cross-Coupling with Alkyl Electrophiles.J. Am. Chem. Soc. 2014, 136, 3788−3791. (d) Song, G.; O, W. W. N.; Hou, Z. Enantioselective C−H Bond Addition of Pyridines to Alkenes Catalyzed by Chiral Half-Sandwich Rare-Earth Complexes.J. Am. Chem. Soc. 2014, 136, 12209−12212. (e) Nelson, H. M.; Williams, B. D.; Miro, J.; Toste, F. D. Enantioselective 1,1-Arylborylation of Alkenes: Merging Chiral Anion Phase Transfer with Pd Catalysis. J. Am. Chem. Soc. 2015, 137, 3213−3216. (f) Smith, J. R.; Collins, B. S. L.; Hesss, M. J.; Graham, M. A.; Myers, E. L.; Aggarwal, V. K. Enantioselective Rhodium(III)-Catalyzed Markovnikov Hydroboration of Unactivated Terminal Alkenes. J. Am. Chem. Soc. 2017, 139, 9148−9151. [2] Hoveyda, A. H.; Evans, D. A.; Fu, G. C. Substrate-Directable Chemical Reactions.Chem. Rev. 1993, 93, 1307−1370. [3] (a) Yang, K. S.; Gurak, J. A., Jr.; Liu, Z.; Engle, K. M. Catalytic, RegioselectiveHydrocarbofunctionalization of Unactivated Alkenes with Diverse C−H Nucleophiles. J. Am. Chem. Soc. 2016, 138, 14705−14712. (b) Liu, Z.; Zeng, T.; Yang, K. S.; Engle, K. M. β,γ-Vicinal Dicarbofunctionalization of Alkenyl Carbonyl Compounds via Directed Nucleopalladation. J. Am. Chem. Soc. 2016, 138, 15122−15125. [4] Zaitsev, V. G.; Shabashov, D.; Daugulis, O. Highly RegioselectiveArylation of sp3 C−H Bonds Catalyzed by Palladium Acetate.J. Am. Chem. Soc. 2005, 127, 13154−13155. [5]AQ-directed enantioselective functionalization of unactivated alkenes: (a) Wang, H.; Bai, Z.; Jiao, T.; Deng, Z.; Tong, H.; He, G.; Peng, Q.; Chen, G. Palladium-Catalyzed Amide-Directed Enantioselective Hydrocarbofunctionalization of Unactivated Alkenes Using a Chiral MonodentateOxazoline Ligand. J. Am. Chem. Soc. 2018, 140, 3542−3546. (b) Liu, Z.; Li, X.; Zeng, T.; Engle, K. M. Directed, Palladium(II)-Catalyzed Enantioselective anti-Carboboration of Alkenyl Carbonyl Compounds.ACS Catal. 2019, 9, 3260−3265. (c) Bai, Z.; Zheng, S.; Bai, Z.; Song, F.; Wang, H.; Peng, Q.; Chen, G.; He, G. Palladium-Catalyzed Amide-Directed Enantioselective Carboboration of Unactivated Alkenes Using a Chiral MonodentateOxazoline Ligand. ACS Catal. 2019, 9, 6502−6509. (d) Nimmagadda, S. K.; Liu, M.; Karunananda, M. K.; Gao, D.-W.; Apolinar, O.; Chen, J. S.; Liu, P.; Engle, K. M. Catalytic, Enantioselective α-Alkylation of Azlactones with Nonconjugated Alkenes by Directed Nucleopalladation. Angew. Chem. Int. Ed. 2019, 58, 3923−3927. (e) Shen, H.-C.; Zhang, L.; Chen, S.-S.; Feng, J.; Zhang, B.-W.; Zhang, Y.; Zhang, X.; Wu, Y.-D.; Gong, L.-Z. Enantioselective Addition of Cyclic Ketones to Unactivated Alkenes Enabled by Amine/Pd(II) Cooperative Catalysis.ACS Catal. 2019, 9, 791−797. (f) Wei, C.; Ye, X.; Xing, Q.; Hu, Y.; Xie, Y.; Shi, X. Synergistic palladium/enamine catalysis for asymmetric hydrocarbon functionalization of unactivated alkenes with ketones. Org. Biomol. Chem. 2019, 17, 6607−6611.
[6] Shi, P.; Wang, J.; Gan, Z.; Zhang, J.; Zeng, R.; Zhao, Y. A practical copper-catalyzed approach to β-lactams via radical carboamination of alkenyl carbonyl compounds. Chem. Commun. 2019, 55, 10523−10526.













No comments yet.