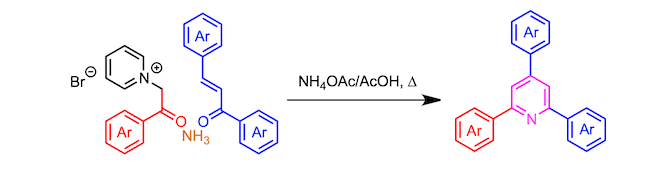
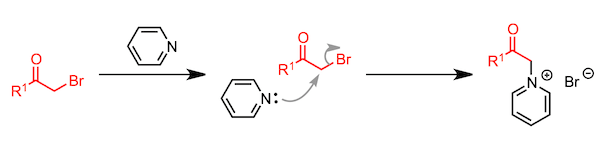
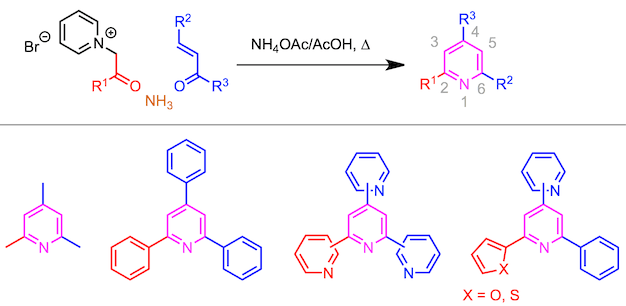
通过使α-卤代酮与吡啶反应形成的吡啶鎓盐、 α,β-不饱和羰基化合物、以及氨三组分缩合形成三取代吡啶的反应。
基本文献
- Zecher, W.; Kröhnke, F. Chem. Ber. 1961, 94, 690–697. DOI: 10.1002/cber.19610940317
- Zecher, W.; Kröhnke, F. Chem. Ber. 1961, 94, 707–712. DOI: 10.1002/cber.19610940319
Review
- Kröhnke, F. Synthesis 1976, 1–24. DOI: 10.1055/s-1976-23941
反応機構
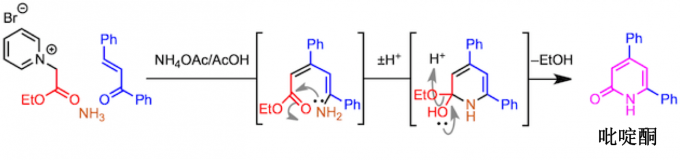
起始原料α-(1-吡啶基)酮通过α-卤代酮和吡啶的SN2 反应来制备。
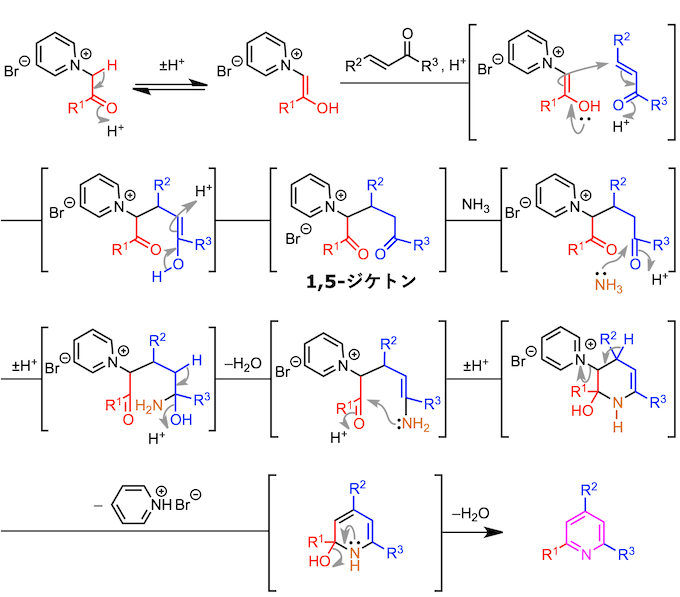
该吡啶鎓盐的亚甲基部分容易被烯醇化,所以亚甲基活性比较好1。也就是说可以作为亲核试剂对α,β-不饱和糖基化合物进行共轭加成反应。然后,发生氢转移形成1,5-二酮、继而进一步与氨进行二次缩合反应。这个时候,吡啶盐离去完成芳香系的构建,形成取代吡啶。(具体如下所示)
特征
- 不需要氧化步骤即可完成吡啶环构建
5元芳族杂环化合物如吡咯,呋喃和噻吩、可以通过1,4-二酮与杂原子源反应而制备(Paal-Knorr 型杂环合成)。然而,在为6元环化合物的吡啶的情况下,存在的问题是芳族体系不能简单地通过使1,5-二酮与氮原子源缩合来完成。因此,例如在Hantzsch的方法中,需要通过氧化二氢吡啶以获得吡啶。
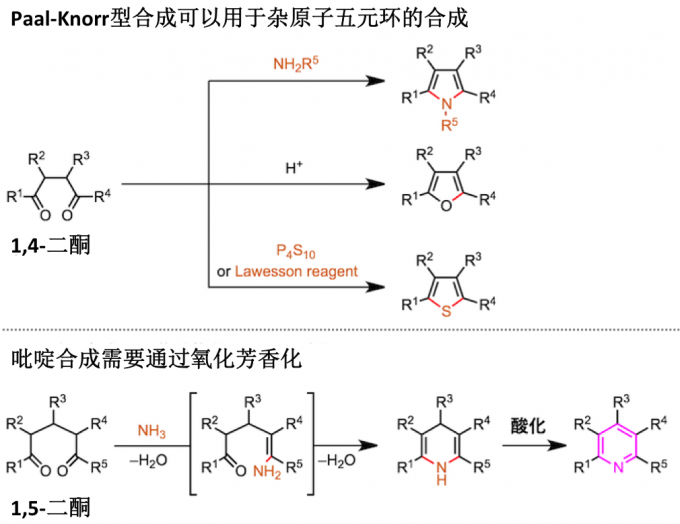
在Kröhnke吡啶合成中,1-吡啶基成为形成双键的离去基团(参见上述反应机理)。因此,该方法不需要用于完成吡啶环构筑的氧化步骤。
- 具有各种取代基的2,4,6-三取代的吡啶的合成
如下面的反应方案所示,该反应可以用于生成2,4,6-三取代的吡啶。该方法特别是对于三芳基吡啶和低聚吡啶的合成很有用。可引入的芳基范围比较广,包括苯环,吡啶基,2-噻吩基,2-呋喃基等。此外,如果使用改良法,也可以引入NH2基团和SH基团 (稍后阐述)。
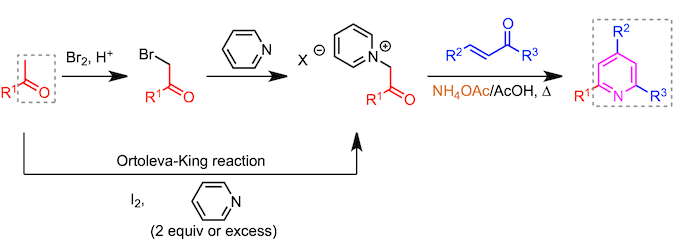
- 以乙酰基为原料2-3步合成2-吡啶环
用作吡啶鎓盐前体的α-卤代酮可以通过乙酰基的卤化来制备(如下图所示)。因此,也就是说,这意味着乙酰基可以通过总共三个步骤(1)卤化,(2)吡啶鎓形成 和(3)吡啶化转变成2-吡啶基。吡啶鎓盐也可以通过使碘和吡啶与乙酰基反应而直接得到(Ortoleva-King反应)2。通过使用这一点,乙酰基团可以分两步转化为2-吡啶基。
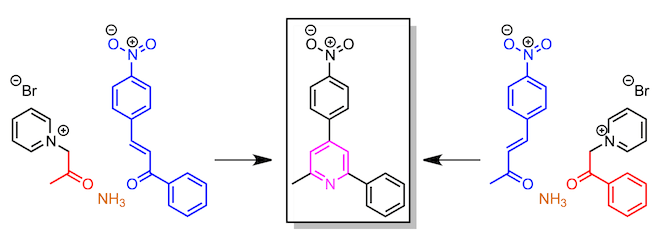
- 对于非对称吡啶的合成来说可以通过方法2所示进行合成
例如,如果您想合成非对称吡啶,如下图所示、是使用带甲基的吡啶鎓盐 (此时,使用具有苯基的α,β-不饱和酮)、还是使用具有苯基的吡啶鎓盐 (此时,使用具有甲基的α,β-不饱和酮),有这两种选择 。而实际上,其中一种route的收率较低。
几个变种手法
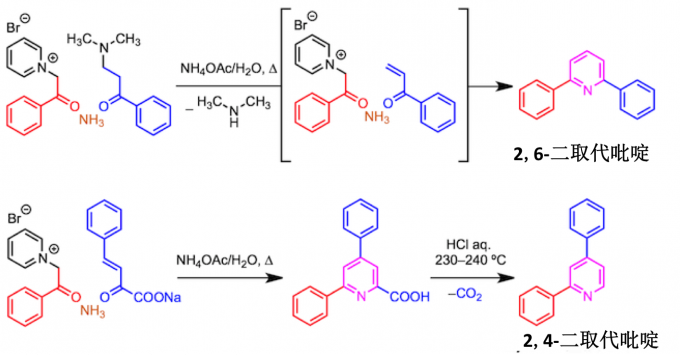
二取代吡啶的合成
当合成2,6-二取代吡啶时、这时候是使用未取代的α,β-不饱和酮作为迈克尔受体 、还是用它使用Mannich碱在体系中生成。另外在合成2,4-取代的吡啶时候先合成6位羧酸取代的吡啶后再脱碳酸制备。
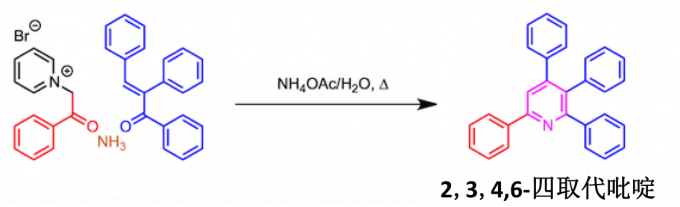
四取代吡啶的合成
四取代吡啶的合成也不是不可能的,但收率低。如下面的方案所示,预先在α,β-不饱和羰基化合物的α位引入取代基即可。
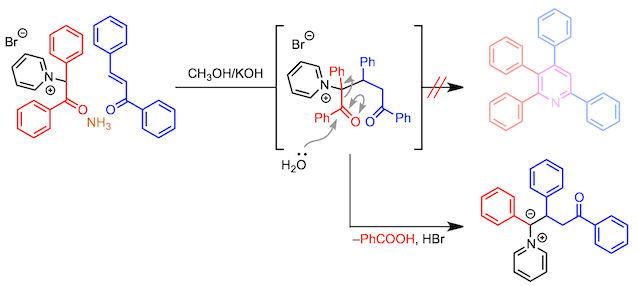
相反,取代基不能置于吡啶鎓盐的α-位。如果使用这样的吡啶鎓盐,虽然加成效果提高了,但是随后会发生酰基裂解,因此无法形成吡啶环(如下图所示)。
使用除甲基酮以外的其他物质作为吡啶鎓盐的前体
通过好好设计吡啶鎓盐的前体,也可以引入除芳基之外的取代基。具体而言,可以分别使用α-卤代腈或α-卤代二硫代酯来获得2-氨基吡啶或2-硫烷基吡啶。在这些反应中,由于在环外延伸的C = X双键的互变异构,可以将双键引入环中。
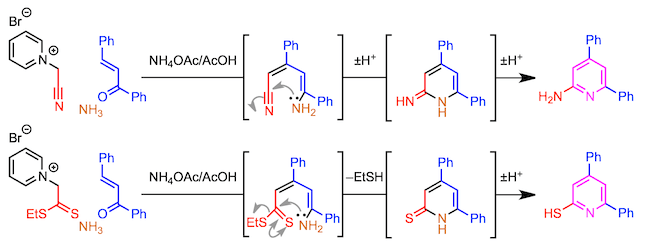
吡啶酮合成也是可能的。为此,使用从α-卤代酯获得的吡啶鎓盐为底物。反应机理的要点如下,在最终环化阶段,发生了消除反应而不是脱水缩合。在利用上述二硫代酯的例子中,与通过互变异构将其转化成吡啶相反,在这种情况下,可以分离出吡啶酮。
反应实例 – 合成寡聚吡啶 –
使用Kröhnke吡啶合成法合成寡聚吡啶,大致可以考虑以下两种策略。
使用衍生自乙酰吡啶的吡啶鎓盐
使用具有吡啶环的α,β-不饱和羰基化合物
运用该策略可以如下图所示构建联吡啶,三联吡啶,支链四吡啶。
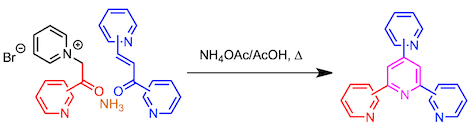
而在此,小编将介绍通过其他方法合成寡聚吡啶的方法。
联吡啶的合成
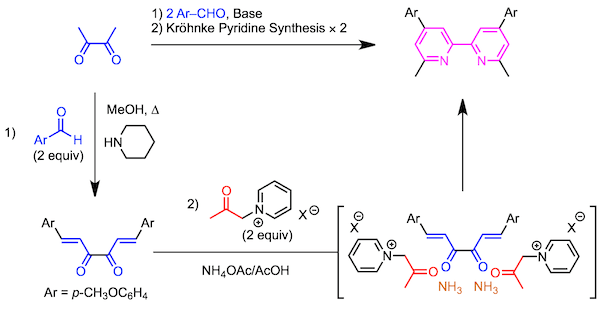
先通过丁烷-2,3-二酮与醛之间的醛醇反应合成双头的α,β-不饱和羰基化合物。然后与2当量的吡啶盐反应,进行2次Kröhnke 吡啶合成、得到联吡啶。
三联吡啶的合成
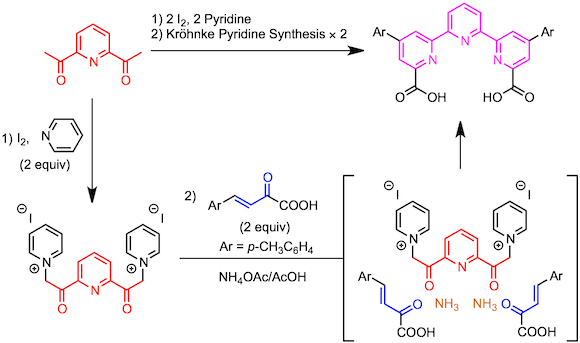
通过上述的Ortoleva-King反应由2,6-二乙酰基吡啶制备双吡啶鎓盐。然后与2当量的α,β-不饱和羰基化合物反应,得到三联吡啶。
四联吡啶的合成
在双头的α,β-不饱和羰基化合物中,加入2当量的由乙酰基吡啶衍生的吡啶鎓盐,进行缩合反应,形成四联吡啶。
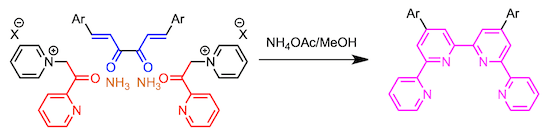
五联吡啶的合成
通过Mannich反应、由2,6-二乙酰基吡啶制备Mannich碱。然后与2当量的由乙酰基吡啶衍生的吡啶鎓盐反应,得到五联吡啶。
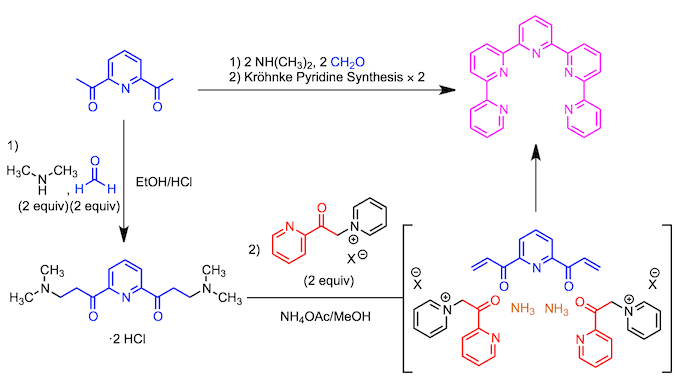
环六联吡啶的合成4
通过偶联反应对直线状的六联吡啶进行关环的手法并不可行。最后研究发现,可以以六联吡啶位底物,利用 Kröhnke吡啶合成法,合成环2,2’:4,’4’’:2’’,2’’’:4’’’,4’’’’:2’’’’,2’’’’’:4’’’’’,4-六吡啶。(具体参照下图所示)
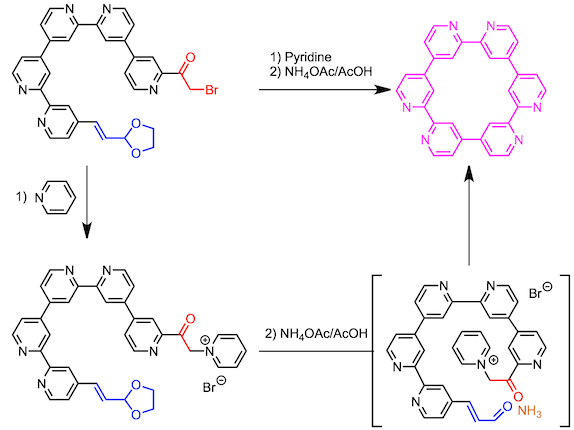
在该反应中,高度反应性的α,β-不饱和醛被缩醛保护,在体系中脱保护,然后使用。在反应体系中,由于可以缓慢的生成α,β-不饱和醛,因此抑制了分子间反应,从而通过分子内反应使得关环反应能够高效进行。
参考文献
- Kröhnke, F. Angew. Chem., Int. Ed. 1963, 2, 225–238. DOI: 10.1002/anie.196302251
- King, L. K. J. Am. Chem. Soc. 1944, 66, 894–895. DOI: 10.1021/ja01234a015
- Kröhnke Pyridine Synthesis. In Comprehensive Organic Name Reaction and Reagents [online]; Wang, Z. Ed.; 2010, Chapter 379, pp 1965–1968. DOI: 10.1002/9780470638859.conrr379
- Kelly, T. R.; Lee, Y.-J.; Mears, J. R. J. Org. Chem. 1997, 62, 2774–2781. DOI: 10.1021/jo962236k
- Kröhnke F. Synthesis 1976, 1–24. DOI: 10.1055/s-1976-23941
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!