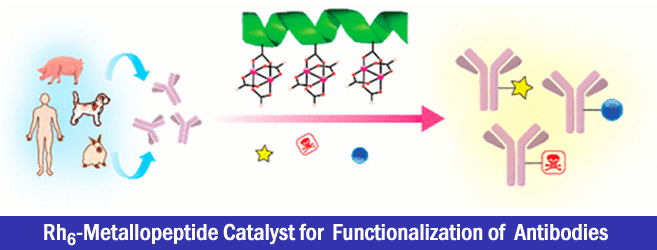
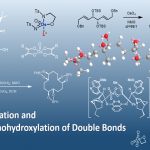
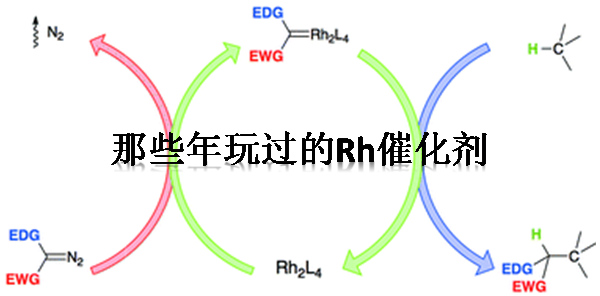
2017年、莱斯大学・Zachary Ball课题组、使用铑(II)金属肽(肽为配体)作为催化剂、成功开发出了IgG抗体的Fc区域的选择性化学修饰法。运用本方法不会对Fab区域进行修饰,因此不会影响抗体的抗原识别能力、另外不需要改变原有的底物序列、因此可以很简便的实现对抗体或均质抗体-药物偶联物(ADC)的荧光标记。
“A Hexa-rhodium Metallopeptide Catalyst for Site-Specific Functionalization of Natural Antibodies”
Ohata, J.; Ball, Z. T.* J. Am. Chem. Soc. 2017, 139, 12617–12622. DOI: 10.1021/jacs.7b06428
问题设定
蛋白质等的化学修饰作为蛋白质功能化的一种有效地方法论,近年来随着抗体偶联药物(ADC)的发展也受到广泛关注。针对赖氨酸或半胱氨酸的亲核侧链的修饰在过去一直是主流,但由于其高反应性和在蛋白质表面的高暴露性问题,常常无法实现高效的化学选择性修饰,因此使得ADC的构效关系取得・结构解析・再现性问题频发。由于这些问题,近年来的研究主要集中在某些限定的修饰位置,尝试合成均质的ADC。到目前为止,已经报道的比较有效地尝试有:基于蛋白质工程的非天然氨基酸取代方法[1],适用于酶/化学试剂[2]的特殊序列掺入方法。但是,还是由于特定位置的高度化学选择性修饰是一个难题,因此基本上都是伴有着副反应的修饰,特别是对于Fc领域选择性的修饰法一直以来都没有大的突破。
解决手法
Ball等人设计了特殊的多肽配体,开发出了新型多肽铑(II)催化剂、并且利用配体与蛋白质的相互作用,尝试对蛋白质进行C-H插入修饰[3]。但是,一般研究只集中在比较小的蛋白质上,而且常常伴有产率低・修饰不完全等问题。
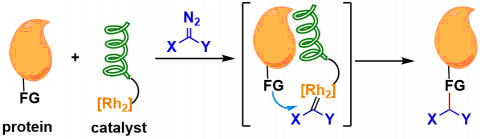
这次要介绍的论文中,作者以protein A由来的Z结构域肽作为羧酸铑的其中一个配体,与抗体Fc进行区域选择性相互作用,实现了抗体Fc区域的选择性化学修饰。
主张的有效性验证
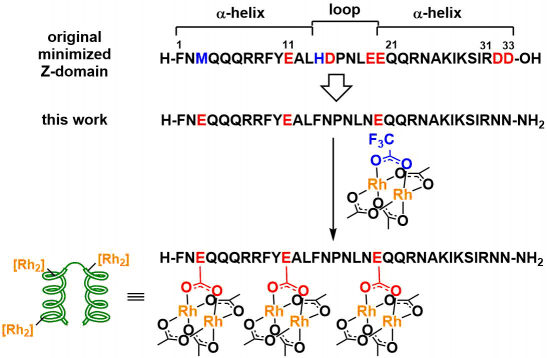
①多肽铑(II)催化剂的设计・合成・结构确定
多肽―抗体复合物的已知晶体(PDB: 1FC2)结构如下图所示,作者的铑催化剂也是根据该单晶结构进行设计的。
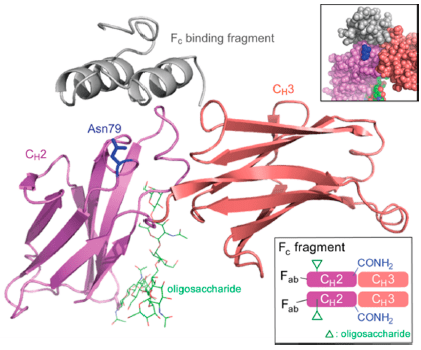
(图引用自原论文)
Z结构域的多肽33残基中,除去与金属结合后能引起催化剂失活・诱导凝聚・取用纯化困难的M3与H14[5]、与Rh结合部位集中于E3、E11、E20。作者利用固相合成法合成出目标多肽,然后与Rh2(tfa)1(OAc)3进行配体交换[6]、合成了新型多肽配体的铑催化剂。
② Rh金属肽催化剂催化的反应条件优化
以抗体Fc片段为底物,进行催化反应优化。最终,筛选结果: 抗体(8 μM)、Rh催化剂 (16 μM)、重氮试剂(1 mM)、N–tert-butylhydroxylamine (TBHA) buffered saline with glycerol (total 500 μL, pH 6.4)、10℃、8h为最佳条件。
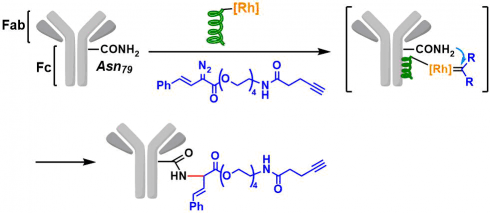
对Fab·Fc片段分别进行反应,作者发现反应仅在Fc片段进行。另外在以多肽为配体的Rh催化剂与Rh2(OAc)4共存下或者不使用Rh多肽催化剂时,作者证实,当与Fc-结合肽竞争时反应效率降低(分析通过炔烃载体型蛋白质的化学印迹进行[7])。另外,Standard条件下,进行反应后的产物通过MALDI解析后发现生成了单一产物,并且在胰蛋白酶消化后的MS / MS分析表明,Fc区中只有Asn 79被修饰。
另外很有意思的是,从本论文中讨论的结果来看,多个Rh催化中心有利于提高整体的催化活性。作为对照实验,作者分别仅仅对E3、E11、E20进行配体交换,得到的单一Rh中心的催化剂的催化活性与含有多个Rh中心的Rh催化剂活性相比,明显活性要差(产率大幅降低)。很有可能,Rh除了作为催化活性中心作用以外,也有可能作为路易斯酸增强了与抗体的结合能,从而提高了催化活性[8]。
③抗体与搭载分子的适用性与功能评价
抗体侧的适用性:已知的能与proteinA结合的人类,猪,兔,犬IgG抗体都能适用该催化反应。无法结合的牛抗体的修饰度(反应活性)很低。另外老鼠的 IgG抗体虽然能与proteinA结合、有可能是没有合适的反应位点,因此修饰反应无法进行。对人源化抗体药物赫赛汀也能进行修饰。
荧光分子的搭载:对于如上所述用炔烃标签修饰的人IgG和赫赛汀、可以与发红色荧光的螯合物(5a)[9]与发绿色荧光分子FITC(5b)通过Click反应结合。通过对HER2过表达癌细胞株(SK-BR-3)撒上FITC修饰(荧光标记)过的赫赛汀,可以看到细胞周围发光,这表明修饰过的赫赛汀还保持了抗原结合能。
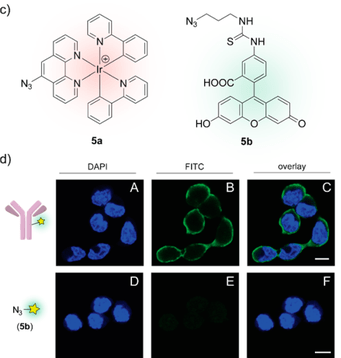
(図は論文より引用)
均质ADC的创制:ADC通过使具有毒素的分子(多柔比星)和用于纯化/检测的标签(脱硫生物素)的化合物6与炔烃修饰的抗体反应来生产。从校准曲线计算抗体 – 药物结合比(DAR)为1:1,并且确认修饰很顺利的进行,产率> 90%。并且得到的ADC保持有对SK-BR-3细胞的结合能。
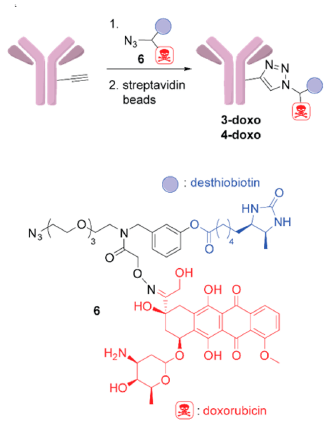
(図は論文より引用)
Comment
- Ball组是为数不多的以多肽为配体,利用Rh催化的C-H插入反应为基点,利用配体多肽与一些多肽,蛋白质的相互作用对大分子化合物进行修饰的课题组。在多年的不断的实践中,积累了大量这块的original知识,经验。
- 抗体具有C2对称性,因此ADC的DAR应该是偶数,在本论文中确是1:1,这一点小编感到挺不可思议的。
- 使用过渡金属(Rh、Cu)这一点,从残留毒性上来看,是一个比较遗憾的点。对于Rh的毒性虽然报道的比较少,然而应该不比铂低[10]。
次に読むべき論文は?
・抗体结合配体的review[11]。
参考文献
- (a) Hofer, T.; Skeffington, L. R.; Chapman, C. M.; Rader, C. Biochemistry 2009, 48, 12047. DOI: 10.1021/bi901744t (b) Axup, J. Y.; Bajjuri, K. M.; Ritland, M.; Hutchins, B. M.; Kim, C. H.; Kazane, S. A.; Halder, R.; Forsyth, J. S.; Santidrian, A. F.; Stafin, K.; Lu, Y.; Tran, H.; Seller, A. J.; Biroc, S. L.; Szydlik, A.; Pinkstaff, J. K.; Tian, F.; Sinha, S. C.; Felding-Habermann, B.; Smider, V. V.; Schultz, P. G. Proc. Natl. Acad. Sci. U. S. A. 2012, 109, 16101. doi:10.1073/pnas.1211023109 (c) Zimmerman, E. S.; Heibeck, T. H.; Gill, A.; Li, X.; Murray, C. J.; Madlansacay, M. R.; Tran, C.; Uter, N. T.; Yin, G.; Rivers, P. J.; Yam, A. Y.; Wang, W. D.; Steiner, A. R.; Bajad, S. U.; Penta, K.; Yang, W.; Hallam, T. J.; Thanos, C. D.; Sato, A. K. Bioconjugate Chem. 2014, 25, 351. DOI: 10.1021/bc400490z
- (a) Siegmund, V.; Schmelz, S.; Dickgiesser, S.; Beck, J.; Ebenig, A.; Fittler, H.; Frauendorf, H.; Piater, B.; Betz, U. A. K.; Avrutina, O.; Scrima, A.; Fuchsbauer, H.-L.; Kolmar, H. Angew. Chem., Int. Ed. 2015, 54, 13420. DOI: 10.1002/anie.201504851 (b) Witus, L. S.; Netirojjanakul, C.; Palla, K. S.; Muehl, E. M.; Weng, C.-H.; Iavarone, A. T.; Francis, M. B. J. Am. Chem. Soc. 2013, 135, 17223. DOI: 10.1021/ja408868a (c) Zhang, C.; Welborn, M.; Zhu, T.; Yang, N. J.; Santos, M. S.; Van Voorhis, T.; Pentelute, B. L. Nat. Chem. 2016, 8, 120. doi:10.1038/nchem.2413
- Ball, Z. T. Curr. Opin. Chem. Biol. 2015, 25, 98. doi: 10.1016/j.cbpa.2014.12.017
- Braisted, A. C.; Wells, J. A. Proc. Natl. Acad. Sci. U. S. A. 1996, 93, 5688.
- Sambasivan, R.; Zheng, W.; Burya, S. J.; Popp, B. V.; Turro, C.; Clementi, C.; Ball, Z. T. Chem. Sci. 2014, 5, 1401. doi:10.1039/C3SC53354A
- Martin, S. C.; Minus, M. B.; Ball, Z. T. Methods Enzymol. 2016, 580, 1. doi:10.1016/bs.mie.2016.04.016
- Ohata, J.; Vohidov, F.; Ball, Z. T. Mol. BioSyst. 2015, 11, 2846. doi:10.1039/C5MB00510H
- Vohidov, F.; Knudsen, S. E.; Leonard, P. G.; Ohata, J.; Wheadon, M. J.; Popp, B. V.; Ladbury, J. E.; Ball, Z. T. Chem. Sci. 2015, 6, 4778. doi:10.1039/C5SC01602A
- Ohata, J.; Vohidov, F.; Aliyan, A.; Huang, K.; Martí, A. A.; Ball, Z. T. Chem. Commun. 2015, 51, 15192. doi:10.1039/C5CC06099K
- https://www.sanei.or.jp/images/contents/290/Rhodium_soluble_compounds.pdf
- Kruljec, N.; Bratkovič, T. Bioconjugate Chem. 2017, 28, 2009. DOI: 10.1021/acs.bioconjchem.7b00335
关联记事
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!






















No comments yet.