酪氨酸(Tyrosine, Tyr)也是细胞用来合成蛋白质的22种必需氨基酸之一,为神经传递物质和增加血浆神经传递物质程度(尤其是多巴胺和去甲肾上腺素)的前驱物,副作用为易对情绪造成影响,使在压力状况下对情绪的影响更为明显。
就侧基反应性而言,与赖氨酸(Lys)、半胱酰胺(Cys)类似,反应性并不是很高,在蛋白质表面露出数适中。在生物体中翻译后容易形成靶蛋白,所以对于其的早期修饰可以直接改变蛋白质的功能。
而修饰位点-苯酚侧基,由于其稳定性比较好,所以现有的很多修饰方法都是用了比较强的氧化条件,或者重金属催化剂。虽然修饰的实例有很多,但是就目前这一长一短来看,就方法学而言,改善的余地还是很大的。
基本文献
<Chemist’s Guide>
- Stephanopoulos, N.; Francis, M. B. Nat. Chem. Biol. 2011, 7, 876. doi:10.1038/nchembio.720
- deGruyter, J. N.; Malihns, L. R.; Baran, P. S. Biochemistry 2017, 56, 3863. DOI: 10.1021/acs.biochem.7b00536
反应实例
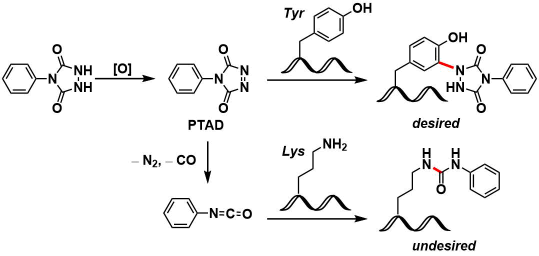
PTAD法[1]:反应试剂事先活化后与原料蛋白质或多肽在buffer中混合即可进行反应,是最简便的一种修饰法。然而,有一个问题是,PTAD试剂再水中会放出氮气与一氧化碳,分解成isocynate,这会与半胱酰胺(Cys)侧基发生交叉反应。
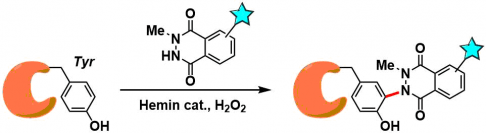
使用鲁米诺衍生物的Tyr修饰方法[2]:利用血红素复合物或者是在Horseradish-peroxidase/NADH/O2的条件下,避免了PTAD法中的交叉反应,通过自由基型反应对Tyr进行修饰。
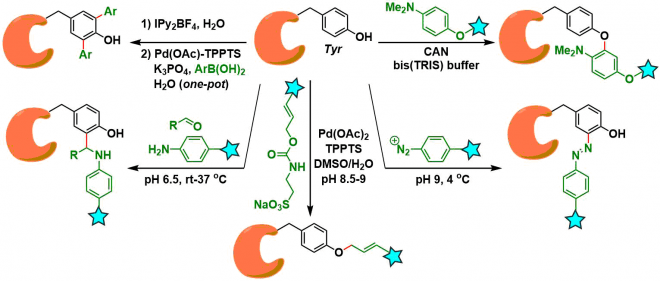
其他的还有如使用Betti型3组分条件的Tyr修饰法[3] 、酪氨酸的碘化→水中鈴木-宮浦偶联[4]、富电子芳香环的氧化偶联[5]、π-烯丙基钯催化剂条件[6] 、重氮化合物的加成反应[7]等多种修饰手法。由于各个条件都有它们的局限性,所以对于具体的底物,得选择适用的方法。
参考文献
- (a) Ban, H.; Gavrilyuk, J.; Barbas, C. F., III J. Am. Chem. Soc. 2010, 132, 1523. DOI: 10.1021/ja909062q (b) Ban, H.; Nagano, M.; Gavrilyuk, J.; Hakamata, W.; Inokuma, T.; Barbas, C. F., III Bioconjugate Chem. 2013, 24, 520. DOI: 10.1021/bc300665t
- (a) Sato, S.; Nakamura, K.; Nakamura, H. ACS Chem. Biol. 2015, 10, 2633. DOI: 10.1021/acschembio.5b00440 (b) Sato, S.; Nakamura, K.; Nakamura, H. ChemBioChem 2017, 18, 475. DOI: 10.1002/cbic.201600649
- (a) Joshi, N. S.; Whitaker, L. R.; Francis, M. B. J. Am. Chem. Soc. 2004, 126, 15942. DOI: 10.1021/ja0439017 (b) Romanini, D. W.; Francis, M. B. Bioconjugate Chem. 2008, 19, 153. DOI: 10.1021/bc700231v
- Vilaró, M.; Arsequell, G.; Valencia, G.; Ballesteros, A.; Barluenga, J. Org. Lett.2008, 10, 3243. DOI: 10.1021/ol801009z
- (a) Seim, K. L.; Obermeyer, A. C.; Francis, M. B. J. Am. Chem. Soc. 2011, 133, 16970. DOI: 10.1021/ja206324q (b) Sato, S.; Nakamura, H. Angew. Chem. Int. Ed. 2014, 52, 8681. DOI: 10.1002/anie.201303831
- Tilley, S. D.; Francis, M. B. J. Am. Chem. Soc. 2006, 128, 1080. DOI: 10.1021/ja057106k
- (a) Hooker, J. M.; Kovacs, E. W.; Francis, M. B. J. Am. Chem. Soc. 2004, 126, 3718. DOI: 10.1021/ja031790q (b) Schlick, T. L.; Ding, Z.; Kovacs, E. W.; Francis, M. B. J. Am. Chem. Soc. 2005, 127, 3718. DOI: 10.1021/ja046239n (c) Li, K.; Chen, Y.; Li, S. Q.; Huong, G. N.; Niu, Z. W.; You, S. J.; Mello, C. M.; Lu, X. B.; Wang, Q. A. Bioconjugate Chem. 2010, 21, 1369. DOI: 10.1021/bc900405q (d) Jones, M. W.; Mantovani, G.; Blindauer, C. A.; Ryan, S. M.; Wang, X.; Brayden, D. J.; Haddleton, D. M. J. Am. Chem. Soc. 2012, 134, 7406. DOI: 10.1021/ja211855q
外部链接
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载
















No comments yet.