译自Chem-Station网站日本版 原文链接:塩基が肝!シクロヘキセンのcis-1,3-カルボホウ素化反応
翻译:炸鸡
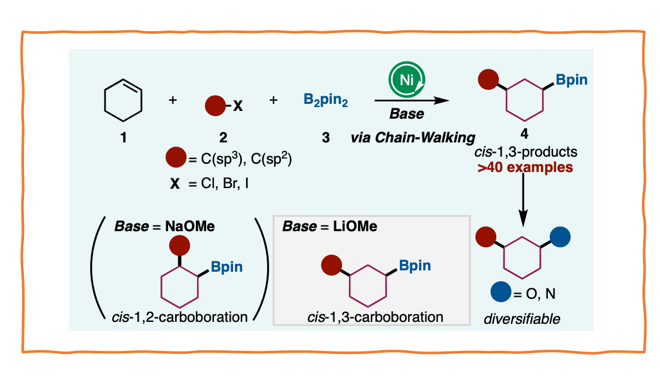
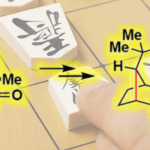
用镍催化的环己烯上区域和立体选择性的碳硼化反应(Carboboration)已经被成功开发出来。反应用的碱是cis-1,3-硼化物选择性生成的关键。
环己烯的cis-1,3-Carboboration反应
cis-1,3-二取代环己烷骨架是常见的具有生理活性化合物的骨架之一[1],其合成方法已经被广泛研究。最近关于cis-1,3-二取代环己烷骨架的研究是1,3-二取代苯的cis-选择性氢化以及环己烷甲酸的C–H芳基化,引起了极大的关注[2]。
环己烯(1)是一种廉价易得的化合物,可以通过环己烷的双官能基化合成cis-1,3-二取代环己烷4,即cis-1,3-二取代环己烷骨架。然而,以往的研究通常使用过渡金属催化剂对1进行双官能基化反应会得到1,2-二取代产物。Brown等人在DMA中,在Ni(cod)2催化剂和NaOtAmyl的条件下,将1与苄氯(2)和B2pin2(3)反应,选择性地得到cis-1,2-二取代环己烷(图1A)[3]。关于如何解决这一问题,武汉大学的Yin教授等认为利用过渡金属催化剂的链传递反应可以打破这种1,2-选择性的禁锢,从而得到从1位取代或4位取代的产物。Yin教授等先前已经报告了几例使用镍催化剂的烯烃1,n-碳碳硼化反应(n = 1,3,4…)(图1B)[4]。在双键发生碳硼化反应后,由β-氢脱离产生的Ni-H络合物发生连续的配位插入(链传递反应),从而得到1,n-碳硼化体。链传递反应的位置选择性通常是底物控制的,停步在苄位或杂原子的α位,从而实现位置选择性。然而,在化合物1中,这些“停止机制”是不存在的,因此无法确定是否能够控制位置选择性,甚至立体选择性。
本研究中,作者发现通过链传递反应,可以实现镍催化的化合物1的cis-1,3-选择性碳硼化反应(图1C)。在这一反应中,使用LiOMe作为碱是实现cis-1,3-选择性的关键,而在使用其他碱时,得到的则是cis-1,2-二取代物。
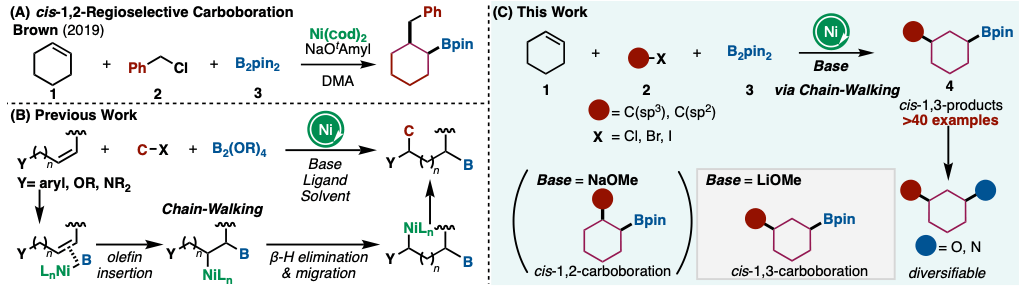
图1. A) cis-1,2-位置选择性的碳硼化B) 前期研究 C) 新研究
“Base-Modulated 1,3-Regio- and Stereoselective Carboboration of Cyclohexenes”
Kong, W.; Bao, Y.; Lu, L.; Han, Z.; Zhong, Y.; Zhang, R.; Li, Y.; Yin, G. Angew. Chem., Int. Ed. 2023, 62, e202308041.
论文作者介绍
研究者:Yuqiang Li (李玉强)

研究者履历:
2012–2016 B.S., Central South University, China
2016–2021 Ph.D., Wuhan University, China (Prof. Guoyin Yin)
2021–2022 Assistant Professor, Central South University, China
2022– Researcher, Shanghai Artificial Intelligence Laboratory, China
研究内容 镍催化的新型反应的开发
研究者:Guoyin Yin (阴 国印)

研究者履历:
2002–2006 B.S., Northeast Agricultural University, China (Prof. Fei Ye and Prof. Ying Fu)
2006–2011 Ph.D., Shanghai Institute of Organic Chemistry, China (Prof. Guosheng Liu)
2011–2013 Postdoc, Technical University of Munich, Germany (Prof. Thorsten Bach)
2013–2014 Postdoc, RWTH Aachen University, Germany (Prof. Franziska Schoenebeck)
2014–2016 Postdoc, University of Delaware, USA (Prof. Donald A. Watson)
2016–2021 Researcher, Wuhan University, China
2021– Professor (untenured), Wuhan University, China
研究内容 过渡金属催化的含有二官能基化的新反应开发
论文概要
在NMP溶剂里,在NiCl2·DME的催化下,让环己烯(1)与有机卤代物2、B2pin2(3)以及LiOMe在50°C下搅拌反应12小时,可以得到cis-1,3-二取代环己烷4(见图2A)。有机卤代物2除了不可以是三级卤代物,可以是各种卤代烷基和溴代芳烃,并以良好的收率获得相应的产物4(4a–4c)。3-取代环己烯5也可应用于反应,通过cis-1,3-碳硼化反应,然后氧化,以较高收率得到了产物4d。
推测的反应机理如下图所示(见图2B)。在LiOMe的存在下,Ni(II)配合物与3发生转移金属化反应,生成Ni(II)–Bpin(B)。B插入到1中形成C,通过链行走反应生成cis-1,3-镍环己烯中间体(E)。随后,自由基2′与E反应生成Ni(Ⅲ)(F),经过还原脱离反应得到产物4的同时生成Ni(Ⅰ)(G)。G与2反应再生烷基自由基2′和Ni(II)(A)。DFT计算的结果表明,1,3-取代物选择性生成的原因是中间体E在热力学上较C和1,4-二取代物(H)更为稳定(详细信息请参阅论文)。
另外,只有使用LiOMe才能获得产物4,而使用NaOMe或其他碱时,尽管收率较低(20-30%),但主产物是1,2-二取代物6(见图2C)。关于这种位置选择性变化,论文认为与Ni–Bpin中间体的氧化态有关。如前所述,LiOMe条件下会生成二价的Ni(II)–Bpin;使用NaOMe时,Ni(II)(A)通过3和碱被还原为Ni0(I),然后通过与Ni(II)配合物的归中反应和接下来的与3的转移金属化反应生成Ni(Ⅰ)-Bpin(K)[5]。在K与1的配位插入之后,链行走反应不会发生,导致只会生成1,2-二取代物(详细信息请参阅论文)。”
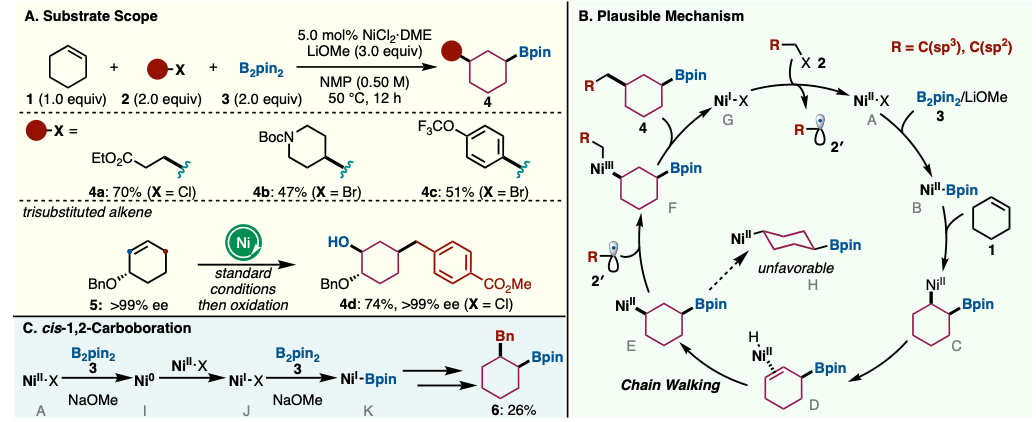
图2. A) 底物适用范围 B) 推测的反応機構 C) cis-1,2-碳硼化
研究人员以廉价的环己烯为原料,通过使用镍催化剂成功实现了cis-1,3-硼氢化反应。这个反应有望成为合成生物活性物质的简便方法。
参考文献
- (a) Lovering, F.; Bikker, J.; Humblet, C. Escape from Flatland: Increasing Saturation as an Approach to Improving Clinical Success. Med. Chem. 2009, 52, 6752–6756. DOI: 10.1021/jm901241e (b) Smaligo, A. J.; Swain, Manisha.; Quintana, J. C.; Tan. M. F.; Kim. D. A.; Kwon, O. Hydrodealkenylative C(sp3)–C(sp2) Bond Fragmentation. Science 2019, 364, 681–685. DOI: 10.1126/science.aaw4212
- (a) Wiesenfeldt. M. P.; Nairoukh. Z.; Li. W.; Glorius. F. Hydrogenation of Fluoroarenes: Direct Access to All-cis-(Multi)fluorinated Cycloalkanes. Science 2017, 357, 908–912. DOI: 1126/science.aao0270(b) Ling, L.; He, Y.; Zhang, X.; Luo, M.; Zeng, X. Hydrogenation of (Hetero)aryl Boronate Esters with a Cyclic (Alkyl)(amino)carbene–Rhodium Complex: Direct Access to cis-Substituted Borylated Cycloalkanes and Saturated Heterocycles. Chem., Int. Ed. 2019, 58, 6554–6558. DOI: 10.1002/anie.201811210 (c) Kang, G.; Strassfeld, D. A.; Sheng, T.; Chen, C.-Y.; Yu, J.-Q. Transannular C–H Functionalization of Cycloalkane Carboxylic Acids. Nature 2023, 618, 519–523. DOI: 10.1038/s41586-023-06000-z
- (a) Logan, K. M.; Sardini, D. W.; Brown, M. K. Nickel-Catalyzed Stereoselective Arylboration of Unactivated Alkenes. Am. Chem. Soc. 2018, 140, 159–162. DOI: 10.1021/jacs.7b12160 (b) Joung, S.; Bergmann, A. M.; Brown, M. K. Ni-Catalyzed 1,2-Benzylboration of 1,2-Disubstituted Unactivated Alkenes. Chem. Sci. 2019, 10, 10944–10947. DOI: 10.1039/C9SC04199K
- (a) Ding, C.; Ren, Y.; Sun, C.; Long, J.; Yin, G. Regio- and Stereoselective Alkylboration of Endocyclic Olefins Enabled by Nickel Catalysis. Am. Chem. Soc. 2021, 143, 20027–20034. DOI: 10.1021/jacs.1c09214 (b) Li, Y.; Wu, D.; Cheng, H.; Yin, G. Difunctionalization of Alkenes Involving Metal Migration. Angew. Chem., Int. Ed. 2020, 59, 7990–8003. DOI: 10.1002/anie.201913382 (c) Dhungana, R. K.; Sapkota, R. R.; Niroula, D.; Giri, R. Walking Metals: Catalytic Difunctionalization of Alkenes at Nonclassical Sites. Chem. Sci. 2020, 11, 9757–9774. DOI: 10.1039/D0SC03634J (d) Sun, C.; Li, Y.; Yin, G. Practical Synthesis of Chiral Allylboronates by Asymmetric 1,1‐Difunctionalization of Terminal Alkenes. Angew. Chem., Int. Ed. 2022, 61, e202209076. DOI: 10.1002/anie.202209076 (e) Li, Y.; Li, Y.; Shi, H.; Wei, H.; Li, H.; Funes-Ardoiz, I.; Yin, G. Modular Access to Substituted Cyclohexanes with Kinetic Stereocontrol. Science 2022, 376, 749–753. DOI: 10.1126/science.abn9124
- Lin, C.-Y.; Power, P. P. Complexes of Ni(I): A “Rare” Oxidation State of Growing Importance. Soc. Rev. 2017, 46, 5347–5399. DOI: 10.1039/C7CS00216E
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载.






















No comments yet.