今年的诺贝尔化学奖相比于去年颁发给分子机器来说更出人意料,这一次颁发给了【冷冻电镜】,属于分析化学。
chem-station在Chem-Station版·诺贝尔化学奖候补List【2017年版】里面也列到了冷冻电镜的开发。然而估计压中的人不多。
有人戏言说“这是一个发给了物理学家的诺贝尔化学奖,奖励他们帮助了生物学家。。。”
玩笑话就不多说了,接下来让我们一起看一下关于冷冻电镜的一些内容。
近年来的hot topic!低温电子显微镜(冷冻电镜)
对于结构生物学的研究目标来说,应该精密解析以蛋白质为代表的生物大分子的三维结构,帮助人们理解一些生命现象并且有效应用来推动社会的进步。而所谓的成果,最直接最明了的应用,也就是医药开发。由于基本上所有的药品都是以与生物体内分子相互作用,以体内的一些蛋白质受体为靶点进行设计的。而如果能够详细了解生物体内的一些蛋白质靶点的结构的话,那么就非常有助于一些新药的设计。
而在原子级别的生物大分子的结构解析的分析手法来说,在早前主要只有两种,X射线单晶衍射(XRD)与核磁共振(NMR)。
但是这种局限也在近年来被慢慢打破,开始出现第三种结构解析法,也就是今日的主角冷冻电镜(Cryo-Electron Microscopy, Cryo-EM)登场了。冷冻电镜作为第三种结构解析法。而其普及速度也是相当迅速,到2016年为止,1000个中就有1个是由电子显微镜解析结构的(下图所示)。
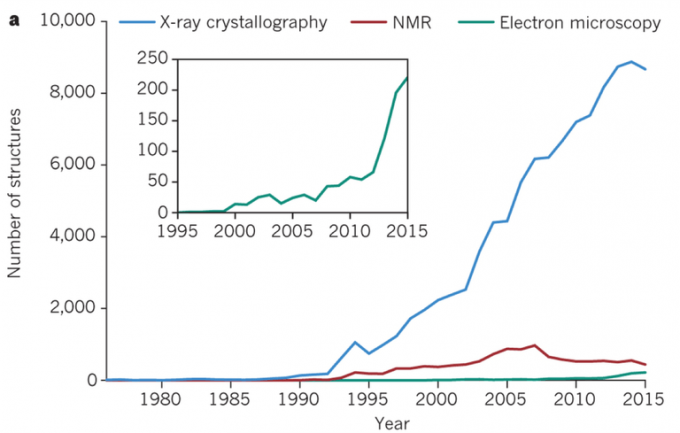 2000年以后,电子显微镜进行的结构解析实例继续发展(引用于[Nature 2016]相关论文)
2000年以后,电子显微镜进行的结构解析实例继续发展(引用于[Nature 2016]相关论文)所以,把sample在极低温・冷冻的状态下测定的话,这一方面的问题就会得到很大程度的解决。
冷冻电镜的优势
冷冻电镜的飞速发展其实是在有一些问题用现有的两种解析法无法解决这样的大环境下实现的。
XRD的问题是,「必须得到化合物的晶体」「必须是均匀的样品」这两个限制。所以对于技术的成熟度要求很高,如果能够得到比较好的晶体,那么基本上就没有什么大的阻碍,能够得到高分辨(1~2Å),清晰的结构图像。
NMR的问题是、「无法直接得到三维结构」「无法解析巨大分子・复合体(>30kDa)」。基本上就是这个原子大概在这个区域,都是一个比较大概的结果。或者确定一些特征局部分子在某个局部区域。而其优点是「可以检测出溶液状态下的结构」「可以追踪分子的动态举动・相互作用」
而冷冻电镜有哪些优点呢?如下所示
- 在冷冻水中,与生物体内环境相近的状态下测定
- 可以解析巨大的蛋白质或复合体
- 在极低温下测定,可以避免电子射线对样品的破坏
- 样品不需要结晶,所以也不需要均匀的样品为前提
- 所需的样品的量极少(浓度在0.1-5.0 M就足够了)
- 可以解析蛋白质的各种区域
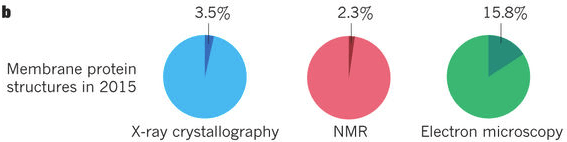
由于上述优点,特别是对结晶化特别困难的膜蛋白的结构解析来说,冷冻电镜具有压倒性的优势,所以自从其发展以来,很多膜蛋白质的结构都是由冷冻电镜解析的。
阻碍冷冻电镜发展的瓶颈
而利用电子显微镜在原子分辨率级别进行结构解析的报道早在1995年就有报道了(可以解析100 kDa以内的大分子)。而为什么到最近不久才飞速发展起来呢?
主要原因是:样品的二维投影图像的对比度非常低。
也就是说由于周围的水分子造成的电子散乱等无法避免干扰的发生。如果使用强电子束,虽然对比度将会变强、然而对于样品的损害也是致命的。所以对样品既不造成损伤,并且也能够顺利解析的电子射线是必要的。在这个前提下,为了得到足够的对比度的成像图,就必须先拿到数千~数万,甚至数十万的投影图像后,再进行平均化。
所以因为上述问题,在利用电子显微镜进行结构解析的研究初期,都是用具有对称性的分子,或者是巨大的复合体(如核糖体和病毒衣壳)为对象进行研究的。但是,在2011年后的五年间,由于硬件/软件的大幅改进,冷冻电镜本身也大大进化了。
首先在硬件方面,电子检测相机性能大大提高了。
2000年代初期使用的电子检测器,对入射电子的检测率只有1/5。而2012年开发出的新型产品,可以提高到1/2。另外加上搭载有连射功能的快速图像捕捉技术,从而大幅降低了干扰。同时,在迅速取得的多个2维投影图像中,选出对比度好的图像进行结构再构成,提高了分辨率。
在软件方面,改进了一种用于恢复二维投影图像的算法。
对于冷冻电镜的样品,都是具有各种结构的蛋白质或者复合体。因此对于这种混合物,通过二维投影图像向三位结构再构成的过程中,要运用一定的算法。而利用统计学对data进行分类的算法在2011年被采用,大幅提高了原子级别的分辨率。
除了以上两点,再加上配备有改良过性能的电子检测相机(2013),即使不是专家也能很容易的利用图像分析算法进行结构解析(2012),因此2014年以后,有很多研究group参入这项领域,从那时候器蛋白质复合体的结构解析的论文就不断增多。其中比较具有年代代表性的是分子量200kDa以下的小蛋白质复合体的结构解析(2015),最大2 Å分辨率的结构解析(2016)。
综上,其实冷冻电镜的发展多亏了近年来机械部品的小型化・高性能化、IT技术的发展。
本次诺贝尔化学奖得主们的业绩
接下来就来看一下三位诺奖得主各自的贡献
Richard Henderson博士的博士研究是X单晶衍射的结构解析。也就是运用X单晶衍射对蛋白质成像。但是上述方法无法用于解析穿透细胞膜的膜蛋白的解析。
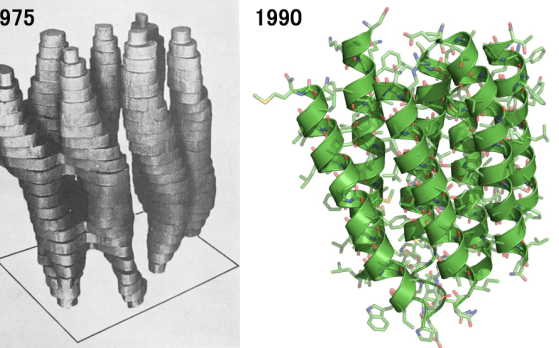
Henderson开发出了将膜蛋白与膜一起放置在电子显微镜中,同时用葡萄糖溶液作为保护液避免干燥,用弱电子束一边照射一边用电子显微镜观察的手法。利用以上方法进行了细菌视紫红质的二维结晶的电子衍射实验工作,虽然最初观测到的是模糊的图像(分辨率7Å),但是从该图像确定了细菌视紫红质是由7个α螺旋结构穿透膜蛋白。15年后,在不断地摸索,改善后,终于首次观测到了原子级别的细菌视紫红质的结构。这是电子显微镜在蛋白质观测,解析领域的最高的成果。并且证明了冷冻电镜与X射线单晶衍射一样,可以达到解像度3Å的成像观测。
该成果揭示出细菌视紫红质膜蛋白在膜中具有相同的排列方向。然而并不是所有的蛋白质都如细菌视紫红质膜蛋白一样的朝向,所以该方法没有一般性。
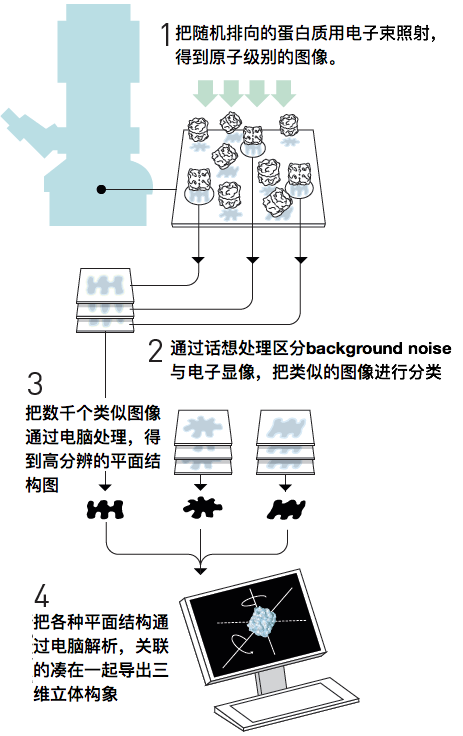
接下来就轮到Frank博士开发的成像解析法登场了。调配样品的过程,蛋白质的朝向是杂乱无序的。先用电子射线照射取得多个二维图像,然后把相似轨迹的高分辨凸显用电脑重建,然后把重建的二维图像的相关性进行计算,重建出三维图像(下图所示)。
也就是说把数千,数万枚凸显通过电脑解析处理,得到“大概就是这样的分子结构模型吧”的结论,这种图像解析的算法被称为单粒子重构法。
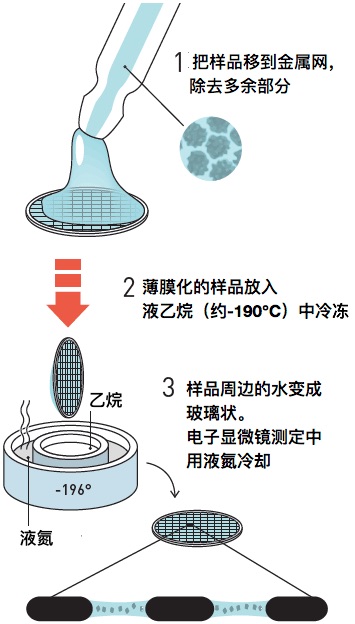
Henderson用葡萄糖溶液防止电子显微镜造成的样品的干燥,而这种方法对于水溶性的蛋白质是不可取的。有很多研究人员把水冻成冰后进行尝试,发现冰的结晶会造成电子束的散乱,无法得到清晰的蛋白质成像图。Dubochet博士提出「不形成冰晶体,做成玻璃台冰包埋样品不就行了?」的设想。Dubochet把含有水分的样品贴在金属网上形成薄膜,扔进被液氮冷却到-190℃的乙烷中,形成非晶体化的「玻璃状的水」。利用该方法制作样品十分简便,也是现在的冷冻电镜的基础,对多种生物体大分子的结构确定起到了巨大贡献。
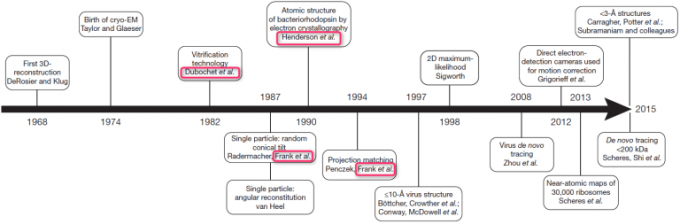
通过观察下图所示的冷冻电镜的发展年表、我们可以清晰的看到这三位诺奖得主做出的巨大贡献。
冷冻电镜存在的一些问题
到目前为止,小编一直在说冷冻电镜的优势,大多事情都具有两面性,而冷冻电镜也一样。其问题是:
很贵!
由于要提供原子级别的分辨率,因此必须使用很高性能的电子显微镜。同时发射电子束时的电压强度与分辨率有直接关系,为了达到原子级别的分辨率,需要200kV的电压。因此好的设备一般需要数千万至上亿人民币。
数据量巨大
1天囤积的数据量就有几个TB,保管上存在很大的问题。另外为了解析这么庞大的数据量,就需要非常高性能的电脑。基本上得用到云计算。
说白了,就是谁钱多。。。谁就用得起。。。
看来这样的冷冻电镜设备并不是所有的研究机构都可以轻松的购买、安装、测定的分析仪器,在今后,冷冻电镜使用的局限性会如何改进,成为一种普及的分析手段,也正是现在该领域的研究者们的兴趣和努力方向。
相关论文
- Rafael Fernandez-Leiro and Sjors H. W. Scheres, “Unravelling biological macromolecules with cryo-electron microscopy.”Nature 2016, 537, 339. doi:10.1038/nature19948
- Eva Nogales, “The development of cryo-EM into a mainstream structural biology technique” Nat. Methods 2016, 13, 24. doi:10.1038/nmeth.3694
- 岩崎憲治,「新時代:クライオ電子顕微鏡による近原子分解能での解析」領域融合レビュー 2016, 5, e010. DOI: 10.7875/leading.author.5.e010
相关书籍
[amazonjs asin=”B01LAT0SME” locale=”JP” title=”The Resolution Revolution: Recent Advances In cryoEM (Methods in Enzymology)”]
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!






















No comments yet.