概要
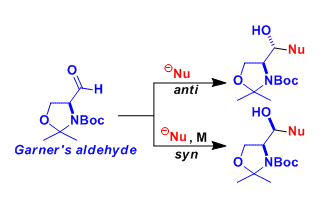
Garner醛可以从L-丝氨酸或者D-丝氨酸这两个镜像异构体大量制备,同时市面上也有出售。 氨基醛的α位在多数情况下比较容易发生拔氢差向异构化,所以很难得到具有光学活性的产物。而Garner醛则很难进行差向异构,可以保持稳定的手性构造。 Garner醛的亲核加成反应可以得到很高的非対映选择性。选择性可以通过Felkin-Anh模型或者螯合模型进行预测。由于生成了连续取代的含有手性碳的光学活性氨基醇产物,该产物作为chiral building block使用,用途很广。
基本文献
- Garner, P. Tetrahedron Lett. 1984, 25, 5855. doi:10.1016/S0040-4039(01)81703-2
- Garner, P.; Ramakanth, S. J. Org. Chem. 1986, 51, 2609. DOI: 10.1021/jo00363a044
- Garner, P.; Park, J. M.; Malecki, E. J. Org. Chem. 1988, 53, 4395. DOI: 10.1021/jo00253a039
- Garner, P.; Park, J. M. Org. Synth. 1991, 70, 18.
- Review: Liang, X.; Andersch, J.; Bols, M. J. Chem. Soc., Perkin Trans. 1 2001, 2136, DOI:10.1039/b101054i
反应机理
选择性可以根据Felkin-Anh模型或者螯合模型进行预测。 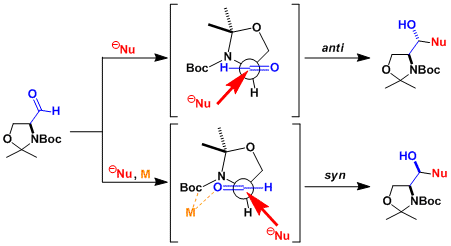
反应实例
实验步骤
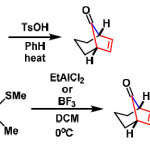
Garner醛的制备方法[1] 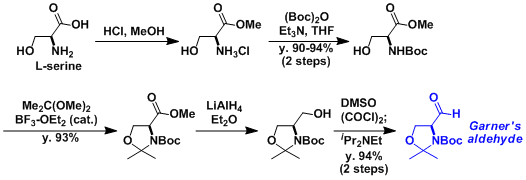 ※Garner自己首次报道的制备方法(Org. Synth., 1991)再现性比较差,而且光学纯度比较低下,上述的方法是McKillop等人的改良法。 ※Swern氧化的碱处理这里利用了Hünig Base。如果用三乙胺处理的话光学纯度会降到80%ee。
※Garner自己首次报道的制备方法(Org. Synth., 1991)再现性比较差,而且光学纯度比较低下,上述的方法是McKillop等人的改良法。 ※Swern氧化的碱处理这里利用了Hünig Base。如果用三乙胺处理的话光学纯度会降到80%ee。
实验技巧
















No comments yet.