本文作者:Summer
导读
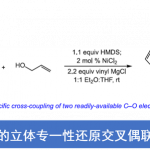
南开大学的王晓晨课题组开发出新的五氟苯基取代的双功能手性硼烷 (bifunctional chiral borane)催化剂,并通过该催化剂成功实现1,2-二氢喹啉与炔酮之间的不对称氢转移/[2+2]环加成串联反应方法学。该方法学为首例通过Lewis酸催化的富电子烯胺与缺电子的炔基化合物之间的不对称[2+2]环加成反应。
Bifunctional Borane Catalysis of a HydrideTransfer/Enantioselective [2+2] Cycloaddition Cascade
M. Zhang, X. Wang, Angew. Chem. Int. Ed. Early view. doi: 10.1002/anie.202106168.
正文
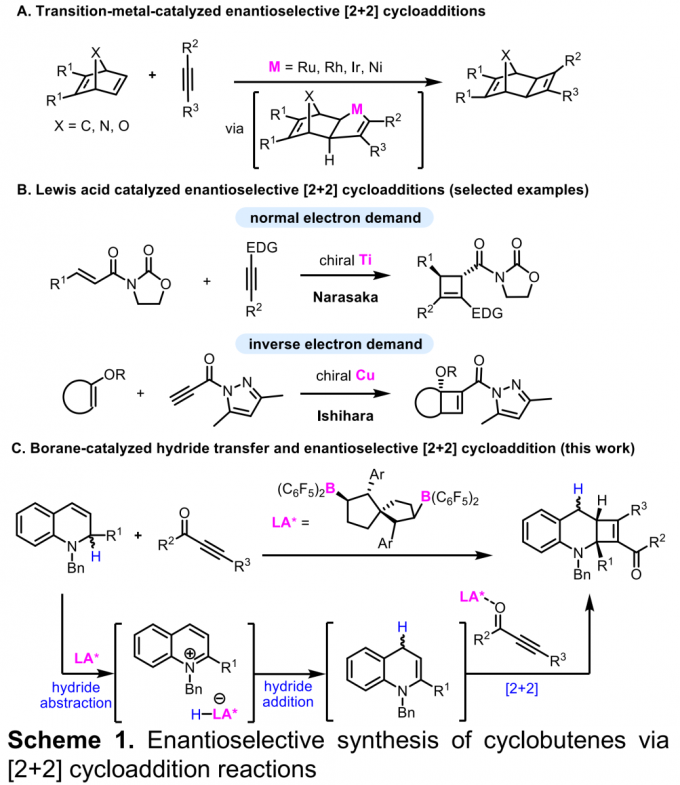
手性环丁烯骨架广泛存在于天然产物与药物分子中,因此,手性环丁烯类化合物的合成备受化学家的广泛关注。炔烃与烯烃之间的对映选择性[2+2]环加成反应方法学是合成手性环丁烯类化合物最为直接有效的方法之一。在过渡金属催化的 [2+2]环加成反应方法学中通常涉及烯/炔氧化偶联 (alkene/alkyne oxidative coupling) 的连续过程与还原消除过程。然而,对映选择性[2+2]环加成方法学的实例均局限于降冰片烯 (norbornene)、降冰片二烯 (norbornadiene)、氮杂或氧杂桥环烯烃 (aza- or oxa-bridged cyclic olefins)等具有高度环张力的烯烃 (Scheme 1A) [1]。同时,研究发现,采用Lewis酸同样能够有效地参与炔烃与烯烃之间的[2+2]环加成反应[2]。然而,Lewis酸参与的对映选择性 [2+2]环加成方法学极少有文献报道。并且,多数情况下,需要底物能够与Lewis酸形成双齿配合物 (Scheme 1B) [3]。而且,目前为止,仅有一篇涉及相关底物与Lewis酸之间形成单齿配合物的对映选择性 [2+2]环加成方法学的文献报道[4]。基于上述研究报道,南开大学的王晓晨课题组开发出通过五氟苯基取代的双功能手性硼烷 (bifunctional chiral borane)催化剂参与的1,2-二氢喹啉与炔酮之间的不对称氢转移/[2+2]环加成串联反应方法学 (Scheme 1C)。该方法学为首例通过Lewis酸催化的富电子烯胺与缺电子炔基化合物之间的不对称[2+2]环加成反应。其反应机理涉及:首先,1,2-二氢喹啉通过氢转移过程,形成1,4-二氢喹啉,接下来,通过与Lewis酸的单齿配位过程,活化炔酮底物,随后,活化的炔酮再与1,4-二氢喹啉发生相应的[2+2]环加成反应。
(图片来源:Angew. Chem. Int. Ed.)
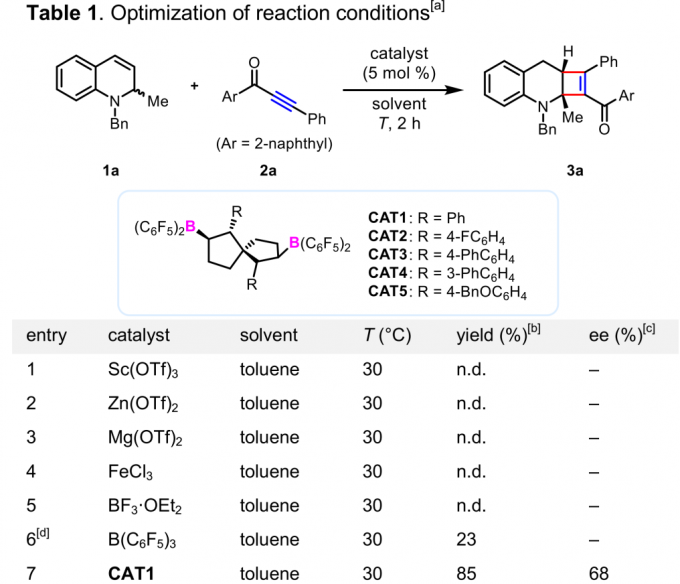
首先,作者采用1,2-二氢喹啉1a与炔酮2a作为模板底物,通过对催化剂、溶剂以及反应温度等条件进行筛选,确定最佳反应条件 (Table 1)为:采用5mol% CAT5作为催化剂,50 mg 4Å分子筛作为添加剂,CHCl3作为反应溶剂,反应温度为0 °C,反应时间为2 h,最终,以92%的收率与93%的对映选择性获得相应产物3a。
(图片来源:Angew. Chem. Int. Ed.)
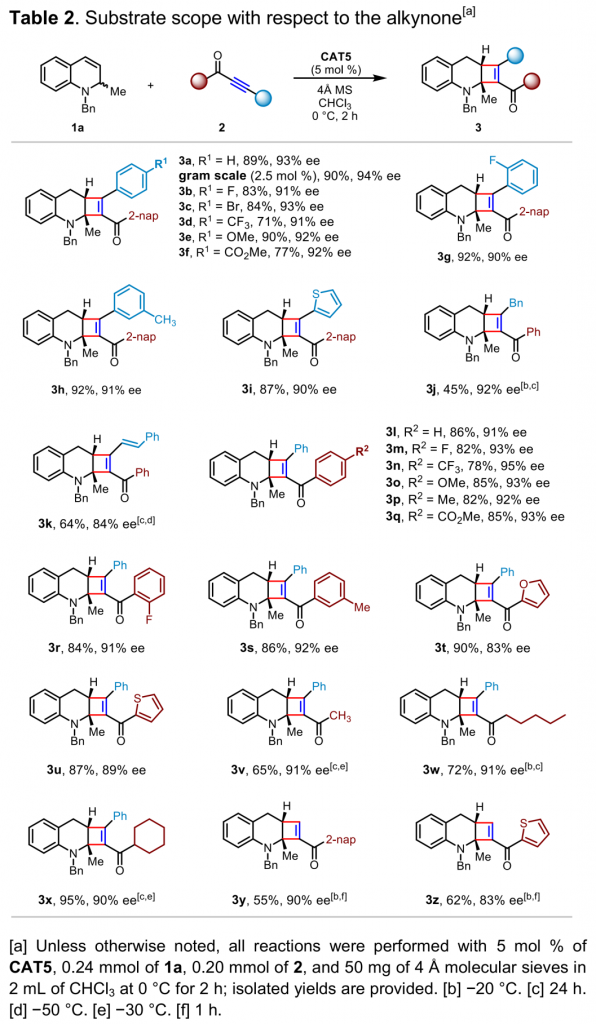
在上述的最佳反应条件下,作者对炔酮的底物适用范围 (Table 2) 进行考察。研究表明,炔酮底物的炔基部分连接有噻吩基以及各类带有吸电子基或供电子基取代的苯基时,均能够与上述反应条件良好地兼容,并以良好至优秀的收率与对映选择性获得相应产物。而炔酮底物的羰基部分连接有各类带有吸电子基或供电子基取代的芳基与杂芳基以及烷基时,同样能够观察到良好至优秀的收率与对映选择性。此外,上述反应条件对于末端炔酮底物同样能够较好地兼容。同时,该小组在1,2-二氢喹啉1a与炔酮2a的克级规模实验中进一步发现,仅采用2.5 mol %的催化剂,同样能够获得优良的产率与对映选择性。
(图片来源:Angew. Chem. Int. Ed.)
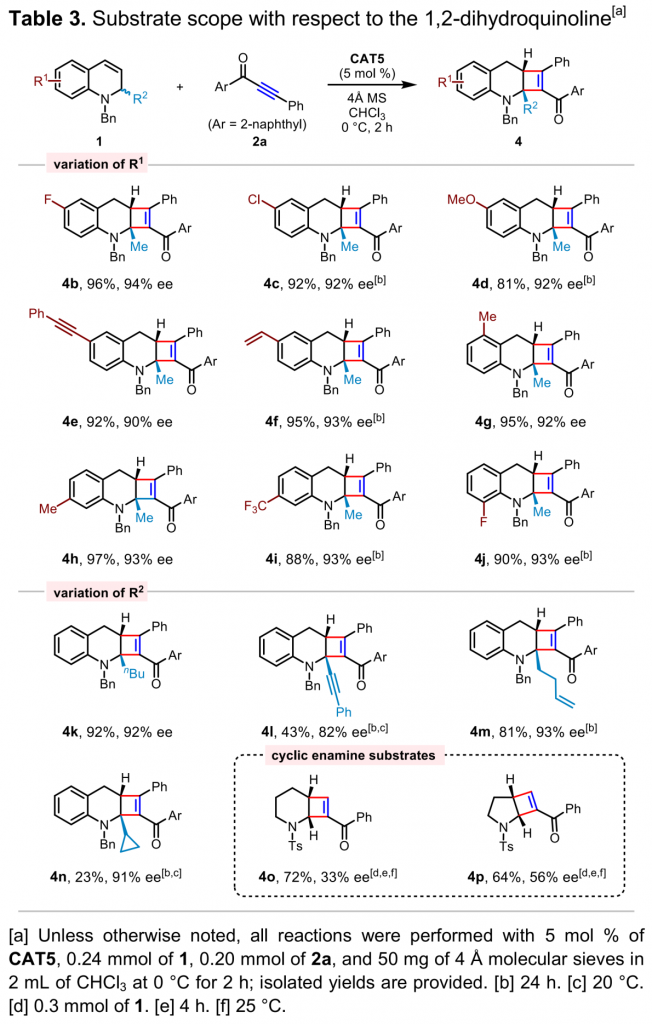
接下来,作者对1,2-二氢喹啉的底物应用范围进行考察 (Table 3)。研究发现,各种芳基取代基、苯乙炔基、乙烯基等基团取代的1,2-二氢喹啉均能够与上述最佳反应条件良好的兼容,并能够以良好至优秀的收率与对映选择性获得相应产物。同时,该小组进一步考察1,2-二氢喹啉底物中R2基团的影响。研究发现, R2基团为正丁基与高烯丙基时,反应同样能够有效地进行,并以良好的收率与优秀的对映选择性获得相应产物。而2-炔基取代的1,2-二氢喹啉则只能够以中等程度的反应收率与对映选择性获得相应产物。对于2-环丙基取代的1,2-二氢喹啉底物,产物收率较低,然而却能够获得较高的对映选择性。此外,作者发现,3-或4-取代的1,2-二氢喹啉底物在上述条件下,反应受到较大程度的抑制,无法有效地参与上述反应或仅能够检测出痕量的目标产物。随后,作者进一步考察六元与五元环烯胺底物的适用性,结果发现上述底物在该条件下,均无法获得良好的的对映选择性。
(图片来源:Angew. Chem. Int. Ed.)
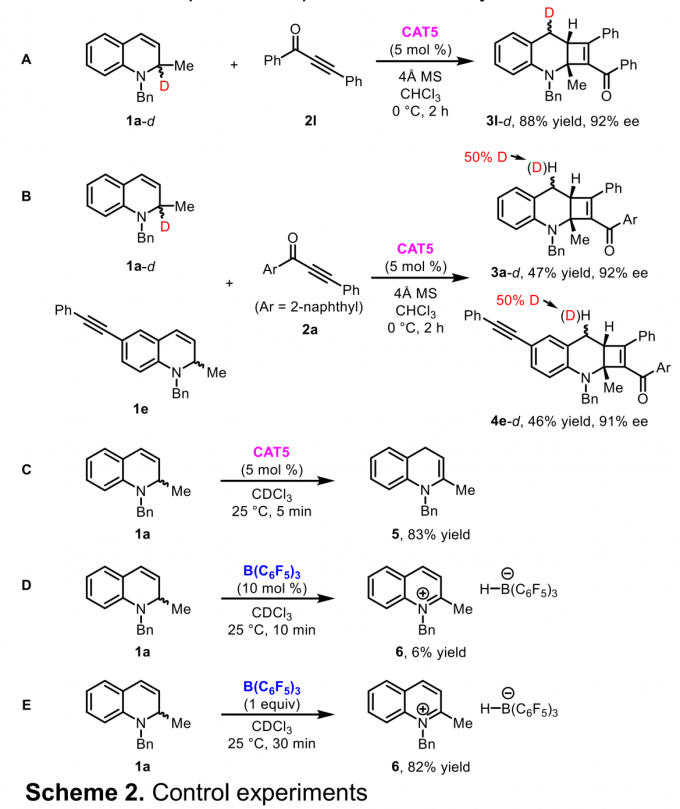
为阐明合理的反应机理,作者进行一系列相应的控制实验与竞争实验 (Scheme 2)。研究发现,在上述的最佳反应条件下,2-氘标记的1,2-二氢喹啉 (1a–d)与2l的反应,最终能够获得4-氘标记的N-杂环化合物3l–d (Scheme 2A)。这一结果表明在环加成过程进行之前,需要首先进行氢转移过程。同时,3l–d 中4-氘基团的绝对构型存在立体化学置乱 (stereochemical scrambling),这表明在氢转移过程中无法实现良好的对映选择性控制。接下来,在1a–d与1e的竞争实验中,作者发现氘在两种产物3a–d与4ed中平均分配 (Scheme 2B)。这一事实表明氢转移过程为分子间反应过程。同时,该小组进一步观察到,将1a与CAT5在氘代氯仿作为反应溶剂的条件下,5 min后,能够以83%的收率获得1,4-二氢喹啉5 (Scheme 2C),同时,能够观察到该反应过程中伴随剩余起始原料的分解。之后,该小组在10 mol % B(C6F5)3与1a的反应中发现,仅能够检测出6%收率的硼氢化喹啉 (quinolinium borohydride) 中间体6 与未反应的起始原料 (Scheme 2D),并未检测出氢转移产物。而将B(C6F5)3的用量增加至1.0 eq时,在30 min 后,便能够获得82%收率的硼氢化喹啉6 (Scheme 2E)。综上结果表明,手性硼烷能够有效地促进氢转移过程的进行,而B(C6F5)3仅能够有效地参与攫氢过程,而无法参与加氢过程 (hydride addition)。
(图片来源:Angew. Chem. Int. Ed.)
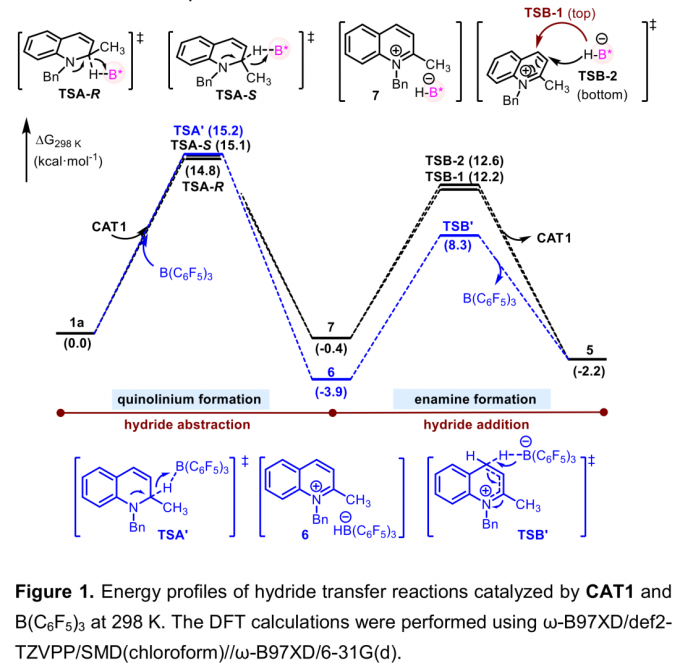
同时,作者通过DFT计算进一步支持上述机理假设,并进一步对反应过程中控制对映选择性的关键因素进行阐述 (Figure 1)。
(图片来源:Angew. Chem. Int. Ed.)
小结
南开大学王晓晨课题组开发出新型的五氟苯基取代的双功能手性硼烷催化剂,并通过该催化剂顺利完成1,2-二氢喹啉与炔酮之间的不对称氢转移/[2+2]环加成串联反应方法学。该方法学是富电子烯胺与缺电子炔基化合物之间不对称[2+2]环加成反应方法学的首例报道。
参考文献
- a) A. Misale, S. Niyomchon, N. Maulide, Chem. Res. 2016, 49, 2444. doi: 10.1021/acs.accounts.6b00375.b) Y. Xu, M. L. Conner, M. K. Brown, Chem. Int. Ed. 2015, 54, 11918.doi: 10.1002/anie.201502815.c) E. Lee-Ruff, G. Mladenova, Rev. 2003,103, 1449.doi: 10.1021/cr010013a.
- a) L. Shen, K. Zhao, K. Doitomi, R. Ganguly, Y.-X. Li, Z.Shen, H. Hirao, T. Loh, Am. Chem. Soc. 2017, 139, 13570. doi: 10.1021/jacs.7b07997.b) K. Okamoto, T. Shimbayashi, E. Tamura, K. Ohe, Lett. 2015, 17, 5843.doi: 10.1021/acs.orglett.5b03065.c) H. Li, R. P. Hsung, K. A. DeKorver, Y. Wei, Lett. 2010, 12, 3780.doi: 10.1021/ol101418d.d) R. F. Sweis, M. P. Schramm, S. A.Kozmin, Am. Chem. Soc. 2004, 126, 7442. doi: 10.1021/ja048251l.
- a) C. Schotes, A. Mezzetti, Chem. Int. Ed. 2011, 50, 3072. doi: 10.1002/anie.201007753.b) K. Ishihara, M.Fushimi, Am. Chem. Soc.2008, 130, 7532. doi: 10.1021/ja8015318.c) Enomoto, H. Oyama, M. Nakada, Chem.–Eur. J. 2015, 21, 2798.doi: 10.1002/chem.201406189.d) Y. Takenaka, H.Ito, M. Hasegawa, K. Iguchi, Tetrahedron 2006, 62,3380. doi: 1016/j.tet.2006.01.050.e) K. Narasaka, Y. Hayashi, H. Shimadzu, S. Niihata, Am. Chem. Soc. 1992,114, 8869. doi: 10.1021/ja00049a020.
- Kang, S. Ge, L. Lin, Y. Lu, X. Liu, X. Feng,Angew. Chem. Int. Ed. 2016, 55, 5541. doi: 10.1002/anie.201600801.

















No comments yet.