- 概要
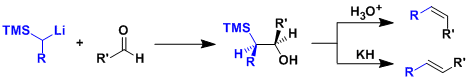
α-硅基碳负离子与醛或者酮羰基亲核加成形成的中间体在酸性或者碱性条件下脱去硅烷醇,总的来说就是一个羰基转换成烯烃的反应。硅烷醇的离去是具有立体特异性的,酸性条件和碱性条件得到的立体构型是互逆的。
另外,相比于Wittig反应,该反应具有α-硅基碳负离子的反应性很高,以及离去物硅烷醇挥发性好,容易除去的两大优势。
- 基本文献
・Peterson, D. J. J. Org. Chem. 1968, 33, 780. DOI: 10.1021/jo01266a061
・Ager, D. J. Synthesis 1984, 384.
・Ager, D. J. Org. React. 1990, 38, 1.
・Kelly, S. E. Comp. Org. Syn. 1991, 1, 731 & 782.
・van Staden, L. F.; Gravestock, D.; Ager, D. j. Chem. Soc. Rev. 2002, 31, 195. DOI: 10.1039/A908402I
- 反应机理
硅烷醇的离去是具有立体特异性的,根据条件的不同得到的产物构型也不同。酸性跳进下,羟基质子化后,硅烷醇进行反式消除离去。另一方面,如果是在碱性条件下的话,醇化物分子内进攻硅烷基,硅烷醇顺式离去。根据上述机理,在不同条件得到两个相反构型的烯烃产物。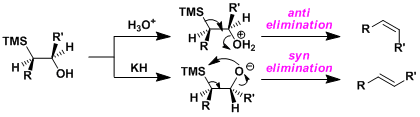
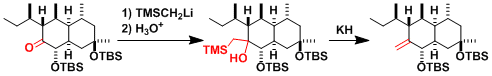
- 实验步骤
- 参考文献