本文作者:孙苏赟
第四部分 Katsuki-Jacobsen不对称环氧化(Jacobsen AE)
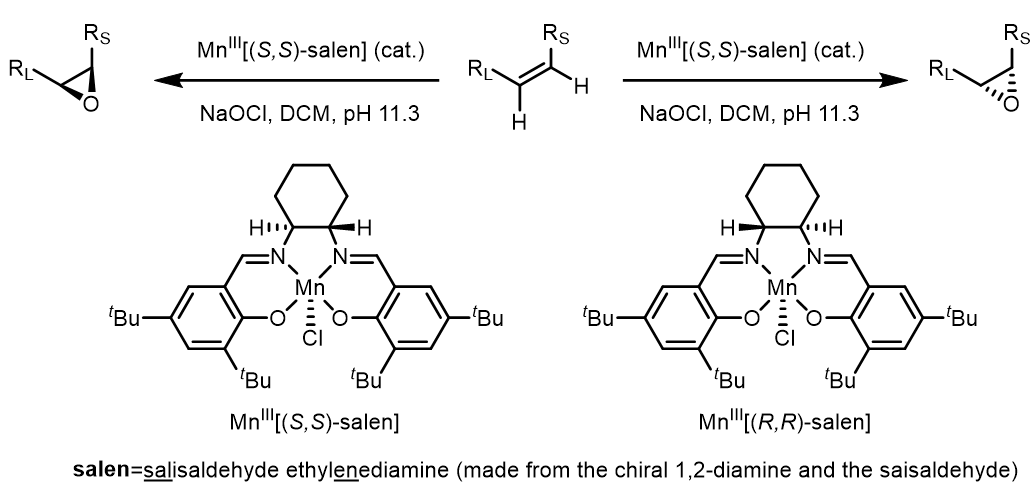
Katsuki-Jacobsen不对称环氧化使用的手性salen类配体和锰的配合物对烯烃进行环氧化,常用的氧化剂有NaOCl,和高价碘试剂,例如PhI(OAc)2,等:
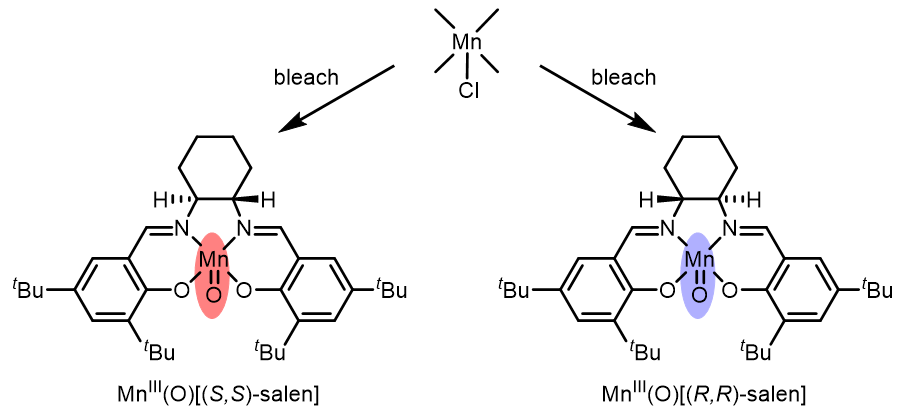
MnIII[(S,S/R,R)-salen]只是预催化剂,真正的催化剂是MnIV(O)配合物,NaOCl是化学计量使用的氧化剂:
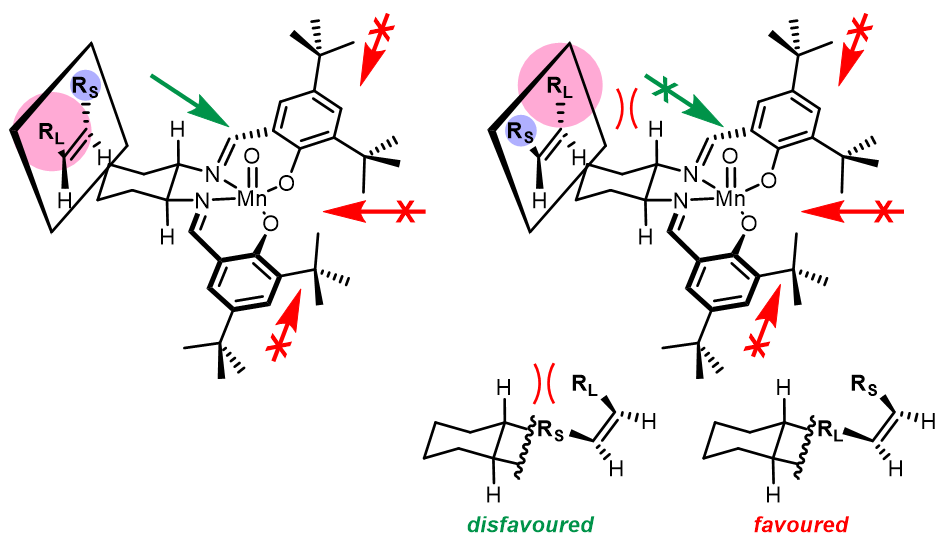
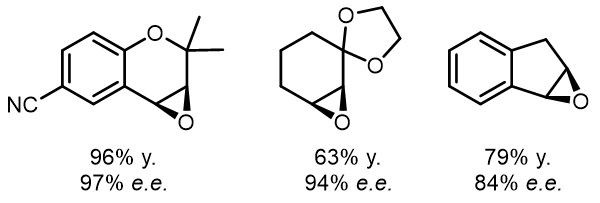
这里值得注意的是,一般只限和顺式-1,2-二取代的双键反应,这也是其很大的一个局限。反应的立体面选择性是由配体的的影响造成的,其中叔丁基非常重要的大位阻基团,由于叔丁基的作用,烯烃不能从侧边靠近氧化剂,而只可能从前后方靠近,然而由于手性二胺的作用而控制了从底物只可以从配合物的后方靠近,其中二胺的构型决定了反应的实际面选择性,且使得反式烯烃很难参与该反应:
例如[1]:
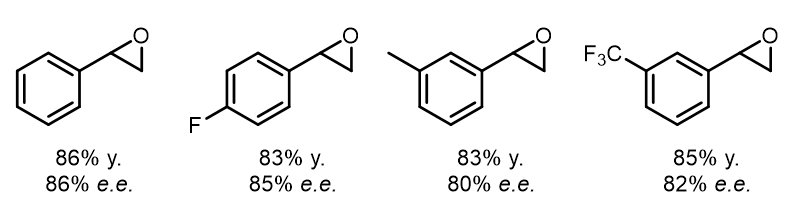
端位双键的立体选择性大大降低:
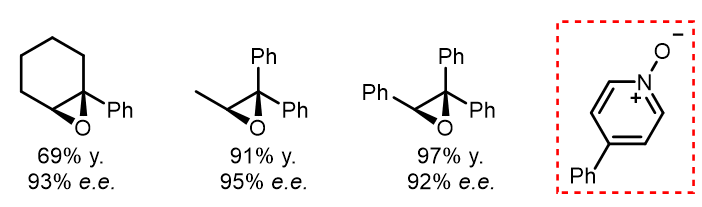
但如过在反应中添加4-苯基吡啶氧化物,可以提高立体选择性,甚至可以使得反应在三取代的大位阻双键上发生很好的立体选择性环氧化:
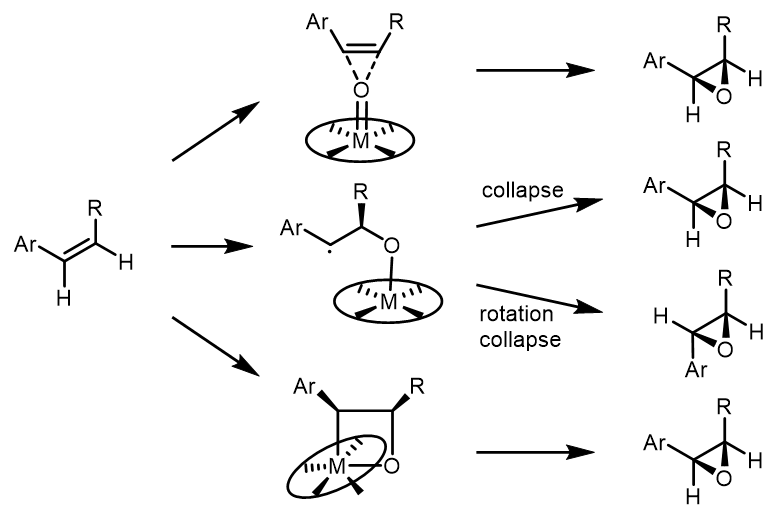
关于反应的机理,目前尚有争议。主流的是有协同机理、自由基分步机理和环加成机理:
此外,Jacobsen的salen配体类催化剂从发明至今有多次的改进,并且在合成中展现了多种应用,这里是水解开环和叠氮化开环的两个应用:
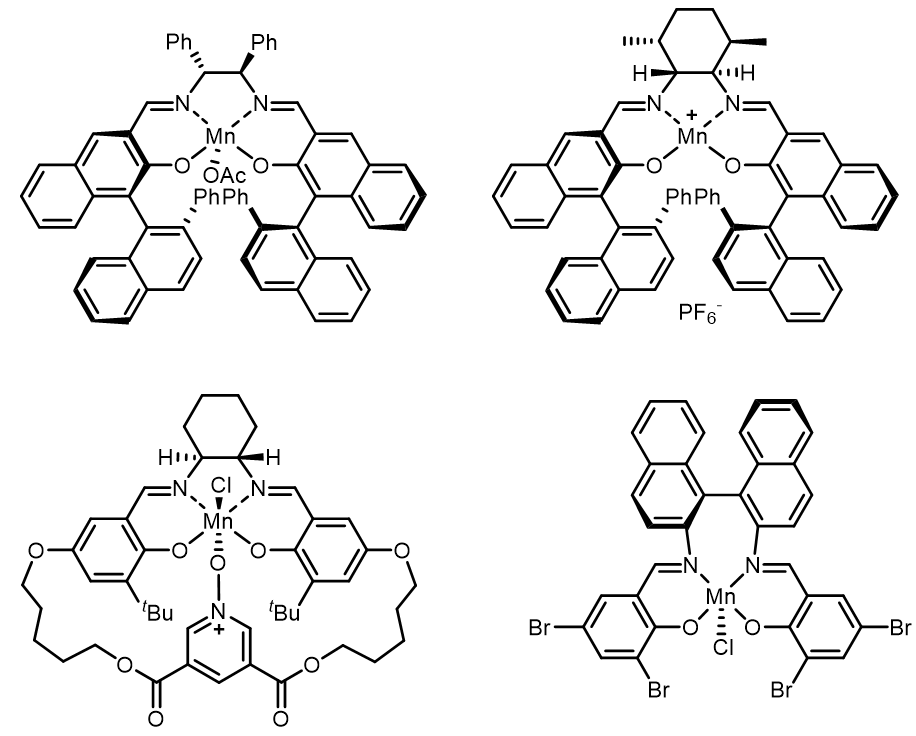
(1) 配体的改进[2]:
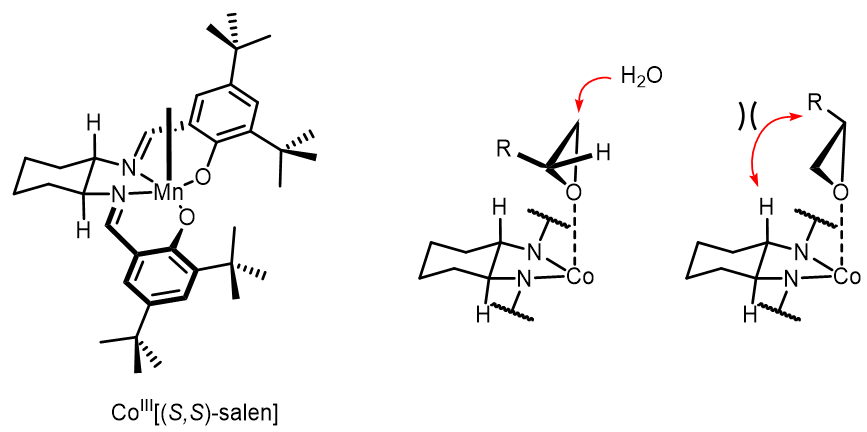
引入不同的手性基团和增强其立体选择性,同时中心金属的不同电子密度可以使得此类催化剂可以适用于多种不同活性的底物。
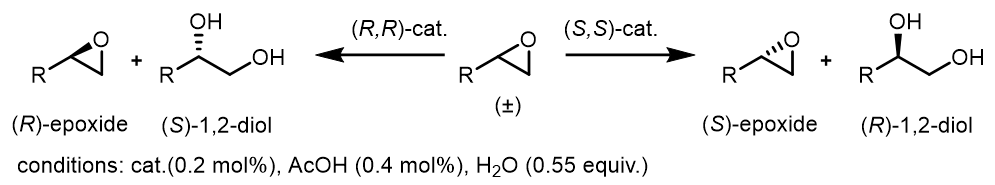
(2) Co(III)催化的环氧化物水解开环动力学拆分(Hydrolytic kinetic resolution, HKR)
反应中加入水和醋酸是为了原位生成Co(III)物种:
一个例子[3]:
反应中的两个产物非常容易分离,可以轻易达到动力学拆分的目的。
反应的过程中,Co(III)可能会和产物环氧化物发生配合,然而只有R-环氧化物可以顺利在(S,S)-salen配体下发生这个过程,其对映异构体S-环氧化物无法参与其中去,因此造成了反应速率上的差异:
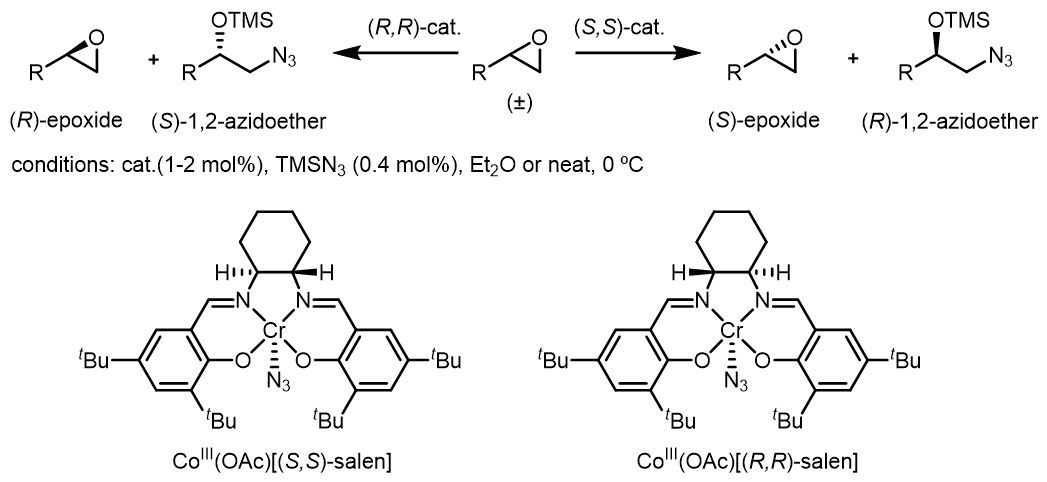
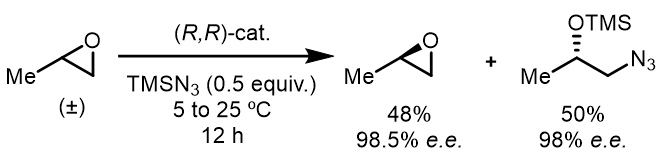
(3) Cr(III)催化的环氧化物叠氮化开环动力学拆分
例如[4]:
反应后处理,可以简单通过蒸发沸点较低的环氧化物而得到。
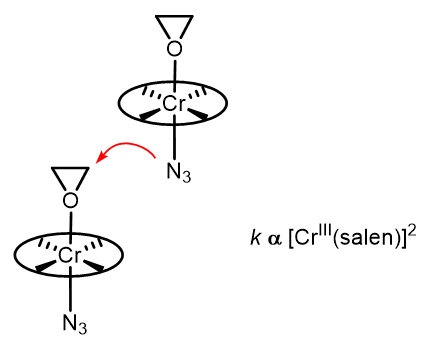
反应中的立体化学部分和HKR类似,但是反应的动力学研究发现反应速率是一个依Cr(III)浓度的二级反应。反应中最关键的是Cr(III)活化作用下的开环过程,其过程经历“头碰脚”的过渡态:jacs 1998 10780
References
- [1] Angew. Chem. Int. Ed. 1997, 36, 2060. Doi: 10.1002/anie.199720601
- [2] (a) Science 1997, 277, 936. DOI: 10.1126/science.277.5328.936. (b) J. Am. Chem. Soc. 2002, 124, 1307-1315. Doi: 10.1021/ja016737l. (c) J. Org. Chem. 1998, 63, 4876-4877. Doi: 10.1021/jo9810765. (d) Chem. Rev. 2005, 105, 1563-1602. Doi: 10.1021/cr0306945
- [3] Angew. Chem. Int. Ed . 2002, 41, 1374. Doi: 10.1002/1521-3773(20020415)41:8<1374::AID-ANIE1374>3.0.CO;2-8
- [4] J. Am. Chem. Soc. 1996, 118, 7420-7421. Doi: 10.1021/ja961708+
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!























No comments yet.