概要
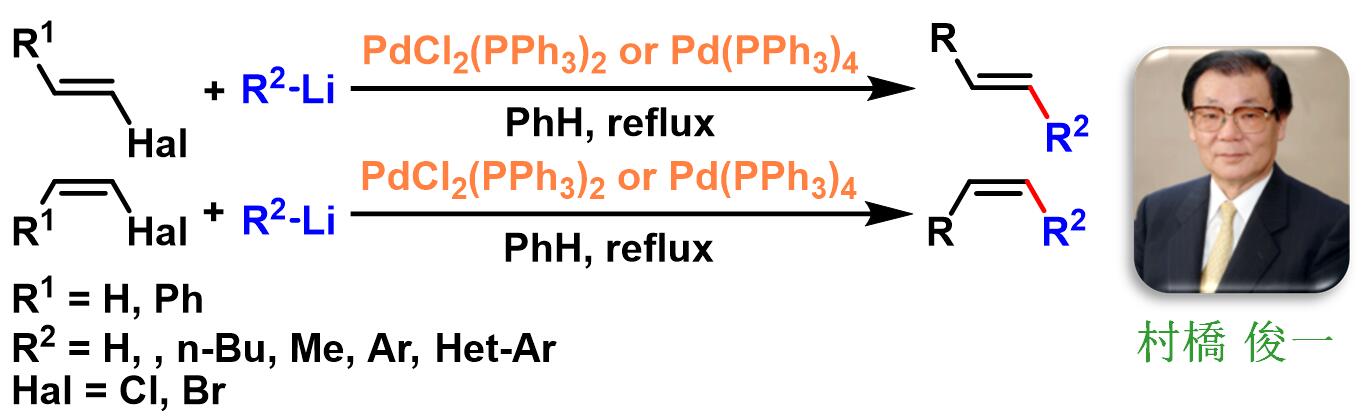
1975年,日本大阪大学应用化学系工学院 (大阪大学工学部応用精密化学科, Department of Applied Chemistry, Faculty of Engineering, Osaka University)的村桥俊一 (村橋 俊一, Murahashi Shun-ichi)研究室报道了钯催化剂采用的卤代烯烃与烷基锂试剂进行的交叉偶联反应,研究发现反应具有优良的立体选择性,卤代烯烃构型完全保持[1]。
1979年,Murahashi进一步将锂试剂扩展至芳基与杂芳基锂,并将底物扩展至与芳基共轭的卤代烯[2],同样具有优良的立体选择性。
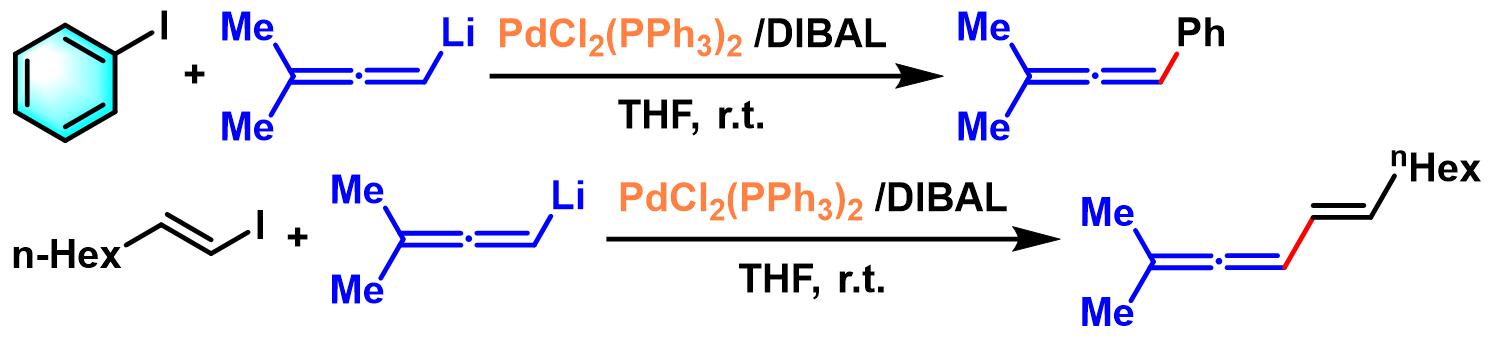
1982年,G. Linstrumelle将该反应条件应用于联烯基锂,成功实现联烯基锂的乙烯基化与芳基化[3]-[4]。
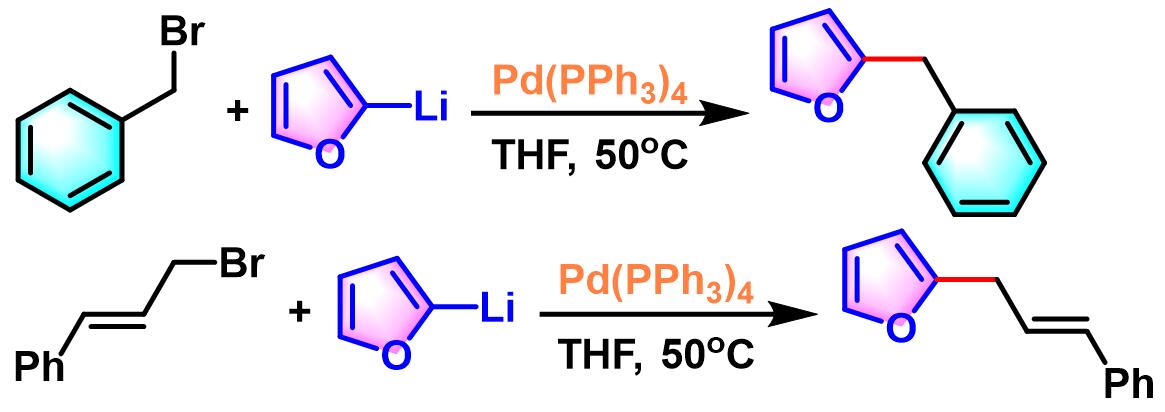
1987年,Pelter成功将Murahashi的反应条件扩展至苄基与肉桂基卤代烷[5],并获得良好的产率。
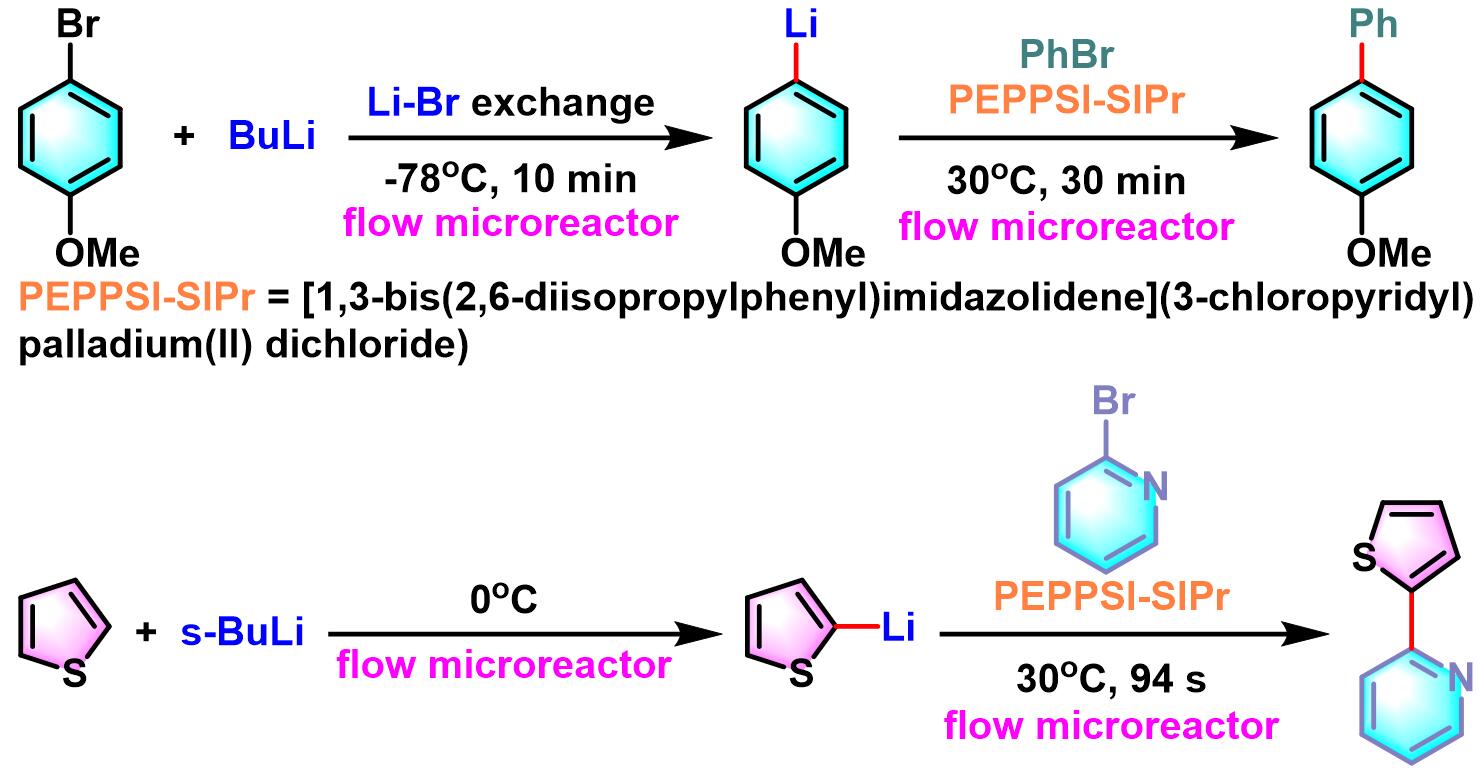
虽然上述反应条件具有广泛的底物适用范围与较高的产率。然而,部分底物在该条件下反应较慢,需要较高的温度、过量的有机锂试剂及较长的反应时间。同时,由于锂试剂较高的反应活性,反应过程中还会出现卤代烃之间的同偶联副反应及锂-卤素交换过程快于交叉偶联反应的问题。因此,无法适应大规模的实验室合成研究及工业生产。2010年,Yoshida课题组采用流动型微反应器 (flow microreactor)将Li-Br交换与Murahashi偶联成功结合,顺利完成了两种不同芳卤间的交叉偶联,获得较高的产率,并使反应时间极大缩短[6]。同时,有效避免了同种芳卤间的同偶联反应。
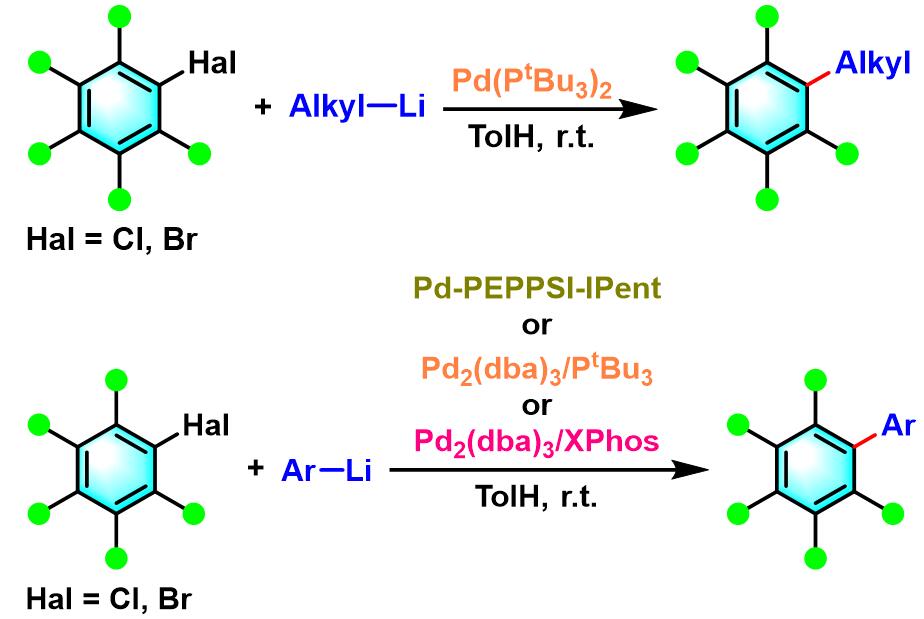
2013年,Feringa采用双(三叔丁基膦)合钯(II)或Pd-PEPPSI-IPent、Pd2(dba)3/三叔丁基膦及Pd2(dba)3/XPhos催化剂,成功将底物范围扩展至更多的芳卤及稠环芳卤,反应条件温和,反应时间有效缩短,同样避免了锂-卤素交换及同偶联等副反应。具有更为广泛的底物适用范围及优良的反应选择性与官能团兼容性,甚至连接有容易与锂试剂发生亲核反应的酮羰基、氰基及烷氧羰基官能团相关的底物,均可在该条件下顺利完成相应的交叉偶联[7]-[8]。
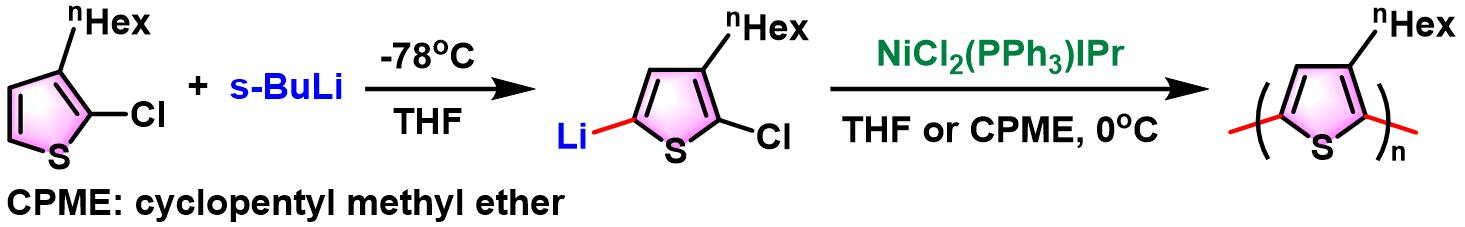
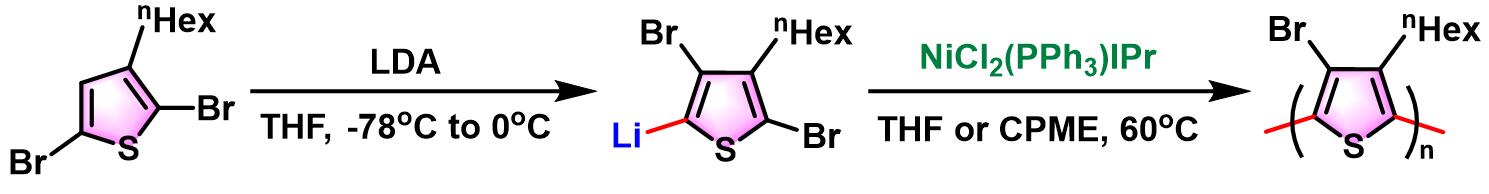
之后,Mori采用Ni(II)-NHC催化剂,实现了Murahashi偶联聚合 (Murahashicoupling polymerization),将该反应成功应用于π-共轭聚合物 (π-conjugatedpolymers)的合成[9]。
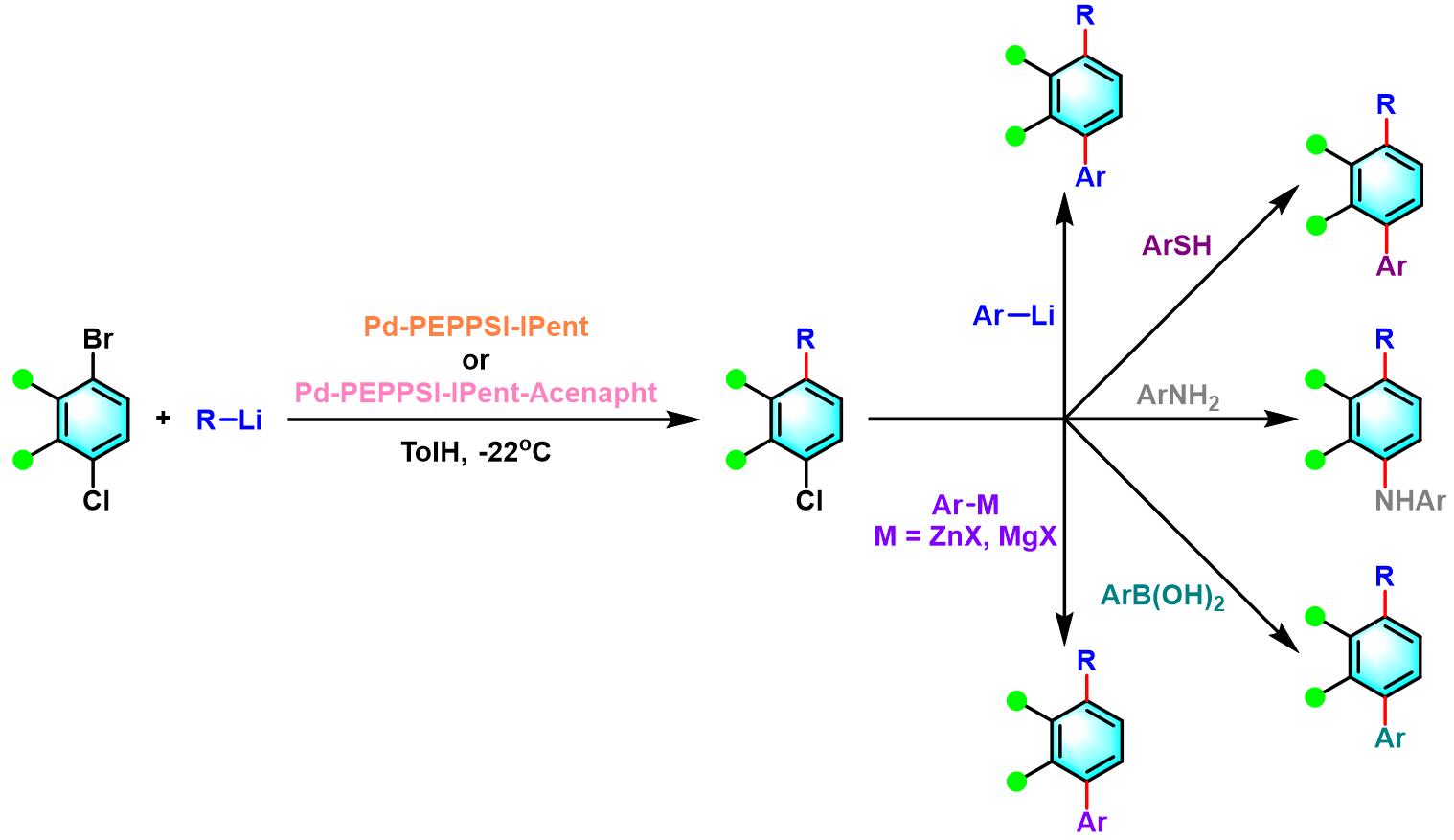
2019年,Feringa与Organ在深冷温度下 (cryogenic temperatures)下,采用反应活性更高的Pd-NHC催化剂,通过温度依赖的化学选择性引发策略 (temperature-dependent chemoselectivity trigger),成功实现氯代芳基溴 (芳基氯在该条件下无法参与偶联过程)的化学选择性交叉偶联[10]。同时,研究发现含有芳基氯官能团的偶联产物可以在一锅条件下完成多种后续的二级偶联过程,如Suzuki-Miyaura反应、Negishi反应及Buchwald-Hartwig反应等。
文献中将上述钯催化的卤代烃与有机锂试剂之间的交叉偶联反应称为Murahashi偶联反应 (Murahashi coupling)或Murahashi交叉偶联反应 (Murahashi cross-coupling)。该反应具有广泛的底物适用范围,优良的化学选择性与立体选择性及官能团兼容性。目前,Murahashi偶联反应在有机合成方法学研究、医药及有机材料研究领域具有极为广泛的应用前景。
基本文献
- [1] M. Yamamura, I. Moritani, S. Murahashi, J. Organomet. Chem. 1975, 91, C39. doi: 10.1016/S0022-328X(00)89636-9.
- [2] S. Murahashi, M. Yamamura, K. Yanagisawa, N. Mita, K. Kondo, J. Org. Chem. 1979, 44, 2408. doi: 10.1021/jo01328a016.
- [3] T. Jeffery-Luong, G. Linstrumelle, Synthesis 1982, 738. doi: 10.1055/s-1982-29923.
- [4] S. Murahashi, J. Organomet. Chem. 2002, 653, 27. doi: 10.1016/S0022-328X(02)01167-1.
- [5] A. Pelter, M. Rowlands, G. Clements, Synthesis 1987, 51. doi: 10.1055/s-1987-27840.
- [6] A. Nagaki, A.Kenmoku, Y. Moriwaki, A. Hayashi, J. Yoshida, Angew. Chem. Int. Ed. 2010, 49, 7543. doi:10.1002/anie.201002763.
- [7] M. Giannerini, M. Fañanás-Mastral, B. L. Feringa, Nat. Chem. 2013, 5, 667. doi: 10.1038/nchem.1678.
- [8] V. Hornillos, M. Giannerini, C. Vila, M. Fañanás-Mastral, B. L. Feringa, Org. Lett. 2013, 15, 5114. doi: 10.1021/ol402408v.
- [9] K. Fuji, S. Tamba, K. Shono, A. Sugie, A. Mori, J. Am. Chem. Soc. 2013, 135, 12208. doi: 10.1021/ja406374t.
- [10] N. Sinha, D. Heijnen, B. L. Feringa, M. G. Organ, Chem. Eur. J. 2019, 25, 9180. doi: 10.1002/chem.201901678.
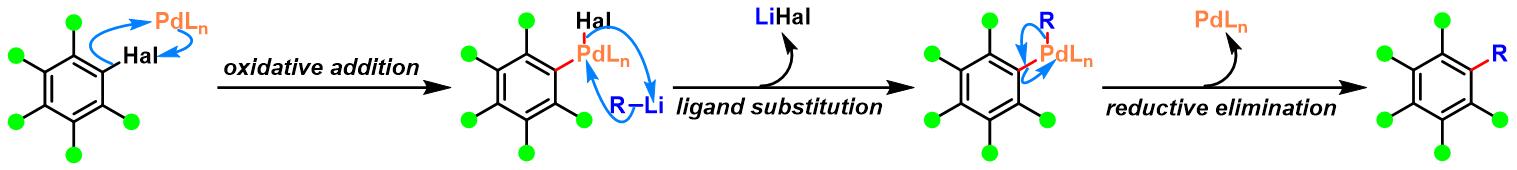
反应机理
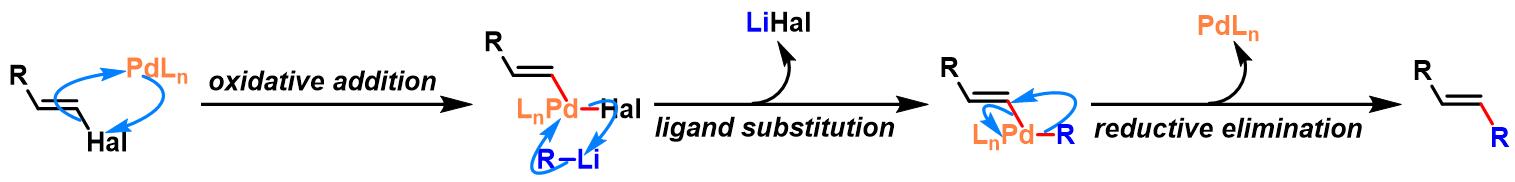
烯基卤参与的Murahashi偶联
芳卤参与的Murahashi偶联
参考文献
- [1] S. Murahashi, M. Yamamura, K. Yanagisawa, N. Mita, K. Kondo, J. Org. Chem. 1979, 44, 2408. doi:10.1021/jo01328a016.
- [2] M. K. Loar, J. K. Stille, J. Am. Chem. Soc. 1981, 103, 4174. doi: 10.1021/ja00404a033.
- [3] C. Amatore, A. Jutland, A. Suarez, J. Am. Chem. Soc. 1993, 115, 9531. doi: 10.1021/ja00074a018.
- [4] C. Amatore, M. Azzabi, A. Jutland, J. Am. Chem. Soc. 1991, 113, 8375. doi: 10.1021/ja00022a026.
反应实例
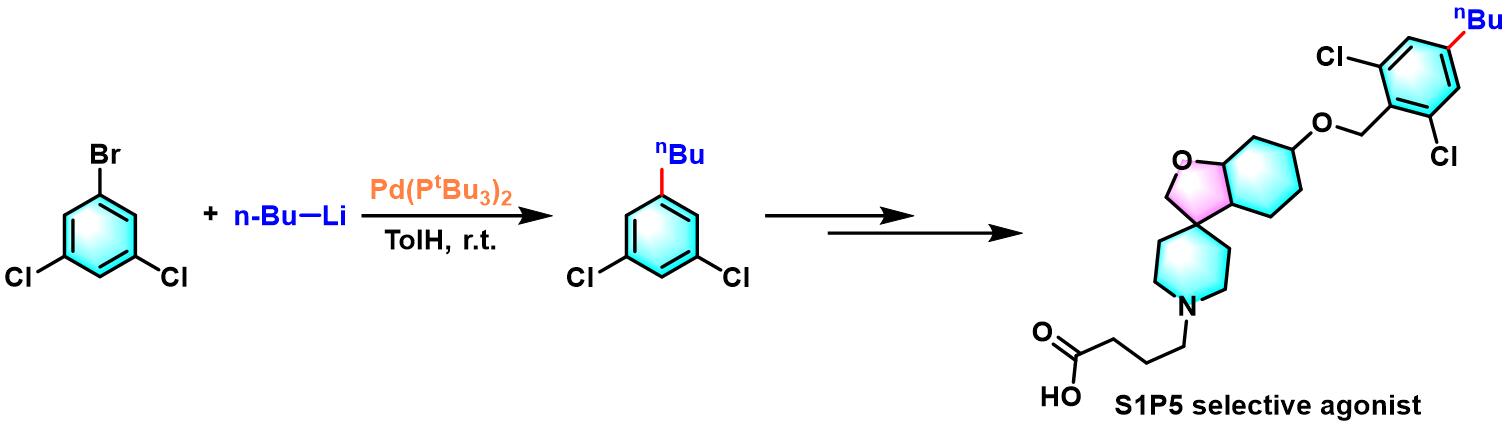
S1P5选择性拮抗剂关键中间体的合成[1]
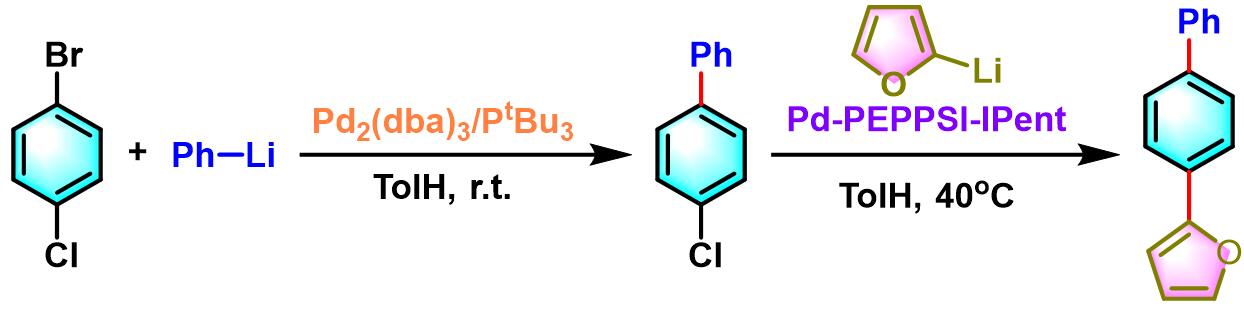
联芳的合成[2]
Murahashi偶联聚合[3]
实验步骤
在氩气气氛下,向干燥的Schlenk瓶内加入Pd(PtBu3)2 (0.05 eq.)与卤代烃 (1 eq.),之后加入无水甲苯溶解 (维持底物浓度为0.15 M)。再将有机锂试剂 (1.2 eq.)加入适量溶剂稀释 (烷基锂试剂,采用无水甲苯稀释至浓度为0.36 M;烷基锂试剂,则采用无水THF稀释至浓度为0.6 M)。随后,通过注射泵缓慢加入 (超过1h后,滴加完毕)。滴加结束后,加入饱和NH4Cl溶液淬灭反应。淬灭完成后,将上述反应液加入乙醚进行萃取,合并有机相,减压除去溶剂。粗产物采用硅胶柱色谱 (根据不同产物,选择正戊烷或正戊烷/乙酸乙酯100:3作为洗脱剂)进行分离纯化,获得最终目标产物。
参考文献
- [1] M. Giannerini, M. Fañanás-Mastral, B. L. Feringa, Nat. Chem. 2013, 5, 667. doi: 10.1038/nchem.1678.
- [2] V. Hornillos, M. Giannerini, C. Vila, M. Fañanás-Mastral, B. L. Feringa, Org. Lett. 2013, 15, 5114. doi: 10.1021/ol402408v.
- [3] K. Fuji, S. Tamba, K. Shono, A. Sugie, A. Mori, J. Am. Chem. Soc. 2013, 135, 12208. doi: 10.1021/ja406374t.
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!


















No comments yet.