投稿作者 孙苏赟
在合成中的应用
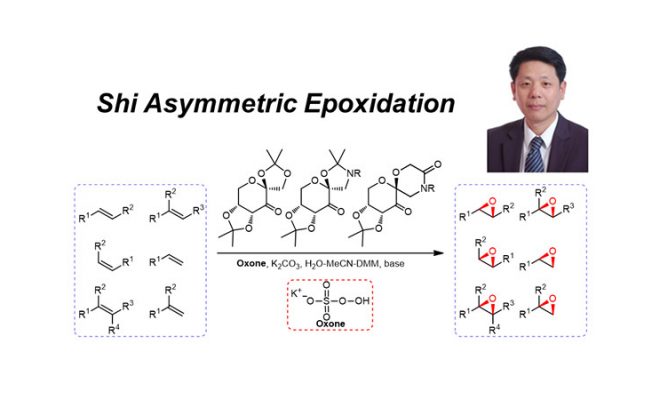
- 手性酮催化剂的选择和史一安环氧化在全合成中的应用
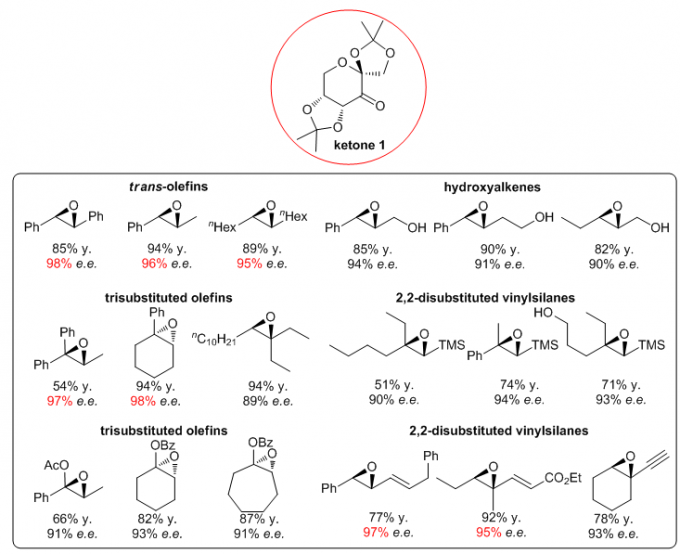
1.1 Ketone 1
Ketone 1是在不对称环氧化反应中最常用的手性酮催化剂。
1.1.1 Ketone 1的反应
1.1.2 Ketone 1在合成上的应用
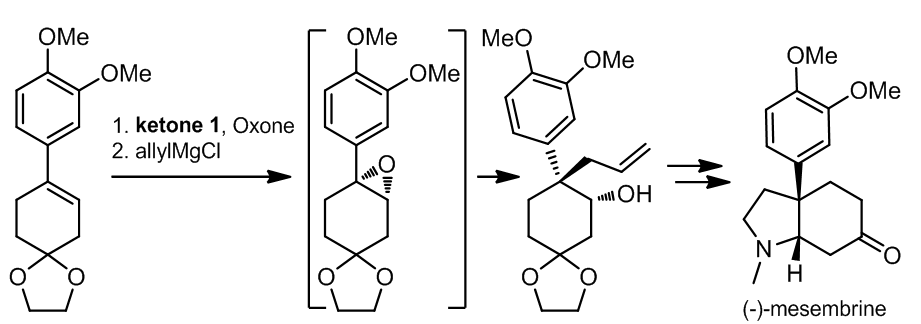
1.1.2.1 (-)-mesembrine的合成
环烷酮很容易通过加入芳基Grignard试剂和环氧化反应,再进行脱水转化为芳基取代的环烯烃1,受此想法的启发,(-)-mesembrine的合成得以以更短的路线完成。
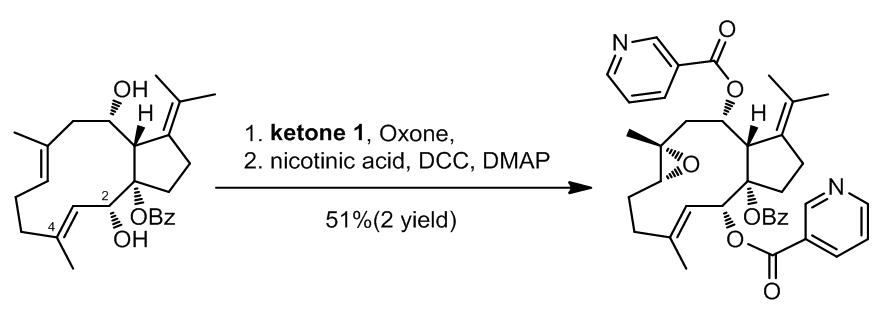
1.1.2.2 ent-(-)-Nigellamine A2的不对称合成
在ent-(-)-Nigellamine A2的不对称合成过程中利用了一步高度选择性的环氧化反应,当用手性酮催化不对称环氧化条件处理该反应物时,实际上在三个反应性双重物之间进行竞争。可能C2-醇可能使C3-C4烯烃失活,并且酮催化剂对该分子中的四取代烯烃不具有反应性,因此,这种单环氧化产物是反应的唯一产物2。
1.1.2.3 ent-Nakorone的仿生合成
为了完成三环化合物nakorone的全合成,合成路线中利用了史一安不对称环氧化来产生多环氧化物分子,之后再进行串联反应构筑三环的分子骨架3。在钯催化的还原脱磺化后,得到的环戊二烯经历了TMSOTf引发的环化过程,随后臭氧分解了丙二烯并脱硅烷化,成功合成了三环目标分子。
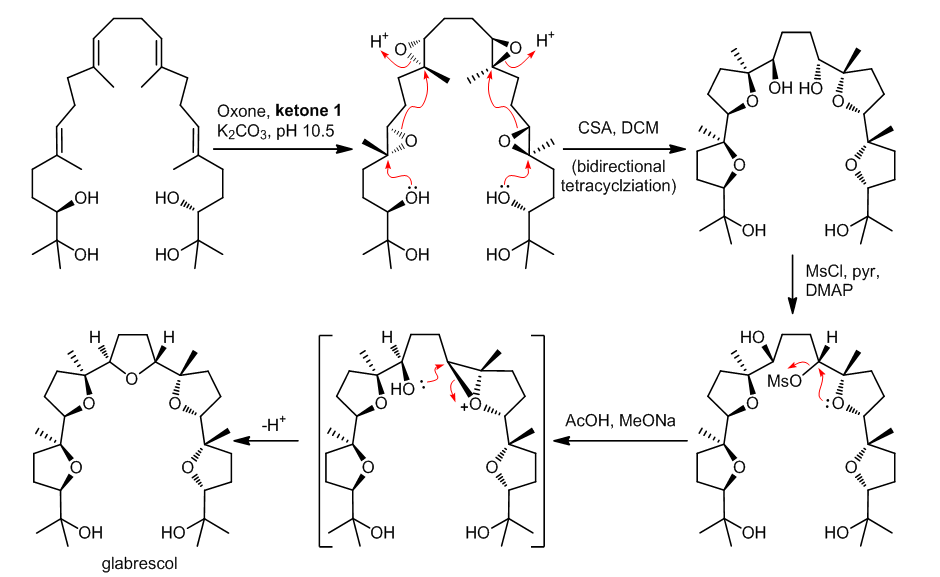
1.1.2.4 的全合成中多烯烃串联环化反应
四环氧化物的前体是通过使用史一安不对称环氧化反应得到的,用CSA处理之后,在分子的两侧分别发生串联环化反应得到所需的四环产物,并且产率也很高4,5。
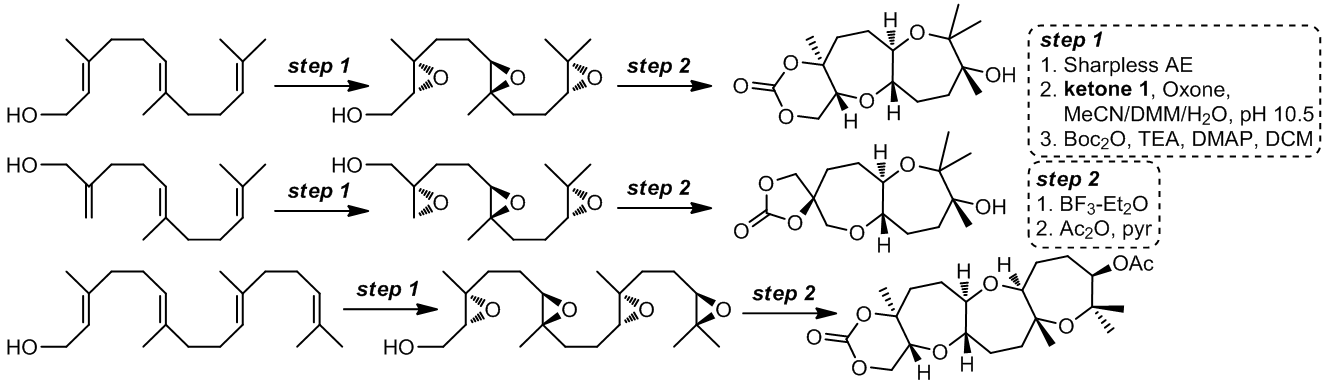
1.1.2.5 Polyepoxides的endo-成环过程
这是一个BF3催化下的多烯烃串联环化反应,反应的底物有很多种,包括香叶醇,法呢醇和香叶基香叶醇等,这个反应的产物具有很高的立体专一性,这为我们合成多环的醚类化合物提供了很有效的策略6-9。
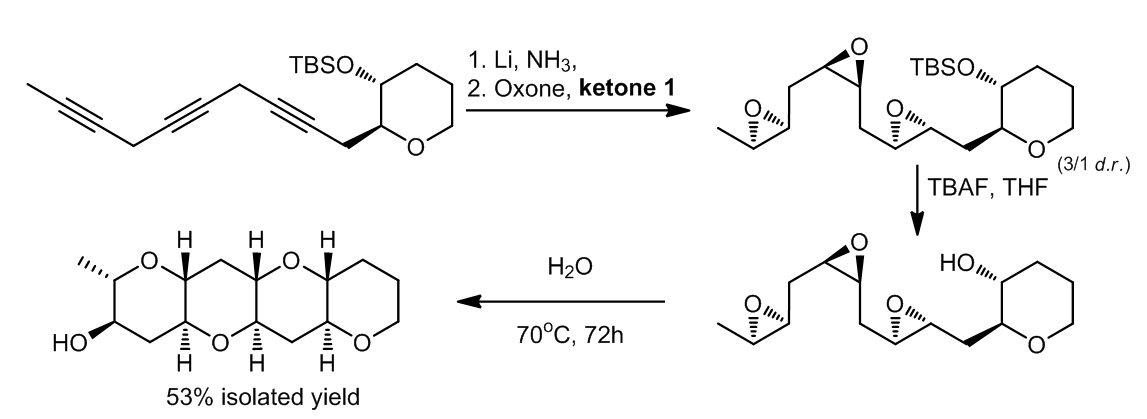
1.1.2.6 可以进行水引发的串联反应的多环氧化物
在被金属锂和液氨还原后,分子中的碳碳三键被转化成形成许多双键,在经过水引发的串联反应生成多环醚类化合物,最终产物以53%的分离产率获得10。
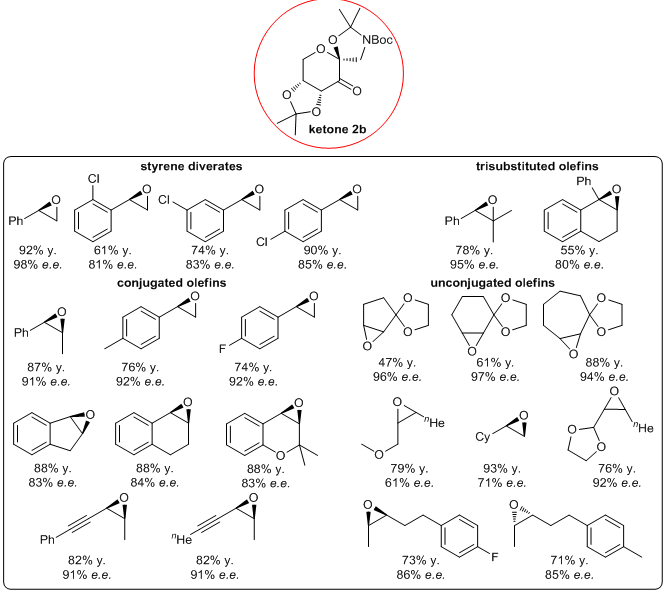
1.2 Ketone 2b
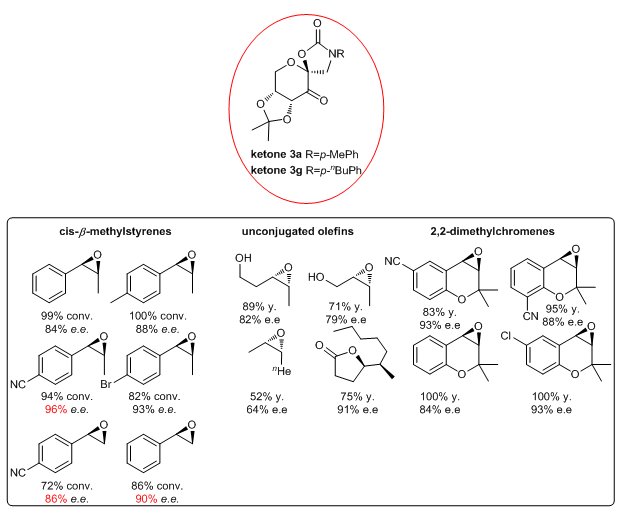
1.3 Ketone 3a和3g
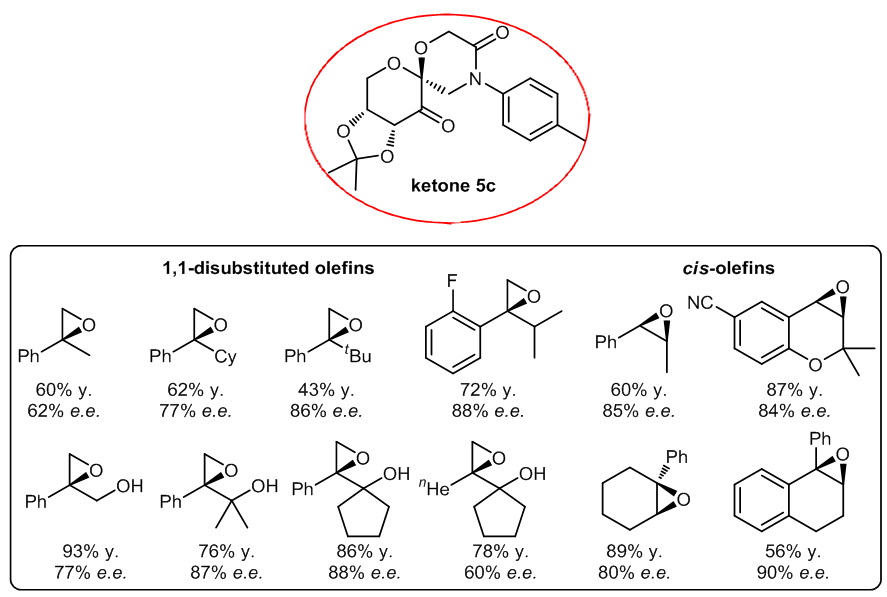
1.4 ketone5c
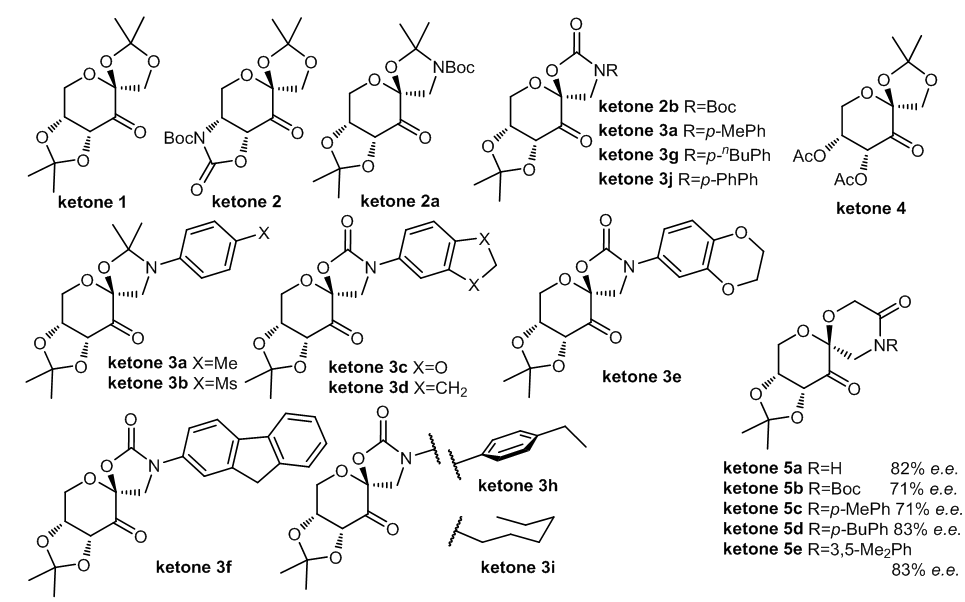
- 用于史一安环氧化的全部的手性酮催化剂
3. 总结
史一安课题组在1996年报道了第一例碳水化合物基的手性酮催化的烯烃的不对称环氧化反应,反应过程中使用的Oxone将手性酮氧化成过氧化酮,之后过氧化酮再和双键发生环氧化反应得到环氧化合物。在测试了众多溶剂之后的研究发现,MeCN是反应的最佳溶剂,并且反应对于三取代的双键和反式双键特别有效,着使得史一安环氧化反应可以作为Jacobsen氧化和Sharpless AE的互补反应,特别是对于烯丙基醇来说尤为如此。此外,这个反应可以适应众多烯烃的衍生物,但是某些反应条件对环氧化过程的影响会特别大,例如温度,pH和反应时间。史一安环氧化最重要的副反应是反应过程中可能发生的Baeyer-Villiger重排反应,但是对于pH的控制可以有效抑制这个反应。总的来说,史一安环氧化反应具有众多的优点,例如反应条件温和,立体选择性很好,便于反应后处理等,是一个在合成中常被使用的反应。
参考文献
- J. Org. Chem., 2005, 70 (19), pp 7711–7714, DOI: 10.1021/jo0511039
- J. Am. Chem. Soc., 2006, 128, 7428-7429, DOI:10.1021/ja061559n
- J. Am. Chem. Soc., 2007, 129 (5), pp 1050–1051, DOI: 10.1021/ja068826+
- J. Am. Chem. Soc., 2000, 122 (19), pp 4831–4832, DOI: 10.1021/ja000842y
- J. Am. Chem. Soc., 2000, 122 (38), pp 9328–9329, DOI: 10.1021/ja0024901
- Org. Lett., 2000, 2 (18), pp 2917–2919, DOI: 10.1021/ol0064009
- Org. Lett., 2000, 2 (18), pp 2917–2919, DOI: 10.1021/jo0110092
- Org. Lett., 2000, 2 (18), pp 2917–2919, DOI: 10.1021/ol034539o
- J. Am. Chem. Soc., 2005, 127 (13), pp 4586–4587, DOI: 10.1021/ja050013i
- Science, 2007, 317, 1189, DOI:1126/science.1146421
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!























No comments yet.