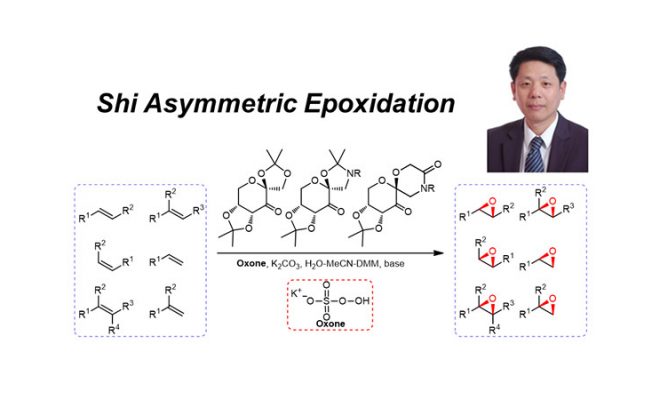
投稿作者 孙苏赟
1. 烯醇醚和烯醇酯的环氧化物的重排反应
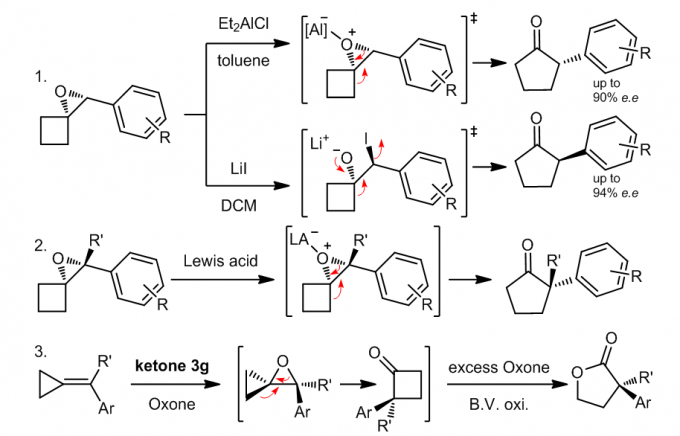
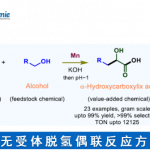
在之前提到烯醇醚和烯醇酯的环氧化产物可以进一步的重排生成五元环化合1,这是一个很意外的发现,但是之后史一安课题组对这个反应进行了深入的研究,发现重排的过程中可以保持环氧化合物中碳原子的构形会在特定情况下发生不同的反应2。当进行上图等式1中的反应时,利用了Lewis酸和质子酸两种不同的条件使得上述环氧化物发生分子内重排反应,当使得Lewis酸参与反应时,化合物的构形是会发生翻转的,反应中,Et2AlCl是作为Lewis酸的,它可以催化立体选择的重排反应,反应的过程是一个分子内的SN2过程,因此得到的产物是发生了钩形反转了的产物,但是值得注意的是,某些化合物,例如当R=OMe时,那么久更倾向于生成碳正离子而进行SN1反应了,因此得到的产物的立体选择性是相对较低的。
而当LiI参与反应时,反应得到的产物的构形是刚好和Lewsi酸催化的反应的产物是相反的,反应的过程可能是经历两次钩形反转过程,因此那个结果上来看构形是没有发生改变的,等式2中24的是四取代的双键发生环氧化的产物发生重排的情况,立体选择性依然非常好3。
基于以上的研究,可以用于合成五元环的内酯,这是另外一种重排的方式,是酸催化和热力学共同作用的结果4,如同等式3中的那样,反应会生成四元环的酮,如果在过量的Oxone的作用下就会发生Villiger-Baeyer氧化反应生成内酯,此后一种动力学拆分手性分子的方法也有了一些开发33。
2.手性识别的环烯醇的环氧化反应
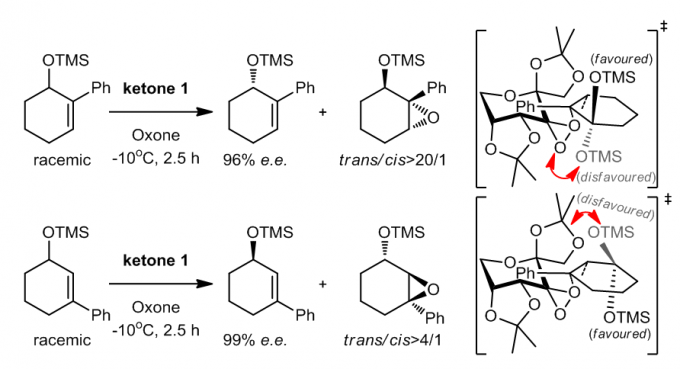
Ketone 1具有卓越的手性催化能力,因此有人提出它可能可以帮助拆分手性的环己烯泪衍生来得到光学纯净的化合物。对于1,3-和1,6-二取代的环己烯类化合物,反应中可以根据反应底物的取代基的空间效应对反应底物进行筛选,这为合成提供了很有用的手性中间体。
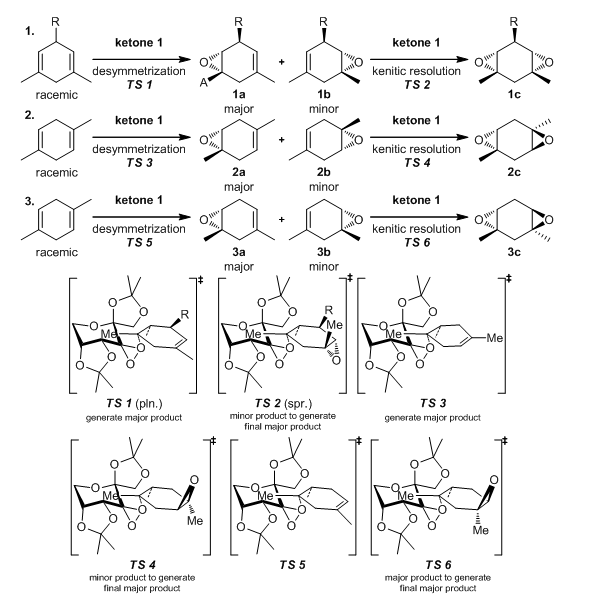
对于二甲基环己烯类反应底物,两个双键邻近具有潜手性中心,当这样的底物通过普通的环氧化处理之后的产物体现出很好的立体选择性38,如同等式1中所示,对于单环氧化物的e.e.可以达到81%到95%之间,反应时间不同对于立体选择性会有影响;而第二次环氧化时,之前反应中较少的产物会更加倾向于通过螺型过渡态得到二环氧化物,最终得到光学纯净的1a和1c产物。
如果分子中没有潜在手性中心,去对称化和动力学拆分也是拆分手性异构体的好方法38,如等式2所示,相同的,如果随着反应时间的延长,单环氧化物2a的e.e.可以从80%增长到98%;而第二次环氧化反应和等式1中的第二部相比,就显得进行的很迅速了。相反地,单环氧化物3a的e.e.会随着反应的进行而降低,如同等式3所示,因为第一次环氧化反应的主要产物更加倾向于进行接下来的反应,最终得到的是较多的二环氧化物的产物。
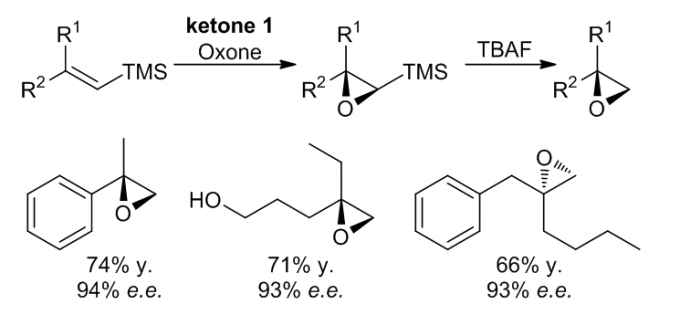
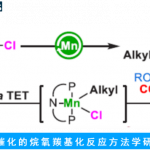
3. 间接地的得到端位环氧化物
利用TBAF去硅化之后,这个方法学中的反应可以高效的产生端位环氧化物,并且这个反应中的立体选择性很好,去硅化的过程不会导致产物的立体构型的改变,因此产物和去硅化之前的光学纯度是一致的。
参考文献
- Tetrahedron Lett., 1998, 39, 7819-7822. , DOI:1016/S0040-4039(98)01711-0
- J. Am. Chem. Soc.,1999, 121, 4080-4081, DOI::10.1021/ja990124f
- Tetrahedron Letters,47 (2006) 5455–5458, DOI:1016/j.tetlet.2006.05.175
- J. Org. Chem., 2001, 66, 1818-1826, DOI:10.1021/jo001593z
- J. Org. Chem., 1999, 64, 7675-7677, DOI:10.1021/jo990951z
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!























No comments yet.