作者:石油醚
导读:
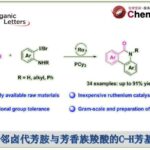
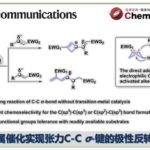
近日,美国Emory University的代明骥教授团队在J. Am. Chem. Soc.上,以 “Concise Total Syntheses of the 6–7–5 Hamigeran Natural Products” 为题,报道了四类6–7–5 Hamigeran类天然产物的全合成路线,即hamigeran C (2) (14 steps)、debromohamigeran I (6)(12 steps)和hamigeran I (7) (13 steps)的首次全合成以13步合成hamigeran G (5)。其中,关键步骤主要涉及钯催化的分子内环丙醇开环交叉偶联(palladium-catalyzed intramolecular cyclopropanol ring opening cross-coupling);芳香烃的C–H键氧化反应(aromatic C–H oxidation)。
“Concise Total Syntheses of the 6–7–5 Hamigeran Natural Products
Baiyang Jiang and Mingji Dai* J. Am. Chem. Soc., 2023,ASAP. doi:10.1021/jacs.3c06031.”
正文:
Hamigeran类天然产物是由新西兰科学家Cambie及其同事于2000年从新西兰海岸附近的海绵体Hamigera tarangaensis中分离获得的一种具有多种化学结构和显著生物活性的二萜类化合物 (Figure 1A)[1]。目前为止,已有30多种Hamigeran类天然产物被分离和定性[2]。从结构上看,大多数都具有特征性的6–6–5(hamigerane,1,图1A)或6–7–5(isohamigerane、2–8)三环碳骨架。其中,hamigerans类天然产物具有广泛的生物活性,如hamigeran B (1)对抗疱疹和脊髓灰质炎病毒的抗病毒活性;Hamigerans C (2), D (3), G (5), and M (8)可作为潜在的抗癌先导物,并且对白血病细胞具有中等的细胞毒性。近日,代明骥教授团队报道了四类6–7–5 Hamigeran类天然产物的全合成路线,即hamigeran C (2)(14 steps)、debromohamigeran I (6) (12 steps)和hamigeran I (7) (13 steps)的首次全合成以13步合成hamigeran G (5)。并发表于J. Am. Chem. Soc.上。
首先, hamigeran I (7)及其其他天然产物骨架中均含有6–7–5三环碳骨架。
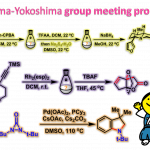
基于上述6–7–5三环碳结构的,作者对hamigeran I (7)及其类似天然产物进行了相关的逆合成分析(Figure 1D),即砌块(25)和(26)发生Suzuki 偶联、HAT还原等构建三环内酯(33)[3]。随后,(33)经Kulinkovich反应可制得环丙醇(32)[4],(33)经Pd催化环丙醇分子内开环交叉偶联获得关键的中间体(31)[5]。最后,(31)通过酮导向的C-H羟基化或硼化氧化完成hamigeran I (7)[6]及其类似天然产物的全合成。
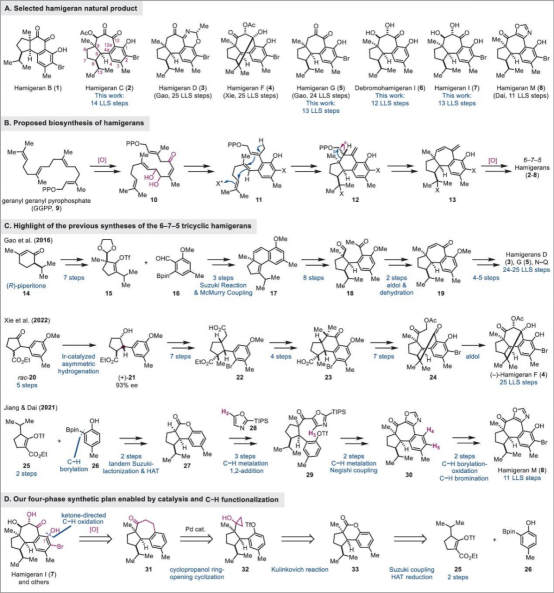
Figure 1. Hamigerans, plausible biosynthesis, prior synthesis, and retrosynthetic analysis.
该小组完成了hamigeran I (7)及其类似天然产物路线设计,如Figure 2。
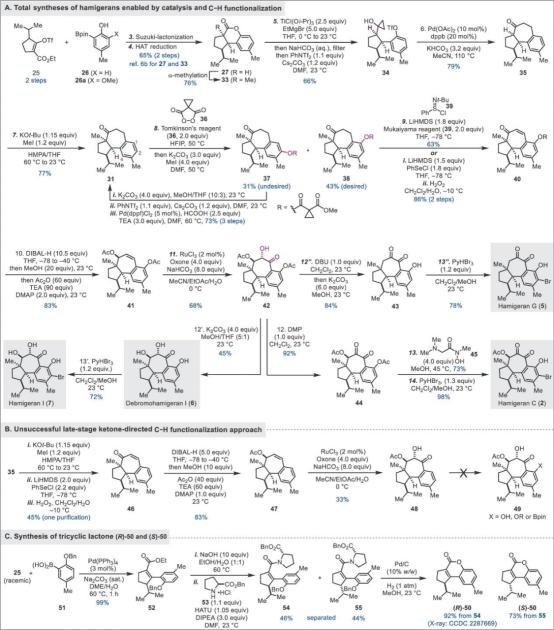
Figure 2. Total Syntheses of Hamigerans C, G, I, and Debromohamigeran I

总结,代明骥教授团队报道了四类6–7–5 Hamigeran类天然产物的全合成路线,即hamigeran C (2) (14 steps)、debromohamigeran I (6) (12 steps)和hamigeran I (7) (13 steps)的首次全合成以13步合成hamigeran G (5)。其中,关键步骤主要涉及钯催化的分子内环丙醇开环交叉偶联(palladium-catalyzed intramolecular cyclopropanol ring opening cross-coupling);芳香烃的C–H键氧化反应(aromatic C–H oxidation)。
参考文献:
- [1] K. D. Wellington, R. C. Cambie, P. S. Rutledge, P. R. Bergquist, J. Nat. Prod. 2000, 63, 79. doi:10.1021/np9903494.
- [2] J. D. Dattelbaum, A. J. Singh, J. J. Field, J. H. Miller, P. T. Northcote, J. Org. Chem. 2015, 80, 304. doi:10.1021/jo502370b.
- [3]. B. Jiang, M. Dai, J. Am. Chem. Soc. 2021, 143, 20084. doi:10.1021/jacs.1c11060.
- [4]. O. G. Kulinkovich, Chem. Rev. 2003, 103, 2597. doi:10.1021/cr010012i.
- [5]. S. Ydhyam, J. K. Cha, Org. Lett. 2015, 17, 5820. doi:10.1021/acs.orglett.5b02978.
- [6]. G. Shan, X. Yang, L. Ma, Y. Rao, Angew. Chem. Int. Ed. 2012, 51, 13070. doi:10.1002/anie.201207458.
- [7]. J. S. Kingsbury, E. J. Corey, J. Am. Chem. Soc. 2005, 127, 13813. doi:10.1021/ja055137+.
- [8]. E. Piers, R. W. Friesen, J. Org. Chem. 1986, 51, 3405. doi:10.1021/jo00367a042.
- [9]. A. Dragan, T. M. Kubczyk, J. H. Rowley, S. Sproules, N. C. O. Tomkinson, Org. Lett. 2015, 17, 2618. doi:10.1021/acs.orglett.5b00953.
- [10]. M. Teruaki, M. Jun-ichi, K. Hideo, Chem. Lett. 2000, 29, 1250. doi:10.1246/cl.2000.1250.
- [11]. K. B. Sharpless, R. F. Lauer, A. Y. Teranishi, J. Am. Chem. Soc. 1973, 95, 6137. doi:10.1021/ja00799a062.
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载.

















No comments yet.