本文作者:杉杉
导读
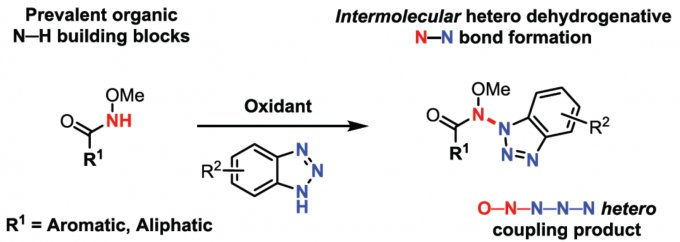
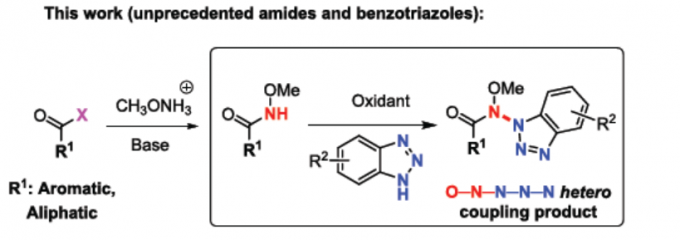
含氮-氮键的化合物,广泛存在于生物活性化合物、有机材料等中。然而,对于分子间的选择性N-N氧化偶联反应,仍具有难度。近日,德国亚琛工业大学Frederic W. Patureau课题组在Organic Letters 上发表论文,报道了一种通过使用高价碘作为末端氧化剂,实现酰胺和苯并三唑的选择性交叉脱氢N-N偶联反应。
Cross-Dehydrogenative N-N Coupling of Aromatic and Aliphatic Methoxyamides with Benzotriazoles
Pooja Y. Vemuri and Frederic W. Patureau*
Org. Lett. 2021, 23, 3902–3907. DOI:10.1021/acs.orglett.1c01034
正文
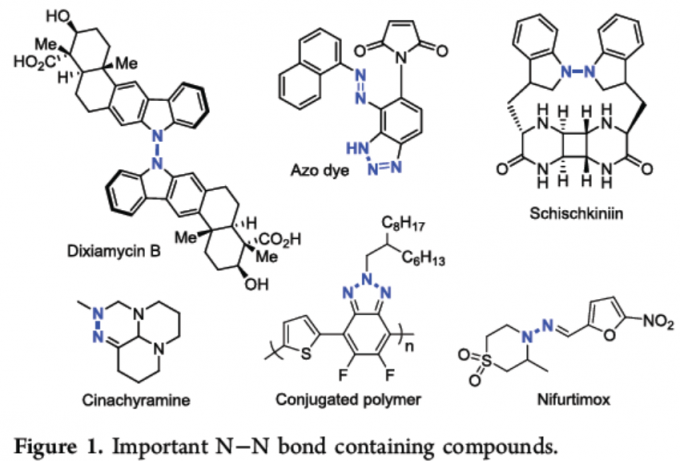
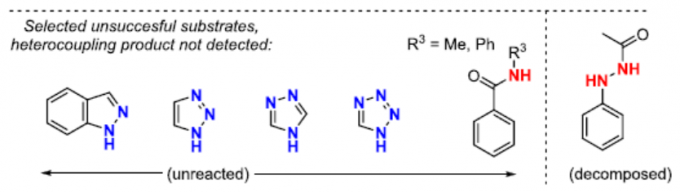
含有氮-氮键的化合物,广泛存在于药物、天然产物、有机材料、染料等中(Figure 1)。然而,此类化合物的合成常依赖重氮化反应或使用亲电的氮源(如肟、腙、腈、叠氮化物等),但对于通过直接脱氢构建N-N键的策略却很少被研究。
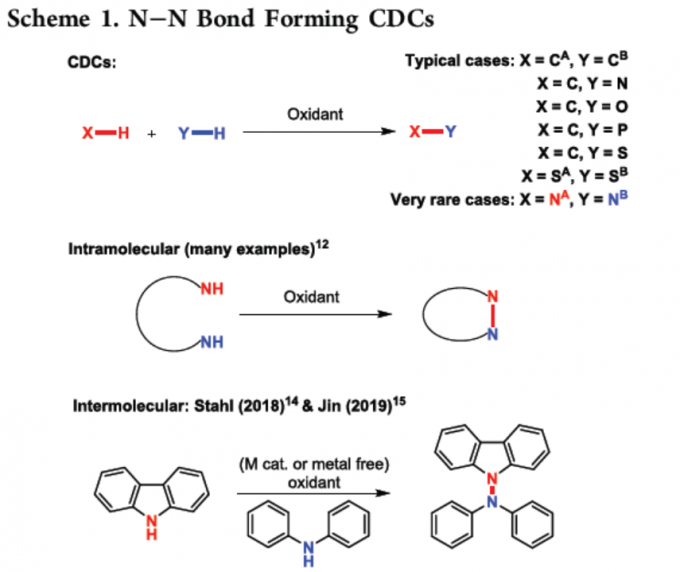
由于步骤和原子经济性的特点,脱氢交叉偶联(CDC)反应备受关注,同时可避免底物的预活化,并以高选择性构建C-C、C-N、C-O、C-P、C-S和杂SA-SB键(Scheme 1)。在过去,脱氢N-N偶联反应常用于分子内N-N键的构建。然而,对于分子间的脱氢N-N偶联反应,仍未得到充分探索。据文献查阅,Stahl等[1]和Jin等[2]报道了分子间脱氢N-N偶联的方法,但仅限于咔唑与二芳基胺底物(Scheme 1)。在此,本文将报道一种通过简单且温和的反应条件,实现酰胺和苯并三唑的高度选择性脱氢偶联反应。
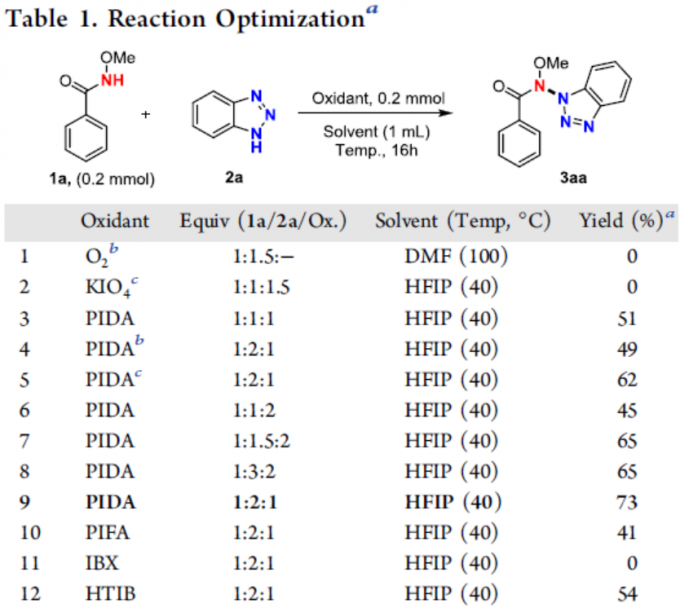
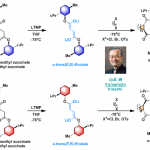
首先,作者以N-甲氧基苯甲酰胺1a和苯并三唑2a作为模型底物,进行了相关偶联反应条件的筛选(Table 1)。反应的最佳条件为:以PIDA为氧化剂,六氟异丙酚(HFIP)为溶剂,可在40 °C下反应,获得73%收率的偶联产物3aa。
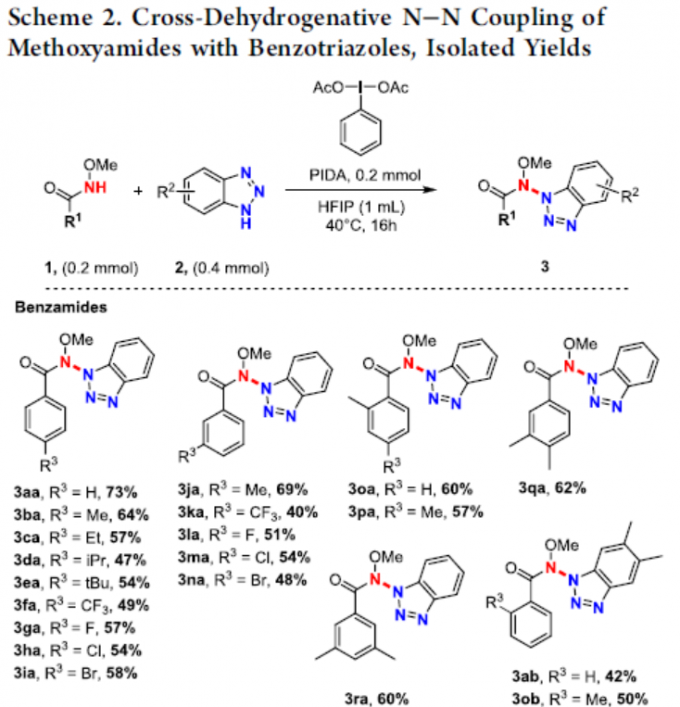
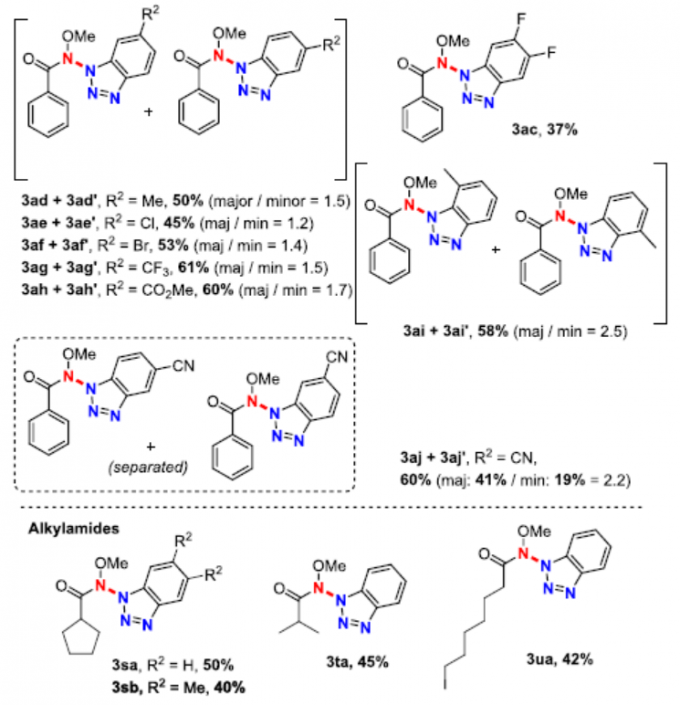
在获得上述最佳反应条件后,作者开始对底物范围进行了扩展(Scheme 2)。酰胺底物中的芳基取代,不受电子效应和定位效应的影响,均可顺利反应,获得相应的产物3aa–3ra,收率为40-73%。同时,对于对称的苯并三唑,也获得产物3ab、3ob和3ac。对于非对称的苯并三唑,通常获得异构体的混合物,如3ad/3ad’–3aj/3aj’。此外,一系列脂肪族酰胺(3sa,3sb,3ta,3ua),也与体系兼容。
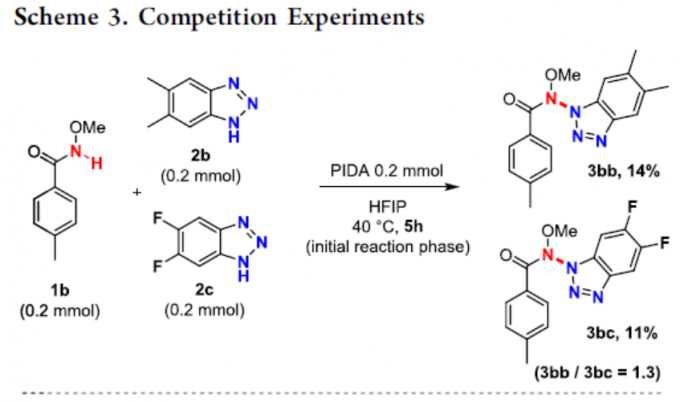
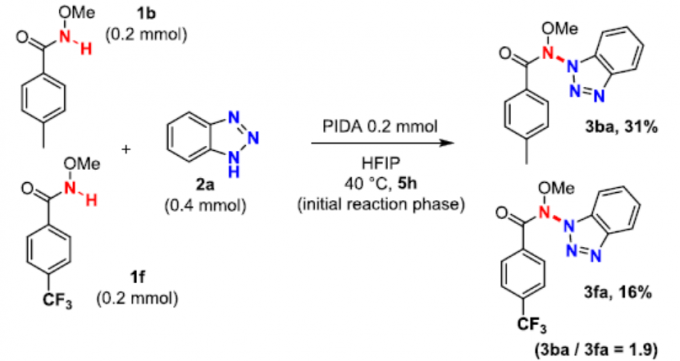
随后,作者进行了一些竞争性实验,以探究每种偶联底物的相对亲核性(Scheme 3)。酰胺1b与苯并三唑2b和2c同时反应时,具有给电子取代基的苯并三唑收率略高(3bb/3bc = 1.3)。苯并三唑2a与酰胺1b和1f同时反应时,具有给电子取代基的酰胺收率略高(3ba/3fa = 1.9)。上述结果说明,具有给电子基的底物反应速度会偏快,收率也略高。
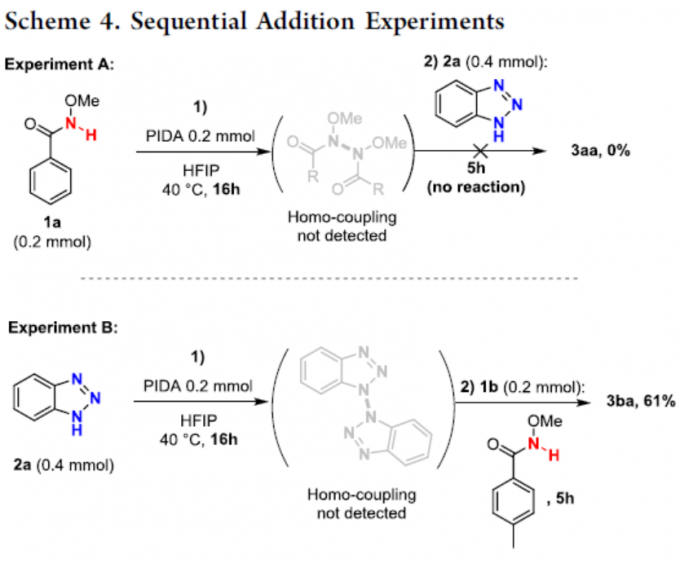
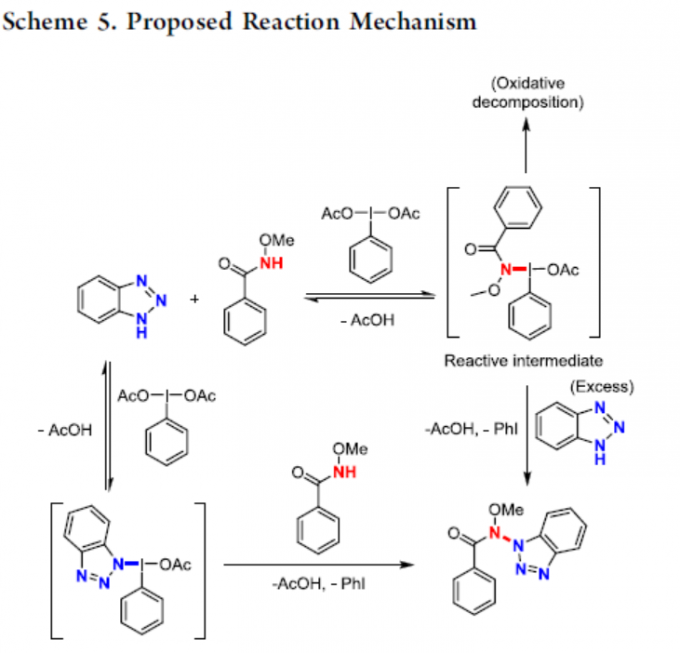
同时,为了进一步证明反应的先后顺序,作者分别将底物分批加入至反应体系中(Scheme 4)。在Experiment A中,酰胺底物1a在标准条件反应16 h后,再加入苯并三唑2a,但未能获得目标产物3aa。在Experiment B中,苯并三唑2a在标准条件反应16 h后,再加入酰胺底物1b,可获得61%收率的目标产物3ba。这些结果表明,在PIDA存在下,酰胺底物会发生不可逆地降解,而苯并三唑则不受影响。此外,作者还提出了一种可能的反应机理(Scheme 5)。
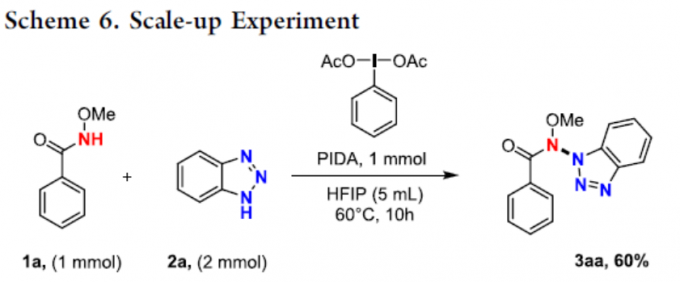
为了进一步证明反应的实用性,作者进行了相关的克级反应(Scheme 6),克级实验结果表明,仅需将反应温度提高至60 °C,即可获得60%收率的目标产物3aa。
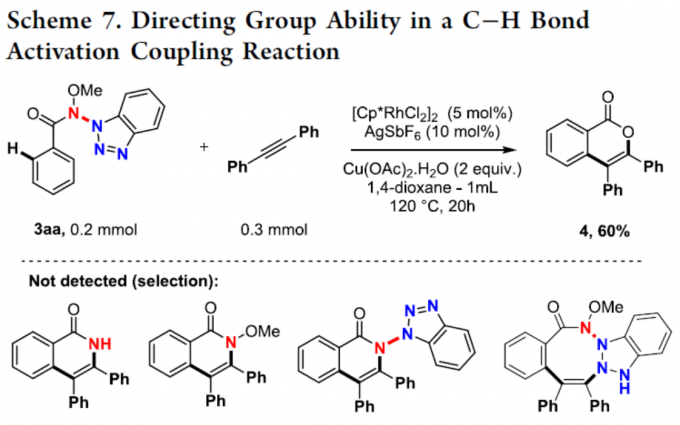
此外,合成的产物可应用于C-H活化偶联反应中(Scheme 7)。当使用Rh催化剂时,3aa可与二苯基乙炔顺利进行偶联反应,获得60%收率的化合物4。值得注意的是,化合物4未含有氮原子,从而表明这种新型O-N-N-N-N官能团可作为金属催化C-H键活化反应中有效的离去基团。
总结
德国亚琛工业大学Frederic W. Patureau课题组报道了一种N-甲氧基酰胺和苯并三唑的分子间脱氢N-N偶联反应。同时,该反应具有反应条件温和、底物范围广泛、官能团耐受性高等特点。值得注意的是,产物中的O-N-N-N-N官能团,可作为金属催化C-H键活化反应中有效的离去基团。



















No comments yet.