本文作者:杉杉
导读
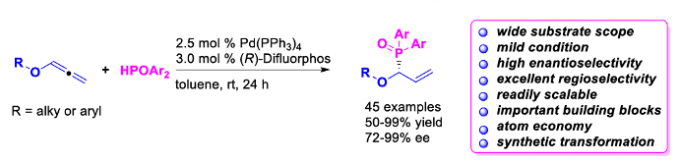
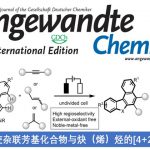
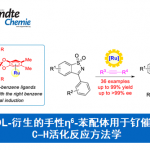
近日,香港Baptist大学的J. Wang课题组在Angew. Chem. Int. Ed.中发表论文,报道一种全新的采用钯催化剂促进的烷基或芳氧基联烯与膦氧化物之间的区域与对映选择性氢膦酰化 (hydrophosphinylation)反应方法学,进而快速高效地完成一系列具有多种官能团存在的手性烯丙基膦氧化物分子的构建。
Enantioselective Palladium-Catalyzed Hydrophosphinylation of Allenes with Phosphine Oxides: Facile Access to Chiral Allylic Phosphine Oxides
Yang, J. Wang, Angew. Chem. Int. Ed. 2021, 60, 27288. doi: 10.1002/anie.202112285.
正文
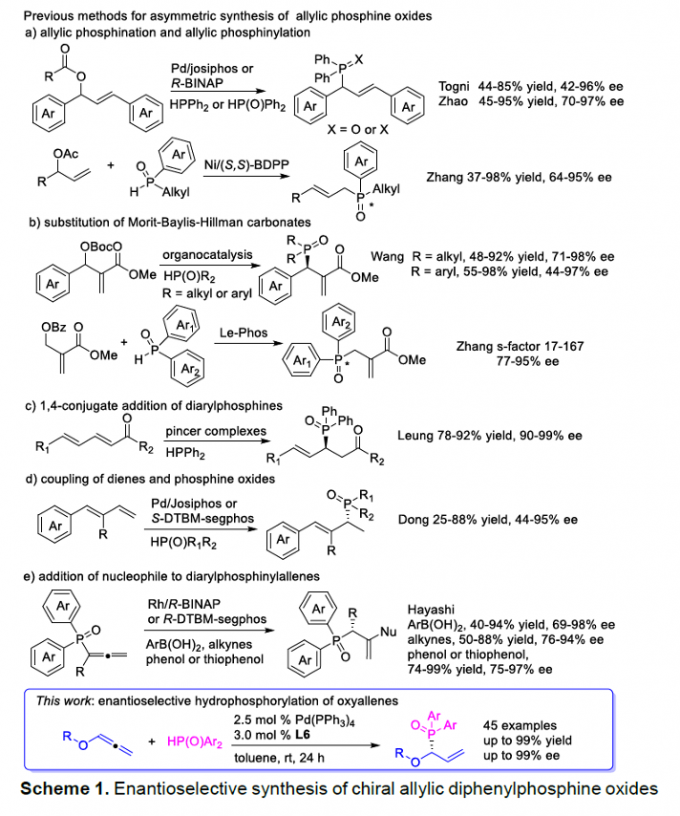
有机磷化合物广泛存在于一系列重要的生物活性分子、功能材料以及配体中。近年来,通过不对称催化策略构建手性有机磷化合物,尤其手性烯丙基膦氧化物(Scheme 1a-e)的相关研究,已经备受诸多研究团队的广泛关注[1]-[8]。然而,迄今为止,通过联烯基化合物参与的对映选择性氢膦酰化反应方法学的研究尚未有相关的文献报道。这里,受到Han与Tanaka团队对于钯催化的末端联烯基化合物参与的立体与区域选择性氢膦酰化反应方法学[9]以及本课题组前期对于含碳不饱和键的不对称氢官能化反应方法学[10]相关研究报道的启发,香港Baptist大学的J. Wang研究小组成功设计出一种全新的通过钯催化剂促进的烷基或芳氧基联烯与膦氧化物之间的区域与对映选择性氢膦酰化反应方法学,进而快速高效地完成一系列具有多种官能团存在的手性烯丙基膦氧化物分子的构建。
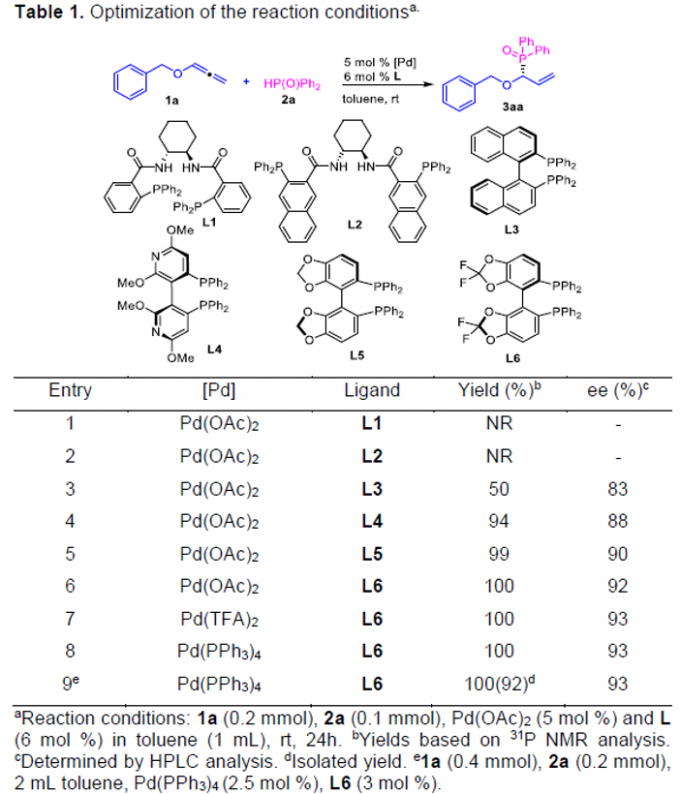
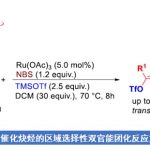
首先,作者采用烷氧基联烯1a与HPOPh2(2a)作为模型底物,进行相关反应条件的优化筛选 (Table 1)。进而确定最佳的反应条件为:采用Pd(PPh3)4作为催化剂,L6作为手性配体,甲苯作为反应溶剂,反应温度为室温,最终获得92%收率与93% ee的手性产物3aa。
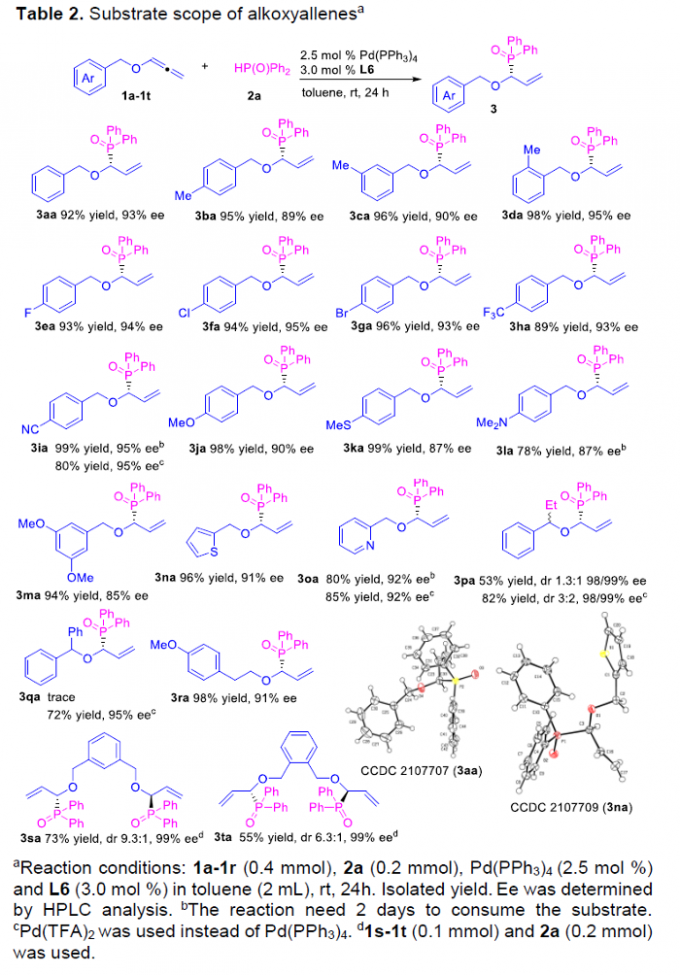
在上述的最佳反应条件下,作者首先对各类烷氧基联烯底物的应用范围进行考察 (Table 2)。研究表明,上述的标准反应条件对于芳基中具有一系列供电子与吸电子基团取代的联烯底物,均能够较好地兼容,并以良好至优良的反应收率与优良的对映选择性,获得相应的氢膦酰化产物3aa–3ma。同时,对于具有杂芳基取代的联烯底物,同样能够有效地兼容,并以良好至优良的反应收率与优良的对映选择性,获得相应的手性产物3na与3oa。之后,作者进一步发现,上述的标准反应体系对于底物1p,则需要将催化剂替换为Pd(TFA)2,进而获得良好的非对映选择性。而对于底物1q,则仅能够通过选择Pd(TFA)2作为催化剂,进而获得良好的反应收率与优良对映选择性的手性产物3qa。而对于具有更长碳链的联烯底物1r,同样能够顺利地参与上述的合成转化过程。同时,研究发现,上述的最佳反应条件对于对称烷氧基联烯底物,则获得具有双重手性中心的烯丙基膦氧化物3sa与3ta。并且,作者进一步通过X-射线晶体学分析,对相应手性产物3aa与3na的绝对构型 (R-构型)进行表征。
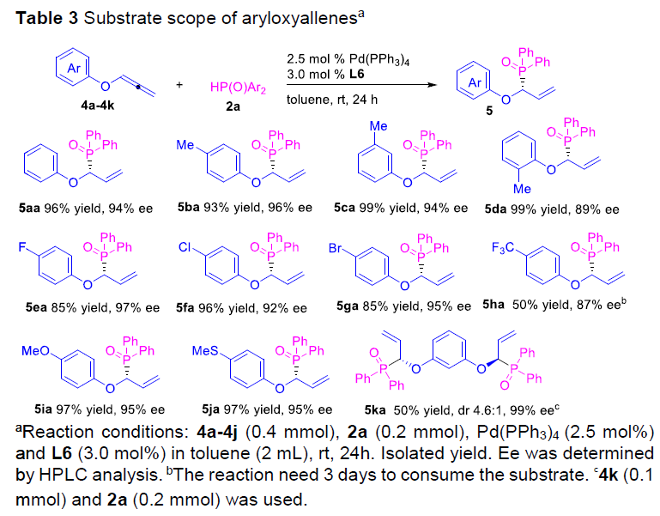
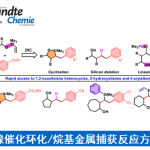
之后,作者进一步对一系列芳氧基联烯底物的应用范围进行深入研究 (Table 3)。实验表明,一系列芳基中带有供电子与吸电子基团取代的联烯底物,均能够有效地与上述的标准反应条件兼容,并以良好至优良的反应收率与优良的对映选择性,获得相应的手性产物5aa–5ja。同时,研究发现,采用对称芳氧基联烯底物4k时,则获得相应的双重氢膦酰化产物5ka。
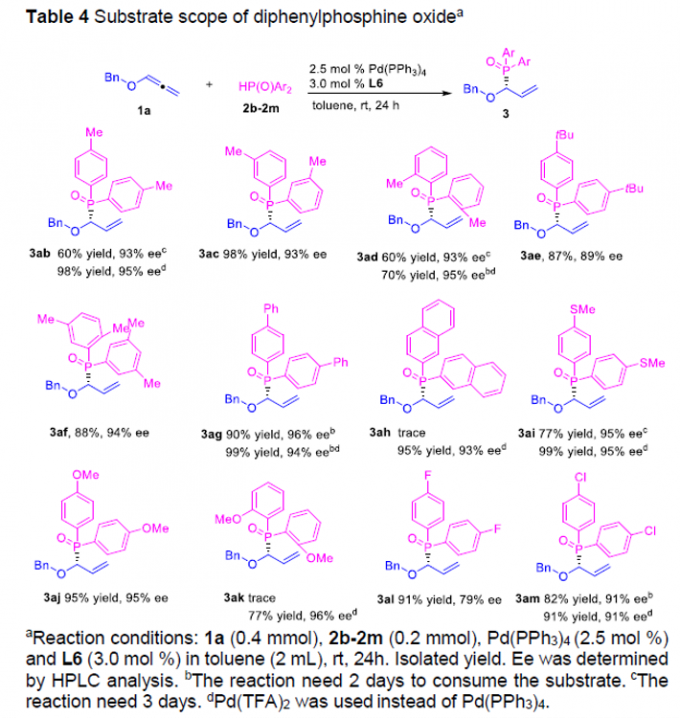
接下来,作者对各类HP(O)Ar2 (二芳基膦氧化物)底物的应用范围进行进一步考察 (Table 4)。研究表明,芳基中具有一系列供电子与吸电子基团取代的HP(O)Ar2底物,均能够以良好至优良的反应收率与优良的对映选择性,获得相应的标题化合物3ab–3af以及3ai–3am。同时,该小组发现,上述的标准反应体系对于萘基以及联苯基取代的二芳基膦氧化物,同样能够良好地兼容,并获得相应的手性产物3ag与3ah。
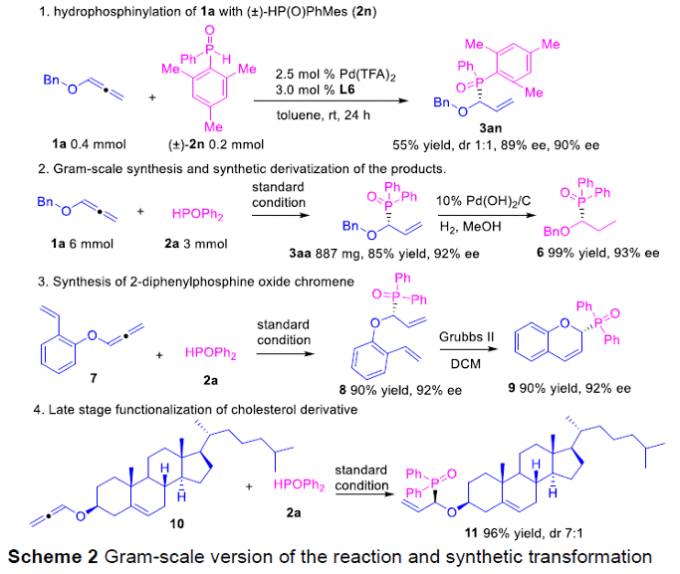
之后,该小组通过如下的一系列研究进一步表明,这一全新的氢膦酰化策略具有良好的合成应用前景(Scheme 2)。
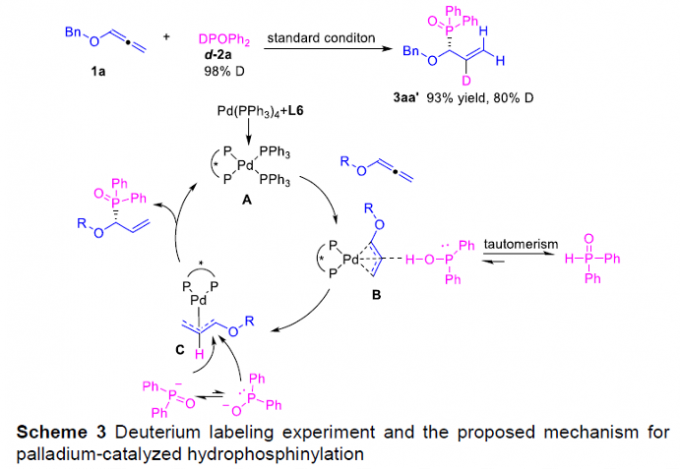
接下来,作者通过同位素标记实验的相关研究,进而提出一种合理的反应机理 (Scheme 3)。
总结
香港Baptist大学的J. Wang课题组成功设计出一种全新的通过钯催化剂促进的烷基或芳氧基丙二烯分子与膦氧化物之间的区域与对映选择性氢膦酰化反应方法学,进而有效地完成一系列具有多种官能团存在的手性烯丙基膦氧化物分子的构建。这一全新的氢膦酰化策略具有广泛的底物范围、良好的官能团兼容性、高度的反应收率与对映选择性以及良好的原子经济性等优势。
参考文献
- [1] (a) S. Zhang, J. Z. Xiao, Y. B.Li, C. Y. Shi, L. Yin, J. Am. Chem. Soc. 2021, 143, 9912. doi: 10.1021/jacs.1c04112.
- (b) C. Wang, K. Huang, J. Ye, W.-L.Duan, J. Am. Chem. Soc. 2021, 143, 5685. doi: 10.1021/jacs.1c02772.
- [2] a) P. Butti, R. Rochat, A. D. Sadow, A. Togni, Angew. Chem. Int. Ed. 2008, 47, 4878. doi: 10.1002/anie.200801287.
- b) L. Zhang, W. Liu, X. Zhao, J. Org. Chem. 2014, 2014, 6846. doi: 10.1002/ejoc.201403024.
- [3] X. T. Liu, Y. Q.Zhang, X. Y.Han, S. P.Sun, Q. W. Zhang, J. Am. Chem. Soc. 2019, 141, 16584. doi:10.1021/jacs.9b08734.
- [4] a) W. Sun, L. Hong, C. Liu, R. Wang, Org. Lett. 2010, 12, 3914. doi: 10.1021/ol101601d.
- b) L. Hong, W. Sun, C. Liu, D. Zhao, R. Wang, Commun. 2010, 46, 2856. doi: 10.1039/B926037D.
- [5] H. Qiu, Q. Dai, J. He, W. Li, J. Zhang, Chem. Sci. 2020, 11, 9983. doi: 10.1039/D0SC04041J.
- [6] X. Y. Yang, W. S. Tay, Y. Li, S. A. Pullarkat, P. H. Leung, Organometallics 2015, 34, 5196. doi:10.1021/acs.organomet.5b00787.
- [7] S. Z. Nie, R. T. Davison, V. M. Dong, J. Am. Chem. Soc. 2018, 140, 16450. doi: 10.1021/jacs.8b11150.
- [8] a) T. Nishimura, S. Hirabayashi, Y. Yasuhara, T. Hayashi, J. Am. Chem. Soc. 2006, 128, 2556. doi: 10.1021/ja058763f.
- b) T. Kawamoto, S. Hirabayashi, X. Guo, T. Nishimura, T. Hayashi, Chem. Commun .2009, 352. doi:10.1039/B813589D.
- [9] (a) C. Q. Zhao, L. B. Han, M. Tanaka, Organometallics 2000, 19, 4196. doi: 10.1021/om000513e.
- (b) L. B.Han, F. Mirzaei, C. Q. Zhao, M. Tanaka, J. Am. Chem. Soc. 2000, 122, 5407. doi: 10.1021/ja000444v.
- [10] a) Z. Lu, H. Zhang, Z. Yang, N. Ding, L. Meng, J. Wang, ACS Catal. 2019, 9, 1457. doi: 10.1021/acscatal.8b04787.
- b) L. Meng, K. Y. Ngai, X. Chang, Z. Lin, J. Wang, Lett.2020, 22, 1155. doi: 10.1021/acs.orglett.0c00005.
- c) S. Li, Q. Yang, Z. Bian, J. Wang, Lett. 2020, 22, 2781. doi: 10.1021/acs.orglett.0c00762.
- d) Q. Yang, Y. Wang, S. Luo, J. Wang, Chem. Int. Ed. 2019, 58, 5343. doi: 10.1002/anie.201900721.
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载

















No comments yet.