小编从博三开始接触有机叠氮化合物这个底物,可以说叠氮化合物作为click反应,Curtius重排等反应的原料近年来发展特别迅速,而有机叠氮,有机重氮化合物也让小编的课题得到了巨大突破,终于即将能够抬头挺胸走出这个实验室了,因此,在这里准备介绍一下有机叠氮化合物的构造,反应活性及其用途。有不充分的地方,请各位读者大神们指正。
什么是有机叠氮?
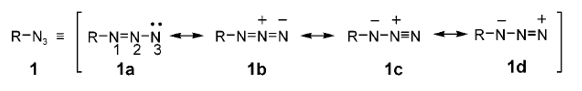
有机叠氮化合物(Organic Azides)具有三个氮,这三个氮以”直線”排列链接形成了叠氮基团 (图1),一般以RN3表示。

图1 有机叠氮化合物的构造
有机叠氮化合物在1864年首次被合成出来,迄今为止已经有150年的历史了,通常具有以下两个特征。
- 可以画出共振结构试、可以”稳定”存在
- 同时具有「亲核性」与「亲电性」两种性质
叠氮可以转换成多种官能团,近年来在化学生物学,荧光标记领域发挥了重要的作用。
实际上,用SciFinder简单搜了下「有机叠氮」相关的论文数(图2),可以发现每年的论文数呈持续增长的趋势。
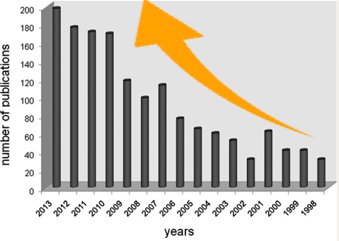
图2 「有机叠氮化合物」相关论文数量(SciFinder)[1]
那么,近年来备受数目的有机叠氮化合物是怎样被合成的呢?让我们一起来看一下它的开发历史吧。
有机叠氮的黎明期
1864年,德国化学家Johann Peter Griess(叠氮化合物的发现者)合成出了苯基叠氮[2]。但是,由于当时分析手段有限,没有能够明确确定其结构式,而是错认为了1-phenyl-1H-triazine的结构(图3)。
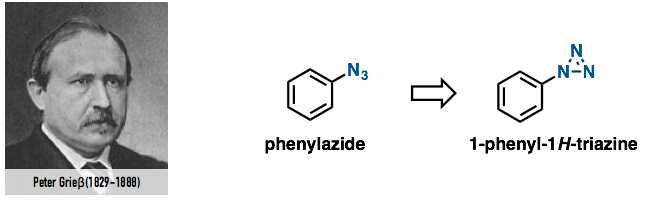
图3. 苯基叠氮的合成者及当时的假定结构式
之后在1890年同样是德国的化学家Theodor Curtius发现了酰基叠氮的重排现象,生成的异氰酸酯在水作用下水解后得到减碳的胺产物(图4)。这就是著名的Crutius重排反应[3]。
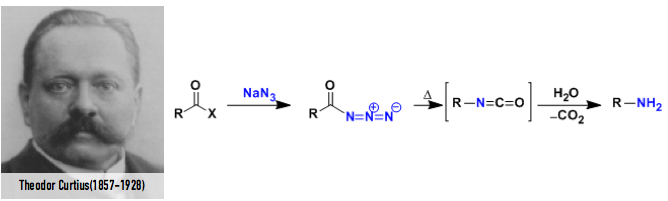
図4. Curtius跟Curtius重排反应
所以说,19世纪是有机叠氮的合成与应用的黎明期。从1950年之后的60年中大量的叠氮化合物被合成,在2000年左右开始叠氮核酸与生物体内的共轭反应为中心的研究被发展壮大,接下来,一起来看一下有机叠氮化合物的结构与性质
有机叠氮的结构:真的是直线构型么?
在开头,小编提到有机叠氮的叠氮基是”直线”排列的,但是这里小编在直线上特意加了个引号,那到底是不是三个氮之间距离等长且直线排列呢?
答案是否定的,叠氮基团既不是直线也不是等间隔的!
首先让我们来看一下甲基叠氮(CH3-N3)的结构(图5),三个氮原子N1-N2-N3的二面角呈172.5°而不是180°(直线)。另外键长也不是一致的,N1-N2长度为1.244Å,N2-N3则只有1.162Å,因此与C比较近的N-N键相对来说要长一点。
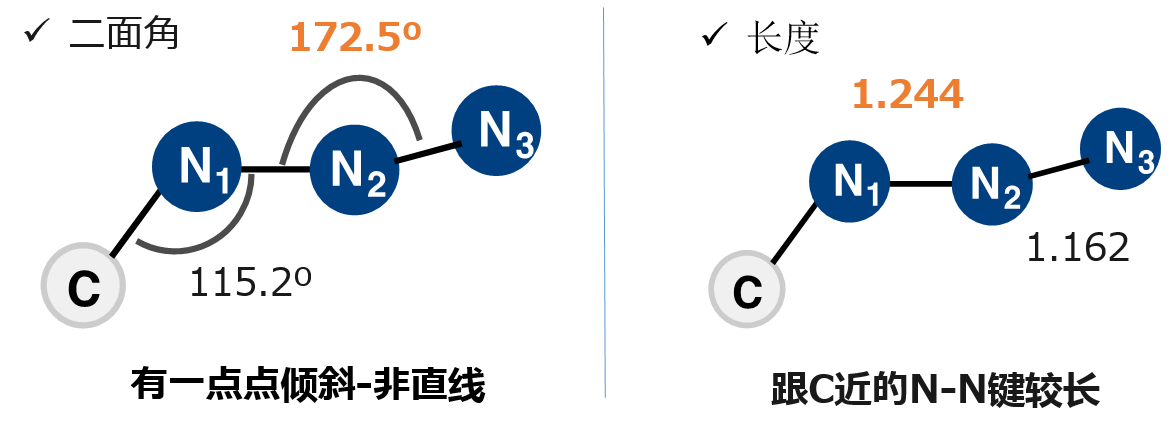
图5 甲基叠氮的结构[4]
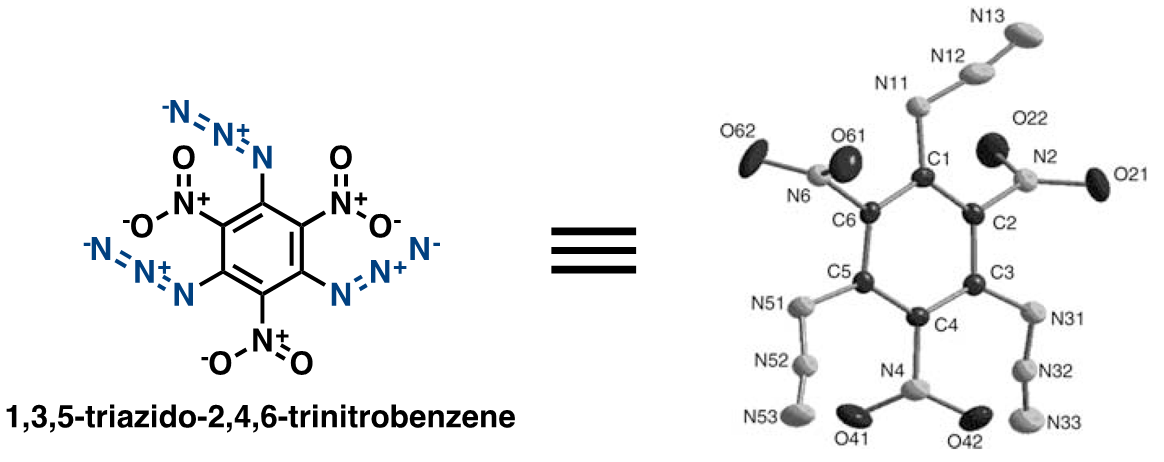
接着再来看一下芳香基的叠氮化合物(图6)。苯环上被叠氮与硝基占据的化合物,由于含N比较多,所以目测非常危险,从这个化合物的X-ray单晶衍射解析[5]也显示,叠氮基并不是直线排列的。
有机叠氮化合物的物理性质:共轭式・谱图・反应性
开头小编也提到了有机叠氮化合物是”稳定”存在的,这里所述的稳定指的是「化学层面上的稳定存在」之意。叠氮化合物的共振结构式如下图所示,特别是芳香基取代的叠氮化合物,由于多个共轭结构式的存在,更加”稳定”。
但是实际上叠氮化合物具有「爆炸性」。这一点会在以后的系列文章中详细描述。
红外IR与紫外UV的谱图如下所示。
IR = 2114 cm-1 (苯基叠氮)
UV = 287 nM, 216 nM (烷基叠氮)
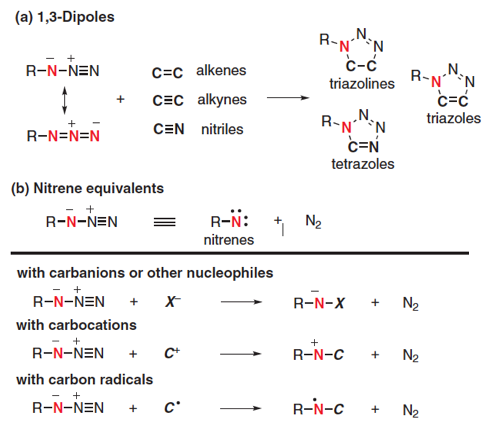
反应活性相对较高,分子内同时含有亲核性的氮与亲电子的氮原子,因此,可以作为1,3-偶极子反应或者氮烯的等价体参与反应。
综上,第一回就介绍到这里,主要序数了下有机叠氮化合物的发展历史以及基本的物理化学性质,下一次准备介绍下叠氮的爆炸性等特点,敬请期待。
参考文献
- Intrieri, D.; Zardi, P.; Caselli, A.; Gallo, E. Chem Commun 2014, 50, 11440. DOI: 10.1039/C4CC03016H
- (a) Grieβ, P.; Philos. Trans. R. Soc. London 1864, 13, 377 (b) Grieβ, P. Justus Liebigs Ann. Chem. 1865, 135, 131.
- (a) Curtius, T. Ber. Dtsch. Chem. Ges. 1890, 23, 3023 (b) Curtius, T. J. Prakt. Chem. 1894, 50, 275.
- Nguyen, M. T.; Sengupta, D.; Ha, T.-K.J. Phys. Chem. 1996, 100, 6499. DOI: 10.1021/jp953022u
- Chiba, S.Synlett 2011, 2012, 21. DOI: 10.1055/s-0031-1290108
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!





















No comments yet.