本文作者:杉杉
导读
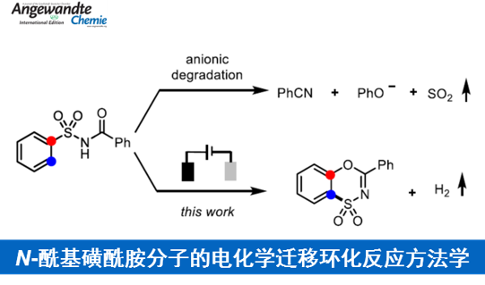
近日,福州大学的叶克印与厦门大学的朱军课题组在Angew. Chem. Int. Ed.中发表论文,报道一种全新的通过各类N-酰基磺酰胺化合物参与的电化学迁移环化反应方法学,进而顺利完成一系列苯并噁噻嗪二氧化物(benzoxathiazine dioxides)分子的构建。
Electrochemical Migratory Cyclization of N-acylsulfonamides
Shi, Y. Li, N. Li, W. Wang, H. Lu, H. Yan, Y. Yuan, J. Zhu, K. Ye, Angew. Chem. Int. Ed. 2022, ASAP. doi: 10.1002/anie.202206058.
正文
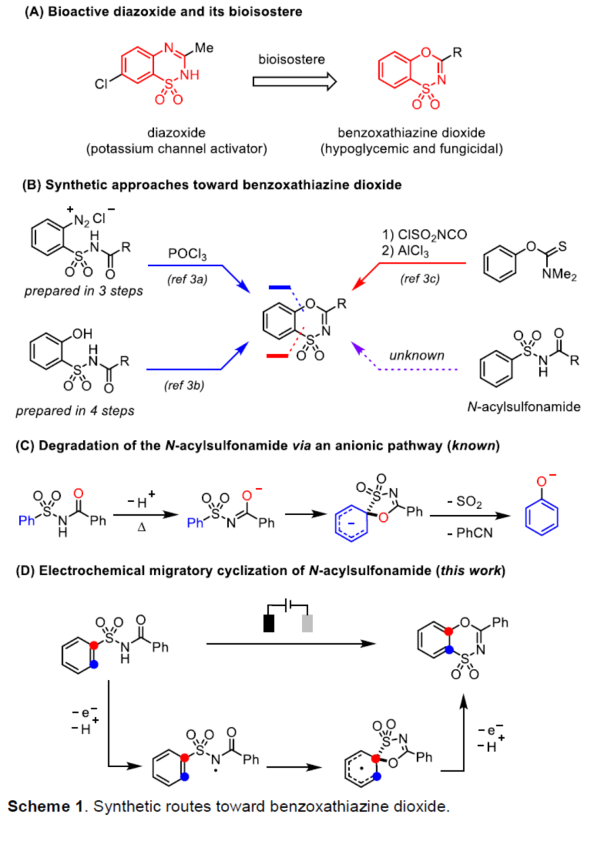
苯并噁噻嗪二氧化物具有良好的生物活性 (Scheme 1A)。然而,对于上述分子的合成,却较少有相关的研究报道[1]-[2] (Scheme 1B-C)。这里,受到近年来对于有机电化学合成反应方法学[3]以及通过电化学策略获得氮自由基[4]相关研究报道的启发,福州大学的叶克印与厦门大学的朱军课题组共同报道一种全新的采用各类N-酰基磺酰胺 (N-acylsulfonamides)化合物参与的电化学迁移环化反应方法学 (Scheme 1D)。
首先,作者采用N-酰基苯磺酰胺1a作为模型底物,进行相关反应条件的优化筛选 (Table 1)。进而确定最佳的反应条件为:采用carbon cloth作为阳极与Pt plate作为阴极,nBu4NOAc作为支持电解质,HOAc作为添加剂,CCE (constant-current electrolysis)=15 mA,DCE/HFIP (7:3 v/v)作为反应溶剂,反应温度为室温,最终获得72%收率的迁移环化产物2。
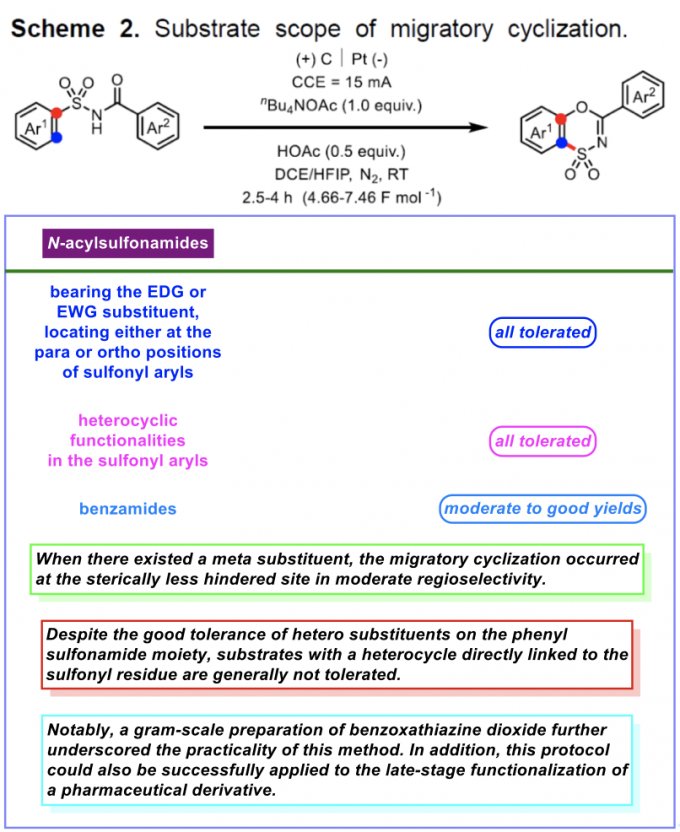
在上述的最佳反应条件下,作者对一系列N-酰基磺酰胺底物 (Scheme 2)的应用范围进行深入研究。
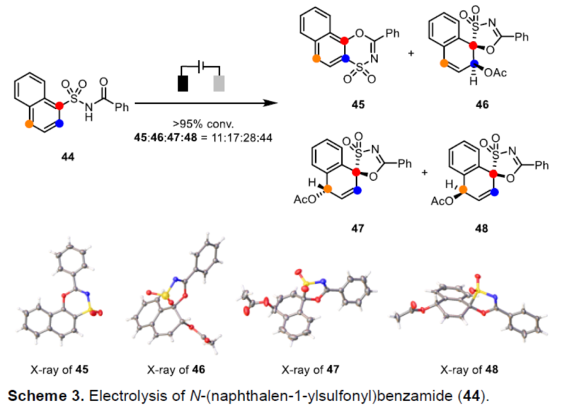
接下来,作者发现,在上述的标准反应条件下,采用N-酰基萘磺酰胺底物44,则能够同时获得相应的迁移环化产物45以及去芳构化螺环产物46–48 (Scheme 3)。
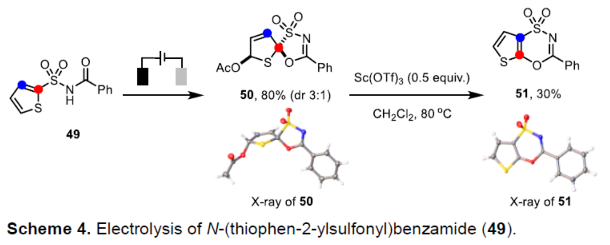
同时,该小组进一步发现,采用N-酰基噻萘磺酰胺底物49时,则能够完全转化为相应的去芳构化螺环产物50,并通过后续的反应步骤,进一步转化为相应的噻吩并噁噻嗪二氧化物51 (Scheme 4)。
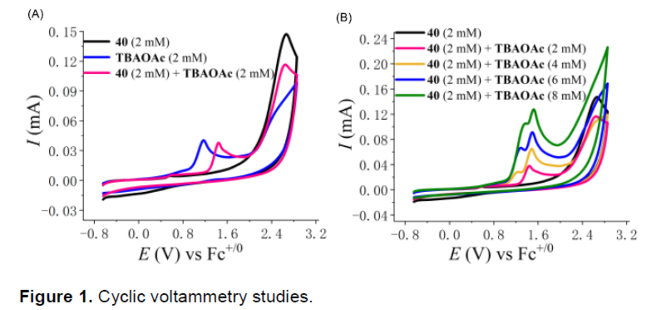
接下来,作者通过CV (cyclic-voltammetry) (Figure 1 and SI)以及NMR实验 (详见SI)研究表明,上述的电化学迁移环化过程中涉及分步的PCET (proton-coupled electron transfer)机理路径。同时,N-对甲苯磺酰基苯甲酰胺分子 (1)中的N-H基团与乙酰氧基负离子之间存在相应的分子间氢键相互作用。
基于上述的实验研究以及前期相关的文献报道[5],作者提出如下合理的反应机理 (Scheme 5)。
总结
福州大学的叶克印与厦门大学的朱军课题组共同设计出一种全新的通过各类N-酰基磺酰胺 (N-acylsulfonamides)化合物参与的电化学迁移环化反应方法学,进而成功完成一系列苯并噁噻嗪二氧化物分子的构建。这一全新的电化学迁移环化策略具有温和的反应条件、广泛的底物应用范围以及优良的官能团兼容性等优势。
参考文献
- [1] (a) E. Wertheim, J. Am. Chem. Soc. 1934, 56, 971. doi: 10.1021/ja01319a069.
- (b) S. Suzue, T. Irikura, Chem. Pharm. Bull. 1968, 16, 806. doi: 10.1248/cpb.16.806.
- [2] Y. Liang, Y. Simon-Manso, P. Neta, X. Yang, S. E. Stein, J. Am. Soc. Mass Spectrom. 2021, 32, 806. doi: 10.1021/jasms.0c00470.
- [3] (a) M. Yan, Y. Kawamata, P. S. Baran, Chem. Rev. 2017, 117, 13230. doi: 10.1021/acs.chemrev.7b00397.
- (b) K. D. Moeller, Chem. Rev. 2018, 118, 4817. doi: 10.1021/acs.chemrev.7b00656.
- (c) A. Wiebe, T. Gieshoff, S. Möhle, E. Rodrigo, M. Zirbes, S. R. Waldvogel, Angew. Chem. Int. Ed. 2018, 57, 5594. doi: 10.1002/anie.201711060.
- [4] (a) P. Xiong, H. Xu, Acc. Chem. Res. 2019, 52, 3339. doi: 10.1021/acs.accounts.9b00472.
- (b) N. Chen, H. Xu, Green Synth. Catal. 2021, 2, 165. doi: 10.1016/j.gresc.2021.03.002.
- [5] A. Studer, D. P. Curran, Angew. Chem. Int. Ed. 2011, 50, 5018. doi: 10.1002/anie.201101597.
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载





















No comments yet.