本文作者:杉杉
导读
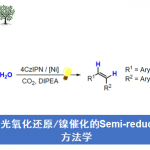
近日,大连理工大学的石磊、廖骞与河南师范大学的郝二军课题组在Angew. Chem. Int. Ed.中发表论文,共同报道一种全新的光氧化还原催化的α-氨基烷基自由基与瞬态烯丙基自由基之间的自由基交叉偶联反应方法学,进而成功完成一系列高烯丙基胺分子的构建。
Synthesis of Homoallylic Amines by Radical Allylation of Imines with Butadiene under Photoredox Catalysis
Chen, H. Yan, Q. Liao, D. Zhang, S. Lin, E. Hao, R. Murtaza, C. Li, C. Wu, C. Duan, L. Shi, Angew. Chem. Int. Ed. 2022, ASAP. doi: 10.1002/anie.202204516.
正文
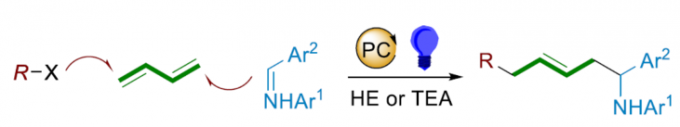
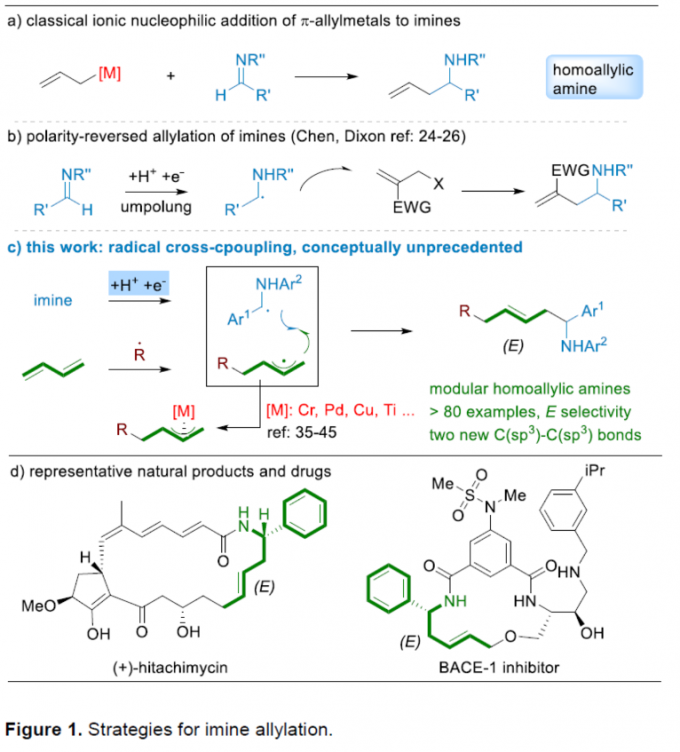
高烯丙基胺化合物作为有机合成化学中的关键砌块,已经广泛应用于各类含氮天然产物以及药物分子的构建(Figure 1d) [1]-[2]。目前,对于高烯丙基胺分子的合成,通常采用π-烯丙基金属试剂与亚胺分子之间的亲核加成策略 (Figure 1a) [1]-[2]。然而,由于湿气较为敏感的π-烯丙基金属试剂的制备过程极为繁琐,因而使上述亲核加成策略的进一步应用受到较大限制。这里,受到亚胺极性反转烯丙基化反应方法学(Figure 1b)[3]-[5]以及通过过渡金属试剂捕获高度反应活性的烯丙基自由基,形成相应π-烯丙基金属配合物 (Figure 1c middle-lower) [6]-[10]的相关研究报道的启发,大连理工大学的石磊、廖骞与河南师范大学的郝二军课题组共同设计出一种全新的光氧化还原催化的α-氨基烷基自由基与瞬态烯丙基自由基的之间交叉偶联反应方法学 (Figure 1c)。
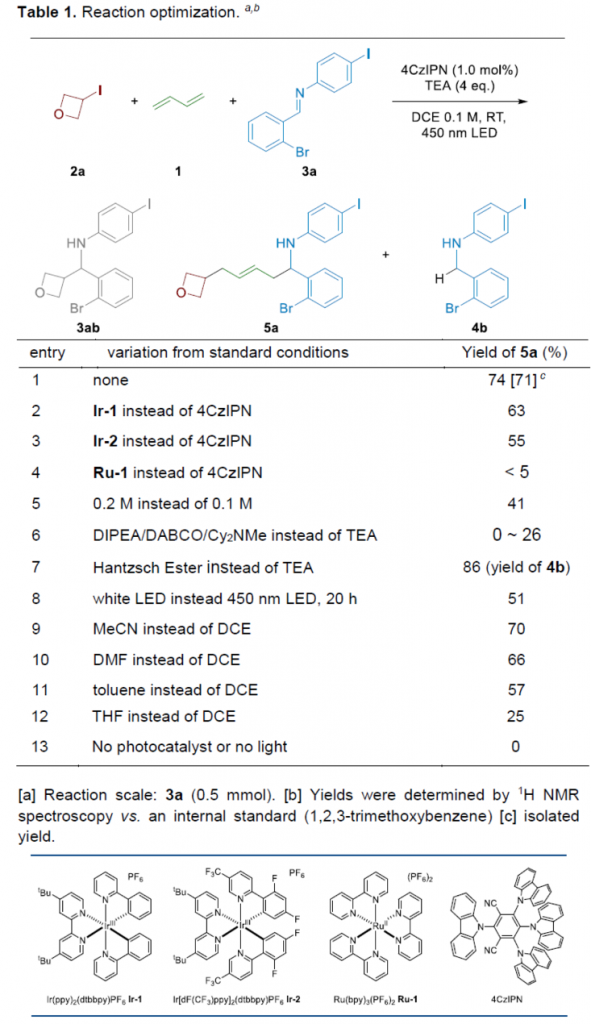
首先,作者采用3-碘氧杂环丁烷2a、丁二烯1与亚胺衍生物3a作为模型底物,进行相关反应条件的优化筛选(Table 1)。进而确定最佳的反应条件为:采用4CzIPN作为光催化剂,TEA作为有机电子供体 (organic electron donor),二氯乙烷作为反应溶剂,450 nm LED辐射,反应温度为室温,最终获得74%收率的偶联产物5a。
在上述的最佳反应条件下,作者对一系列有机卤、共轭二烯以及亚胺底物的应用范围 (Table 2)进行深入研究。
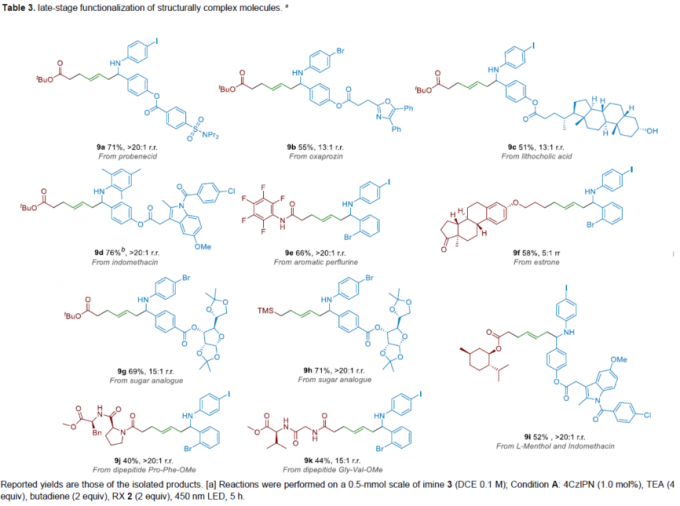
之后,该小组通过如下的一系列研究进一步表明,这一全新的自由基交叉偶联策略具有潜在的合成应用价值(Table 3)。
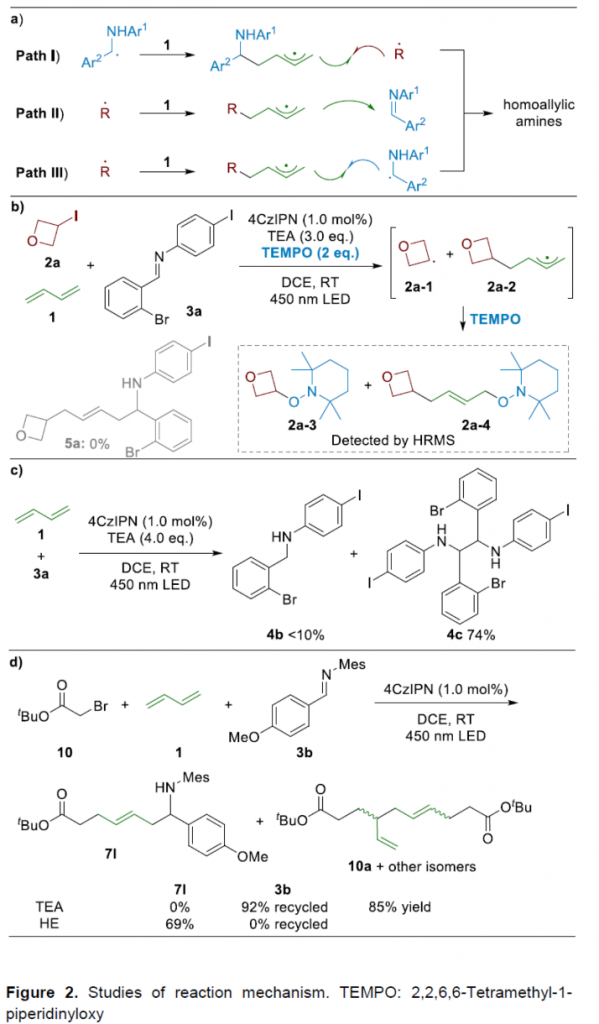
接下来,作提出如下三种可能的反应机理 (Figure 2a)。同时,该小组通过一系列相关的实验研究 (Figure 2b and 2d),进而排除path I与path II。由此表明,反应过程中主要涉及path III的机理路径。
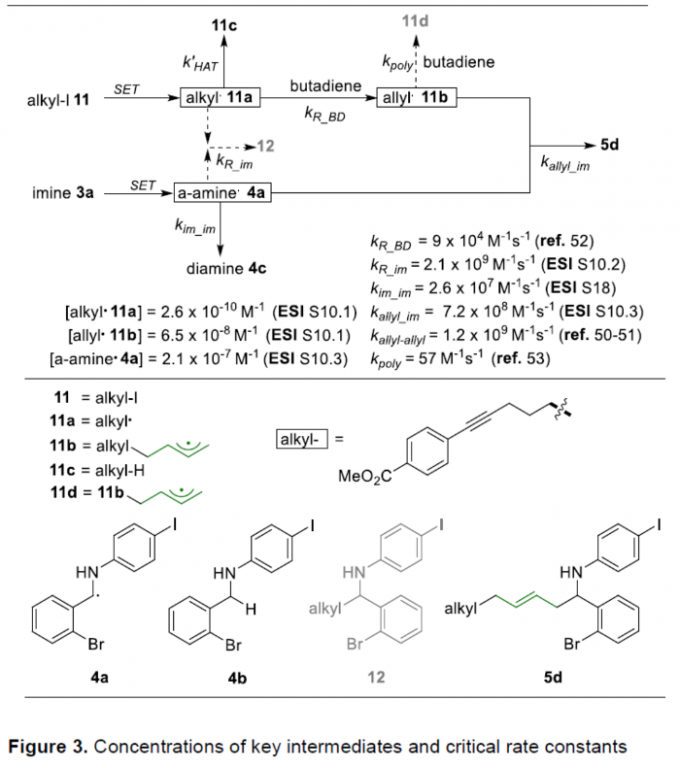
同时,该小组通过一系列动力学实验,对于上述反应过程中自由基中间体的反应活性进行进一步研究(Figure 3)。进而提出,反应过程中PRE (persistent radical effect)[11]-[16]的作用较为关键。
总结
大连理工大学的石磊、廖骞与河南师范大学的郝二军团队共同报道一种全新的光氧化还原催化的α-氨基烷基自由基与瞬态烯丙基自由基之间的自由基交叉偶联反应方法学,进而成功完成一系列高烯丙基胺分子的构建这一全新的自由基偶联合成转化策略具有广泛的底物应用范围与优良的官能团兼容性以及良好的合成应用价值等优势。
参考文献
- [1] (a) C. O. Puentes, V. Kouznetsov, J. Heterocyclic Chem. 2002, 39, 595. doi: 10.1002/jhet.5570390401.
- (b) L. S. Hutchings Goetz, C. Yang, J. W. B. Fyfe, T. N. Snaddon, Angew. Chem. Int. Ed. 2020, 59, 17556. doi: 10.1002/anie.202005151.
- (c) Y. Yuan, X. Han, F. Zhu, J. Tian, F. Zhang, X. Zhang, Y. Tu, S. Wang, X. Guo, Nat. Commun. 2019, 10, 3394. doi: 10.1038/s41467-019-11382-8.
- [1] M. Yus, J. C. González-Gómez, F. Foubelo, Chem. Rev. 2013, 113, 5595. doi: 10.1021/cr400008h.
- [2] M. Yus, J. C. González-Gómez, F. Foubelo, Chem. Rev. 2011, 111, 7774. doi: 10.1021/cr1004474.
- [3] L. Qi, Y. Chen, Angew. Chem. Int. Ed. 2016, 55, 13312. doi: 10.1002/anie.201607813.
- [4] D. Vasu, A. L. Fuentes De Arriba, J. A. Leitch, A. de Gombert, D. J. Dixon, Chem. Sci. 2019, 10, 3401. doi:10.1039/C8SC05164J.
- [5] A. L. Fuentes De Arriba, F. Urbitsch, D. J. Dixon, Chem. Commun. 2016, 52, 14434. doi: 10.1039/C6CC09172E.
- [6] Y. Xiong, G. Zhang, J. Am. Chem. Soc. 2018, 140, 2735. doi: 10.1021/jacs.7b12760.
- [7] P. Wang, X. Wu, Y. Cheng, M. Jiang, W. Xiao, J. Chen, Angew. Chem. Int. Ed. 2021, 60, 22956. doi:10.1002/anie.202110084.
- [8] F. Lu, L. Lu, G. He, J. Bai, W. Xiao, J. Am. Chem. Soc. 2021, 143, 4168. doi: 10.1021/jacs.1c01260.
- [9] F. Li, S. Lin, Y. Chen, C. Shi, H. Yan, C. Li, C. Wu, L. Lin, C. Duan, L. Shi, Angew. Chem. Int. Ed. 2021, 60, 1561. doi: 10.1002/anie.202010780.
- [10] H. Huang, P. Bellotti, P. M. Pflüger, J. L. Schwarz, B. Heidrich, F. Glorius, J. Am. Chem. Soc. 2020, 142, 10173. doi:10.1021/jacs.0c03239.
- [11] D. Leifert, A. Studer, Angew. Chem. Int. Ed. 2020, 59, 74. doi: 10.1002/anie.201903726.
- [12] Y. Li, A. Studer, Angew. Chem. Int. Ed. 2012, 51, 8221. doi: 10.1002/anie.201202623.
- [13] M. Hartmann, Y. Li, A. Studer, J. Am. Chem. Soc. 2012, 134, 16516. doi: 10.1021/ja307638u.
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载






















No comments yet.