本文作者:杉杉
导读
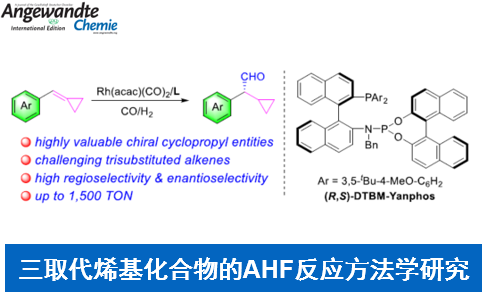
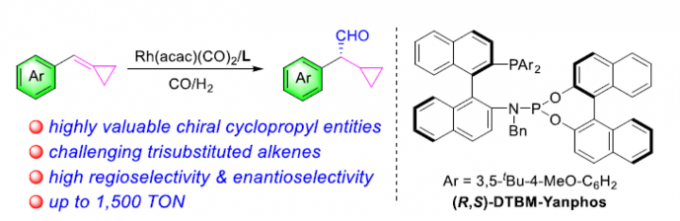
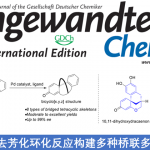
近日,南方科技大学的张绪穆、白绍涛课题组在Angew. Chem. Int. Ed.中发表论文,报道首例通过铑-(R,S)-DTBM-Yanphos催化剂促进的采用环丙基官能团化的三取代烯基化合物参与的高度化学选择性、区域选择性与对映选择性氢甲酰化反应方法学,进而成功完成一系列具有环丙基结构单元的手性醛分子的构建。
Chemo-, Regio- and Enantioselective Hydroformylation of Cyclopropyl-Functionalized Trisubstituted Alkenes
Li, D. Zhang, R. Zhang, S. Bai, X. Zhang, Angew. Chem. Int. Ed. 2022, ASAP. doi:10.1002/anie.202206577.
正文
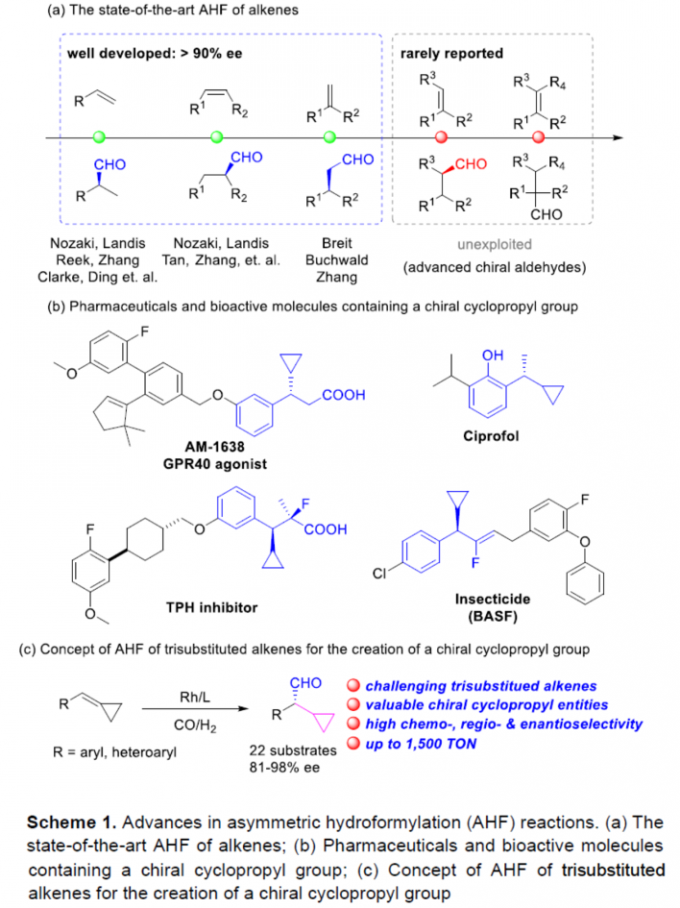
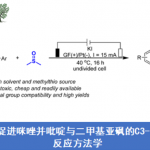
过渡金属催化的AHF (asymmetric hydroformylation) 反应反法学目前已经受到诸多研究团队的广泛关注(Scheme 1a) [1]-[8]。然而,对于三取代烯基化合物参与的AHF反应反法学,却较少有相关的文献报道[9]-[10]。同时,具有环丙基结构单元的手性分子 (Scheme 1b)的构建,同样面临巨大的挑战[11]-[14]。这里,南方科技大学的张绪穆、白绍涛课题组成功设计出首例通过铑-(R,S)-DTBM-Yanphos催化剂促进的采用环丙基官能团化的三取代烯基化合物参与的高度化学选择性、区域选择性与对映选择性氢甲酰化反应方法学 (Scheme 1c)。
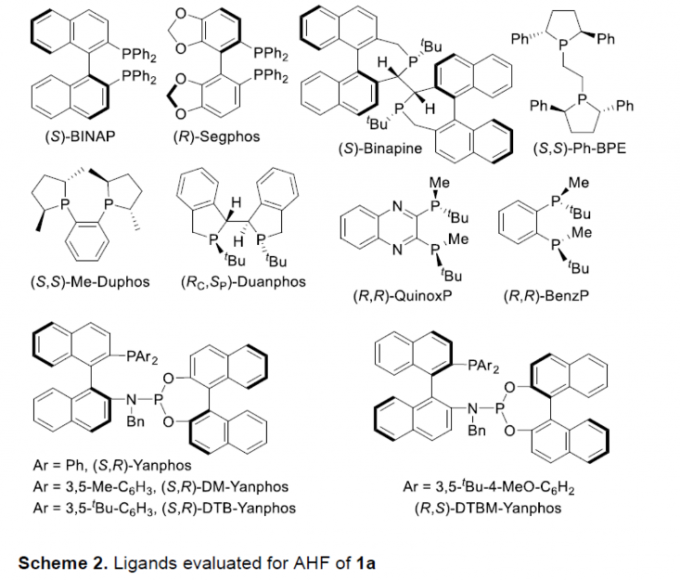
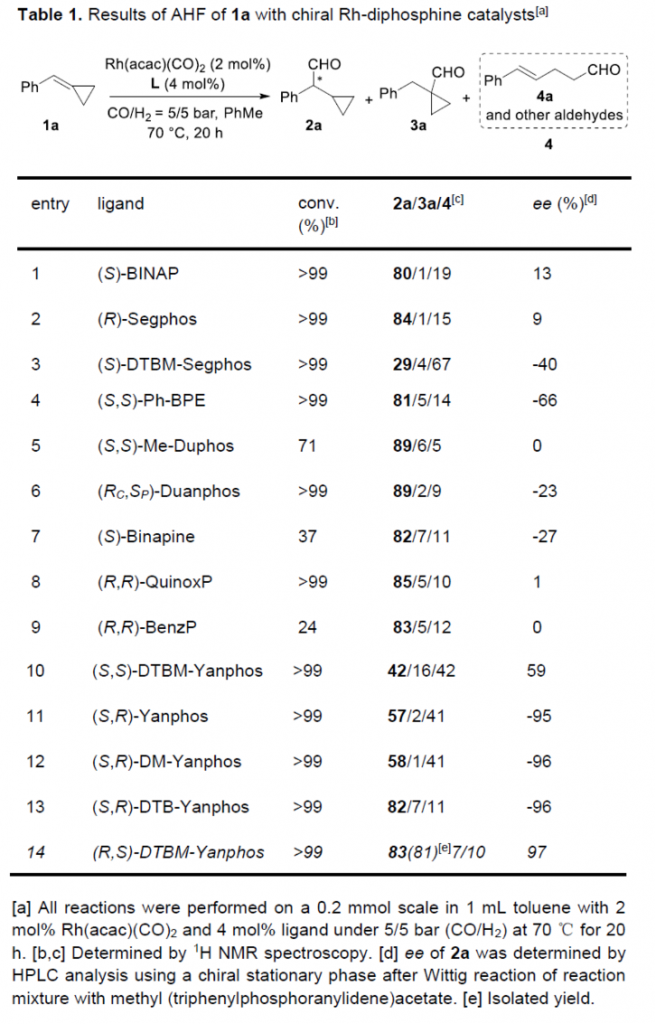
首先,作者采用三取代烯基化合物1a作为模型底物,进行相关反应条件的优化筛选 (Table 1)。进而确定最佳的反应条件为:采用Rh(acac)(CO)2作为催化剂,(R,S)-DTBM-Yanphos作为手性配体,甲苯作为反应溶剂,CO与H2压力均为5 bar,反应温度为70oC,最终获得83%收率的手性产物2a (97% ee)。
在上述的最佳反应条件下,作者分别对一系列三取代烯基底物 (Scheme 3)的应用范围进行深入研究。
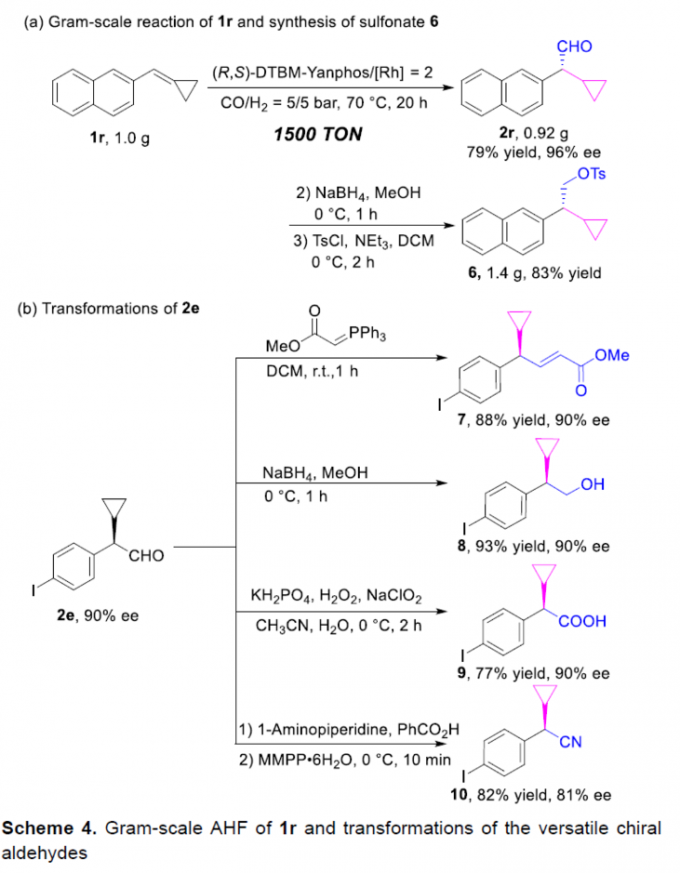
之后,该小组通过如下的一系列研究进一步表明,这一全新的AHF策略具有良好的合成应用价值 (Scheme 4)。
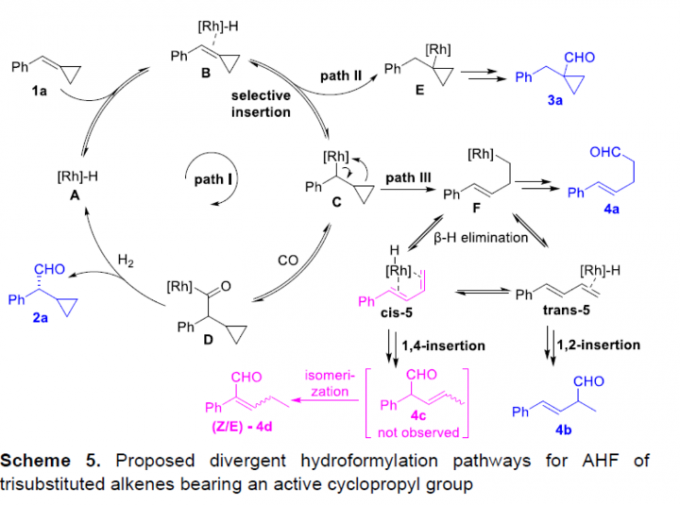
接下来,基于前期相关的文献报道[15]-[16],作者提出如下合理的反应机理 (Scheme 5)。
总结
南方科技大学的张绪穆、白绍涛研究团队成功设计出首例通过铑-(R,S)-DTBM-Yanphos催化剂促进的采用环丙基官能团化参与的三取代烯基化合物的高度化学选择性、区域选择性与对映选择性氢甲酰化反应方法学,进而成功完成一系列具有环丙基结构单元的手性醛分子的构建。这一全新的AHF策略具有广泛的底物范围、优良的官能团兼容性以及优良的对映选择性等优势。
参考文献
- [1] N. Sakai, S. Mano, K. Nozaki, H. Takaya, J. Am. Chem. Soc. 1993, 115, 7033. doi: 10.1021/ja00068a095.
- [2] A. C. Brezny, C. R. Landis, J. Am. Chem. Soc. 2017, 139, 2778. doi: 10.1021/jacs.6b12533.
- [3] (a) A. T. Axtell, C. J. Cobley, J. Klosin, G. T. Whiteker, A. Zanotti-Gerosa, K. A. Abboud, Angew. Chem. Int. Ed. 2005, 44, 5834. doi: 10.1002/anie.200501478.
- (b) X. Zheng, B. Cao, T. Liu, X. Zhang, Adv. Synth. Catal. 2013, 355, 679. doi: 10.1002/adsc.201200960.
- [4] C. You, S. Li, X. Li, J. Lan, Y. Yang, L. Chung, H. Lv, X. Zhang, J. Am. Chem. Soc. 2018, 140, 4977. doi:10.1021/jacs.8b00275.
- [5] G. M. Noonan, J. A. Fuentes, C. J. Cobley, M. L. Clarke, Angew. Chem. Int. Ed. 2012, 51, 2477. doi:10.1002/anie.201108203.
- [6] C. Schmitz, K. Holthusen, W. Leitner, G. Franciò, ACS Catal. 2016, 6, 1584. doi: 10.1021/acscatal.5b02846.
- [7] X. Wang, S. L. Buchwald, J. Am. Chem. Soc. 2011, 133, 19080. doi: 10.1021/ja2092689.
- [8] M. Jouffroy, R. Gramage-Doria, D. Armspach, D. Semeril, W. Oberhauser, D. Matt, L. Toupet, Angew. Chem. Int. Ed. 2014, 53, 3937. doi: 10.1002/anie.201311291.
- [9] J. Eshon, F. Foarta, C. R. Landis, J. M. Schomaker, J. Org. Chem. 2018, 83, 10207. doi: 10.1021/acs.joc.8b01431.
- [10] T. Shin, H. Kim, S. Kim, A. Lee, M. S. Seo, J. Choi, H. Kim, H. Kim, Org. Lett. 2019, 21, 5789. doi:10.1021/acs.orglett.9b01639.
- [11] (a) D. Wang, N. Zhu, P. Chen, Z. Lin, G. Liu, J. Am. Chem. Soc. 2017, 139, 15632. doi: 10.1021/jacs.7b09802.
- (b) L. Liu, K. Guo, Y. Tian, C. Yang, Q. Gu, Z. Li, L. Ye, X. Liu, Angew. Chem. Int. Ed. 2021, 60, 26710. doi:10.1002/anie.202110233.
- [12] (a) V. M. Shoba, J. M. Takacs, J. Am. Chem. Soc. 2017, 139, 5740. doi: 10.1021/jacs.7b02581.
- (b) Q. Zhao, X. Wu, F. Yang, P. Yan, J. Xie, Q. Zhou, Org. Lett. 2021, 23, 3593. doi: 10.1021/acs.orglett.1c00993.
- [13] S. Aichhorn, R. Bigler, E. L. Myers, V. K. Aggarwal, J. Am. Chem. Soc. 2017, 139, 9519. doi: 10.1021/jacs.7b05880.
- [14] R. Takechi, T. Nishimura, Chem. Commun. 2015, 51, 8528. doi: 10.1039/C5CC02140E.
- [15] S. Simaan, I. Marek, J. Am. Chem. Soc. 2010, 132, 4066. doi: 10.1021/ja100544c.
- [16] (a) L. A. Aronica, P. Raffa, A. M. Caporusso, P. Salvadori, J. Org. Chem. 2003, 68, 9292. doi: 10.1021/jo0351062.
- (b) Q. Zhu, Y. Luo, Y. Guo, Y. Zhang, Y. Tao, J. Org. Chem. 2021, 86, 5463. doi: 10.1021/acs.joc.0c02987.
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载















No comments yet.