碳原子之间单键形成的的方法,大家知道几种啊?
用亲电试剂及亲核试剂的当量反应,金属催化的偶联反应等等,还是有不少呢。瞄准分子内的哪一位置,以哪种方式的碳碳键形成的反应,作为化学工作者的话,或多或少还是有些经验的吧。
周期表上罗列的元素,如果能像乐高积木一样随意组合的话,绝对是化学家的梦想。
各种各样研究领域中,键与键之间若能够随心所欲的切断、形成,这样的技术一旦确立的话,并且不断扩大应用范围,一定会发展成为最前沿的化学研究,有着非常大的潜力。我们可以说,掌握键的形成是最基础的终极化学策略。
不。。过。。呢。。实际上还是有很多限制的。
硼-硼键的强度
随着近年来令人眼花缭乱的技术的发展、碳-碳键的形成已经产生了非常多种方法。
但是,相比之下硼-硼键的形成方法,大家又知道多少呢?
一般来说,B-B单键解离能估计是293 KJ/mol 左右,这个数值相比起碳-碳单键的345 KJ/mol)较小,而相比其硅-硅单键的(222 KJ/mol)大出很多,可以看出,B-B键算是比较强的键之一。
然而,B-B键的精密形成方法相比于碳键非常有限。
即使使用现代的合成技术,方便快捷的形成B-B键也比较困难。
首先,反应物的前体大都处理操作比较困难,另外,常伴有未知的副反应、导致反应收率非常低,所以比起预想的,反应实际上通常很难顺利进行。这其中的理由之一:硼的2P轨道,空的轨道反倒非常碍事,
另一方面,如果能很好的控制这个空轨道,那么开发硼-硼键的巧妙方法就会很快攻克。
那么,这一次,我们就B-B键形成的化学,就其相关的研究成果来看看近些年这一领域的发展状况。
B-B单键的形成方法
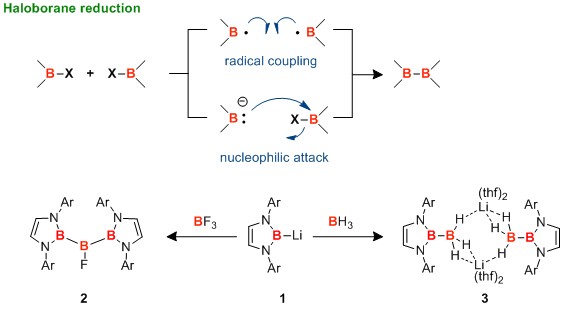
首先,作为B-B键形成的经典方法:「haloborane的还原偶联」。是工业生产二硼化合物时使用的方法,不过,该反应中要用到强还原剂,不但对官能团有局限性,还会因为过度还原导致反应收率低下。
另外,详细的反应机理尚不明确,人们提出了以下两种可能反应机理:
(1)通过单电子还原发生的硼自由基之间的偶联
(2)通过双电子还原发生的硼负离子的亲核取代
就机理(2)来说,可以分离得到的硼负离子1和BF3的反应,生成化合物2,这样的例子已经被报道过。[1] 然后通过类似的反应,合成具有B(sp2)-B(sp3)键的化合物3,作为还原剂利用的反应实例也有报道。[2]
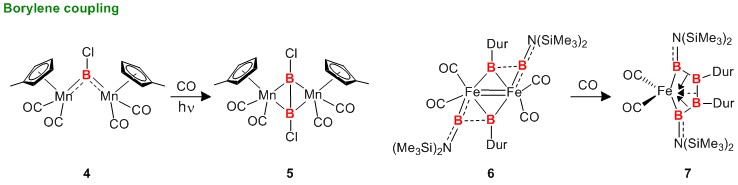
之后,还有一些特例,比如Borylene(亚硼烷基)–过渡金属络合物中,亚硼烷基配体之间通过偶联形成B-B键的方法也有阐述。Braunschweig等人报道了,在一氧化碳气氛下,锰络合物4被光照后,两个硼通过桥键形成化合物5。[3] 另外,类似的条件下铁络合物6通过加热,成功合成了4个硼之间锁链状相连的络合物7。[4]
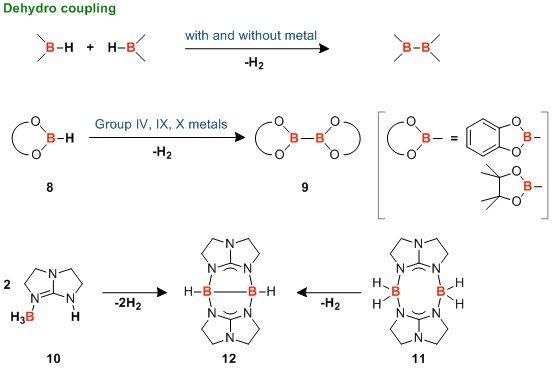
下面的例子,用的方法是硼化氢的脱氢偶联反应。
Braunschweig等人,利用均相和非均相催化剂,将片呐醇硼烷和儿茶酚硼烷8催化偶联,实现双硼化合物9的合成。[5] 在这里,常用的金属是镍,铂,钯等等。这个反应中,没有用容易水解的硼卤化合物做原料出发,应该是相对来说比较容易操作的反应。另外,在这个反应上稍花功夫研究的话,感觉能够实现不同硼与硼之间的不对称双硼化合物的偶联反应。
另外,Himmel等人,由含有NH键的碱加和的硼化合物(BH3)10的二聚,得到两个螯合配体稳定了的双硼化合物12。[6] 而该化合物也可由化合物11的脱氢化反应来获得。
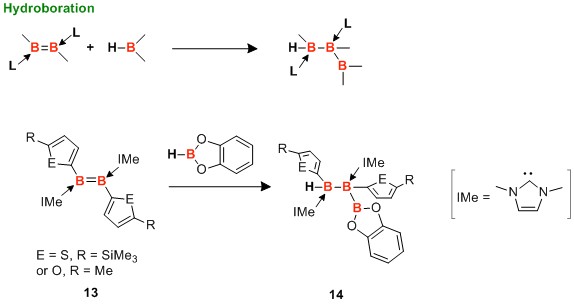
直到最近,化学家们才实现双硼化合物的硼氢化新型反应。[7] 碳碳不饱和键的硼氢化反应是发展很久,且非常经典的有机反应之一。要是针对硼-硼不饱和键也能有相似的反应的话,一定很有意思。利用不対称的双硼烯,实现位置选择性应该非常有意思吧。所以也不一定用双硼烯13作为反应底物,这个方法的亮点是一步反应可以形成含三个硼的化合物结构14。
到这里,介绍的都是合成硼硼键的中性产物。
而下面呢,主要是还原条件下通过B-B键形成,合成双硼烷负二价离子的方法。
具有B-B单键的负二价离子的合成
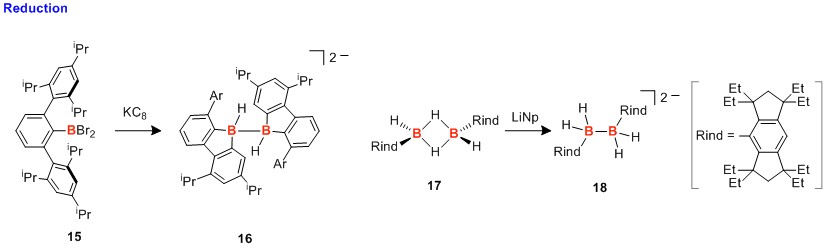
1996年,Power等人报道了,由三联苯基取代的二溴硼烷15与掺钾石墨烯反应,生成含硼芴的二聚体16。[8] 硼原子是sp3杂化形式,不难发现两个硼原子与乙烷碳是等电子状态。形成负二价离子虽然会使电子排斥增加,但与负离子自由基相比起,成键会稳定。
另外,具有B-H-B键的二硼烷17与萘基锂反应,得到化合物18。[9] 因为前体的两个B-H-B桥键,硼附近的电子富裕堆积,在此处给出电子能形成B-B键。由这个反应获得的灵感,两个硼原子接近的时候,给他们加上电子,就能够在硼与硼之间成键。
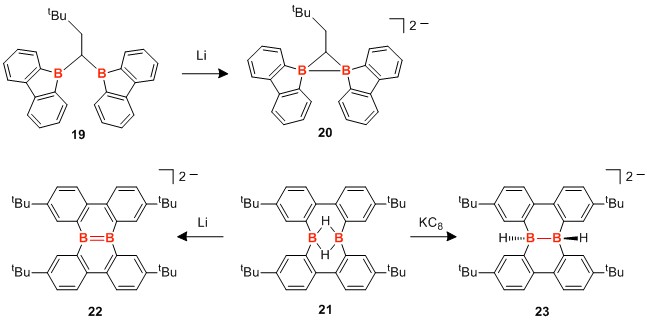
Wagner等人,针对不含B-H-B键的前体19,用同样的方法打造B-B键(化合物20)的方法也被报道。[10]
之后,利用π共轭分子夹杂硼单元的化合物21,通过与还原金属作用,成功选择性的形成了双键结构22和单键结构23。[11]
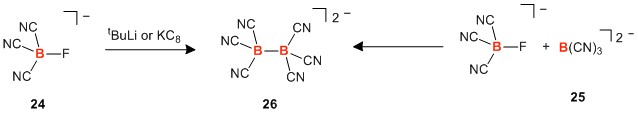
最后,Finze、Bernhardt等人,通过borate24的还原偶联得到六氰基二硼负二价离子26。[12] 化合物26可以分别由24和25反应得到,通过同位素标记实验,25并不是作为还原剂而是亲核试剂来反应的,反应的可能机理是SN2机理。
总结
本文很简要的介绍了一下硼-硼键形成反应的发展现状,正如所看到的,特殊反应体系居多。为了建立普遍适用性较高的反应方法,目前的现状就是得先得着眼于基础研究一点点拓宽范围。硼的电负性和价电子数目与碳不同,导致B-B键可以成直链状,支链等多种自由自在相互组合,利用这一特点来开发新的功能型分子。从最简单的单键来深入研究,其实是可以拓宽新化学领域,它的未来也值得我们期待。
参考文献
- Y. Hayashi, Y. Segawa, M. Yamashita, K. Nozaki, Chem. Commun., 2011, 47, 5888–5890. DOI: 10.1039/C1CC11334H
- K. Nozaki, Y. Aramaki, M. Yamashita, S.-H. Ueng, M. Malacria, E. Lacôte, D. P. Curran, J. Am. Chem. Soc., 2010, 132, 11449–11451. DOI: 10.1021/ja105277u
- (a) H. Braunschweig, R. Shang, Inorg. Chem., 2015, 54, 3099−3106. DOI: 10.1021/acs.inorgchem.5b00091; (b) K. K. Pandey, H. Braunschweig, R. D. Dewhurst, Eur. J. Inorg. Chem., 2011, 2045–2056. DOI: 10.1002/ejic.201001200; (c) H. Braunschweig, M. Colling, C. Hu, K. Radacki, Angew. Chem. Int. Ed., 2002, 41, 1359–1361. DOI: 10.1002/1521-3773(20020415)
- H. Braunschweig, Q. Ye, A. Vargas, R. D. Dewhurst, K. Radacki, A. Damme, Nat. Chem., 2012, 4, 563–567. DOI:10.1038/nchem.1379
- H. Braunschweig, F. Guethlein, Angew. Chem. Int. Ed., 2011, 50, 12613–12616.
- (a) N. Schulenberg, H. Wadepohl, H. J. Himmel, Angew. Chem. Int. Ed., 2011, 50, 10444–10447. DOI: 10.1002/anie.201104834; (b) N. Schulenberg, O. Ciobanu, E. Kaifer, H. Wadepohl, H.-J. Himmel, Eur. J. Inorg. Chem., 2010, 5201–5210. DOI: 10.1002/ejic.201000637; (c) O. Ciobanu, E. Kaifer, M. Enders, H.-J. Himmel, Angew. Chem. Int. Ed., 2009, 48, 5538–5541; DOI: 10.1002/anie.200901842.
(d) O. Ciobanu, P. Roquette, S. Leingang, H. Wadepohl, J. Mautz, H.-J. Himmel, Eur. J. Inorg. Chem., 2007, 4530–4534. DOI: 10.1002/ejic.200700507 - H. Braunschweig, R. D. Dewhurst, C. Hörl, A. K. Phukan, F. Pinzner, S. Ullrich, Angew. Chem. Int. Ed., 2014, 53, 3241–3244. DOI: 10.1002/anie.201309325
- W. J. Grigsby, P. P. Power, J. Am. Chem. Soc., 1996, 118, 7981−7988. DOI: 10.1021/ja960918j
- (a) Y. Shoji, S. Kaneda, H. Fueno, K. Tanaka, K. Tamao, D. Hashizume, T. Matsuo, Chem. Lett. 2014, 43, 1587−1589. DOI: org.10.1246/cl.140507; (b) Y. Shoji, T. Matsuo, D. Hashizume, M. J. Gutmann, H. Fueno, K. Tanaka, K. Tamao, J. Am. Chem. Soc., 2011, 133, 11058−11061. DOI: 10.1021/ja203333j
- A. Hübner, T. Kaese, M. Diefenbach, B. Endeward, M. Bolte, H.-W. Lerner, M. C. Holthausen, M. Wagner, J. Am. Chem. Soc., 2015, 137, 3705−3714. DOI: 10.1021/jacs.5b01192
- T. Kaese, A. Hübner, M. Bolte, H.-W. Lerner, M. Wagner, J. Am. Chem. Soc., 2016, 138, (ASAP). DOI: 10.1021/jacs.6b02303.
- J. Landmann, J. A. P. Sprenger, M. Hailmann, V. Bernhardt-Pitchougina, H. Willner, N. Ignat’ev, E. Bernhardt, M. Finze, Angew. Chem. Int. Ed., 2015, 54, 11259–11264. DOI: 10.1002/anie.201504579
相关书籍
[amazonjs asin=”B00HHUPJR0″ locale=”CN” title=”硼碳和硼氮化合物”] [amazonjs asin=”B00495YZNK” locale=”CN” title=”硼化合物手册”]
相关动画
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!


















No comments yet.