本文作者:杉杉
导读
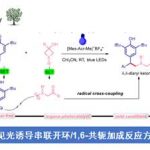
近日,清华大学的席婵娟课题组在ACS Catal.中发表论文,报道一种全新的采用光氧化还原/镍双重催化体系促进的通过各类烯丙醇底物参与的羧基化反应方法学,进而以良好的E-立体选择性,成功完成一系列线性羧酸分子的构建。
Direct C-C Bond Formation of Allylic Alcohols with CO2 toward Carboxylic Acids by Photoredox/Nickel Dual Catalysis
Fan, S. Chen, S. Zou, C. Xi, ACS Catal. 2022, 12, 2781. doi: 10.1021/acscatal.2c00418.
正文
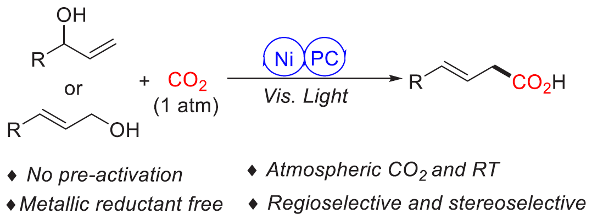
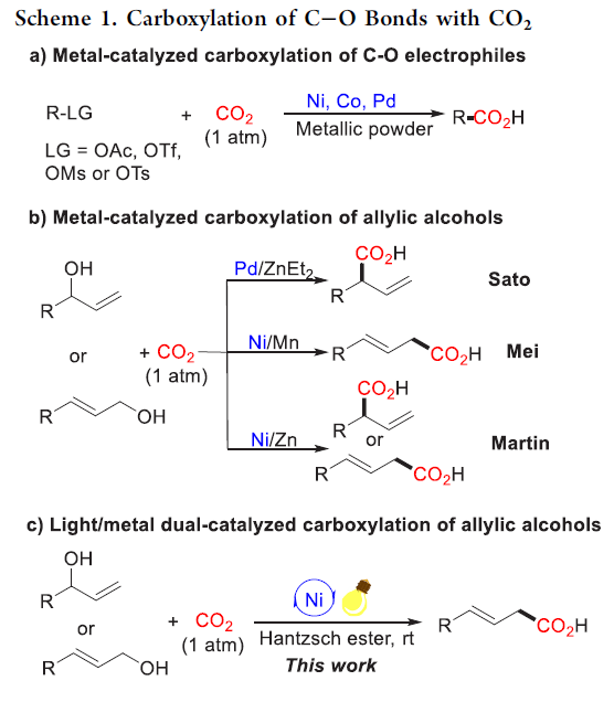
目前,通过二氧化碳参与的有机合成转化反应方法学研究已经开始受到诸多团队的广泛关注[1]-[7](Scheme 1)。这里,受到近年来对于光/金属双重催化的羧基化反应方法学[8]以及通过可见光光氧化还原催化体系促进的苄基 C-O键羧基化反应方法学[9]相关研究报道的启发,清华大学的席婵娟团队成功设计一种全新的采用光氧化还原/镍双重催化体系促进的通过一系列烯丙醇分子参与的羧基化反应方法学 (Scheme 1c)。
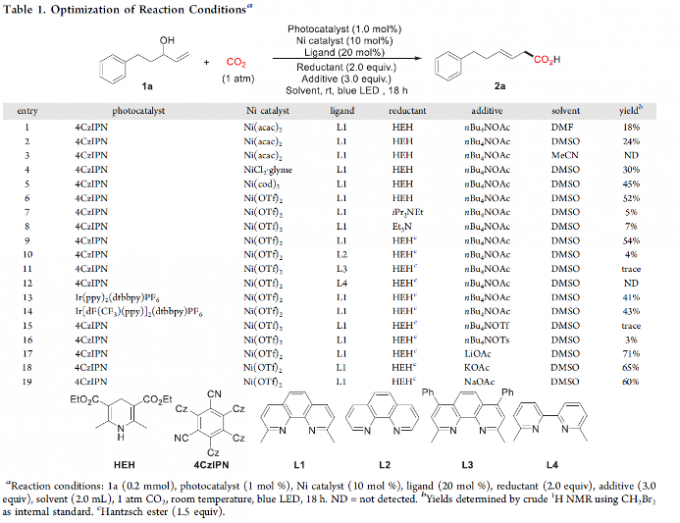
首先,作者采用烯丙醇衍生物1a与作为模型底物,进行相关反应条件的优化筛选 (Table 1)。进而确定最佳的反应条件为:采用4CzIPN作为光催化剂,Ni(OTf)2作为金属催化剂,neocuproine (L1)作为配体,CO2气体压力为1 atm,LiOAc作为添加剂,HEH (Hantzsch ester)作为还原剂,DMSO作为反应溶剂,蓝光LED辐射,反应温度为室温,最终获得71%收率的羧基化产物2a。同时,研究发现,上述的羧基化反应过程中表现出优良的区域选择性(>99:1)与良好的立体选择性 (E/Z > 15:1)。
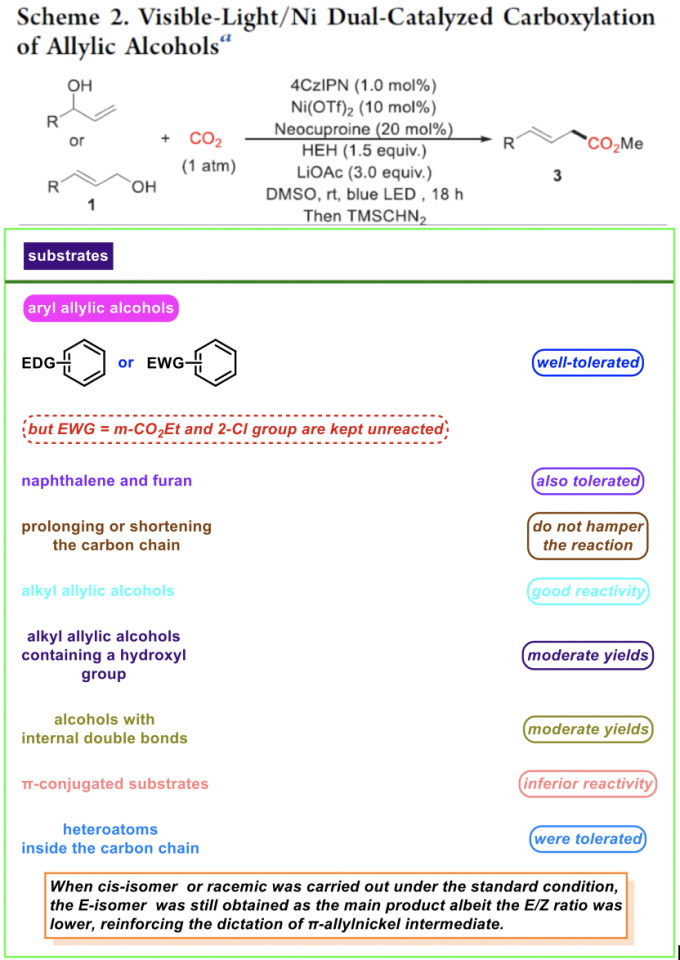
在上述的最佳反应条件下,作者对一系列烯丙醇衍生物的应用范围进行考察(Scheme 2)。同时,为便于后续的分离纯化,作者将羧酸产物进一步转化为相应的甲酯。
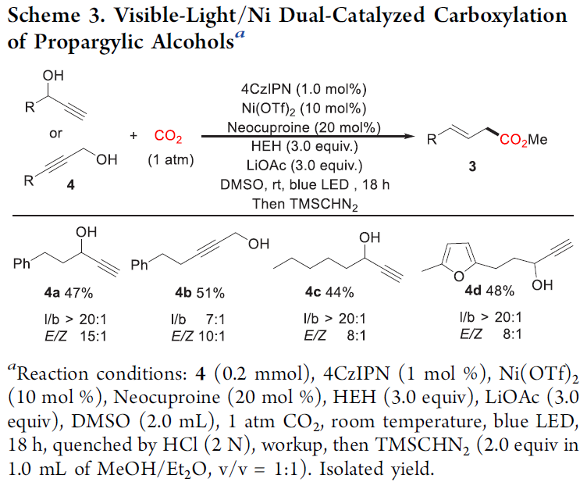
接下来,作者发现,通过增加还原剂的用量,能够进一步将上述的羧基化策略应用于各类炔丙醇底物(Scheme 3)。
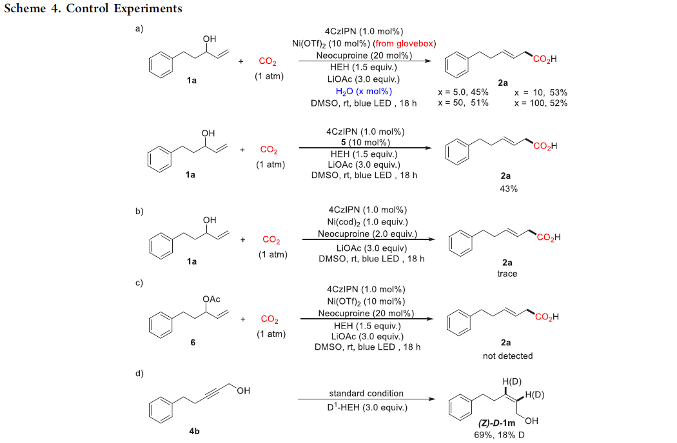
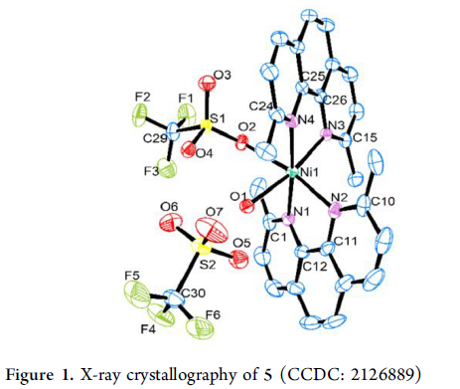
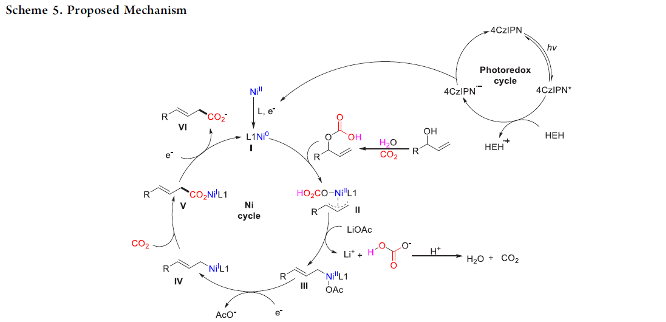
接下来,作者通过一系列控制实验的相关研究以及配合物5的X射线晶体学分析 (Scheme 4)表明,水对于上述的羧基化反应过程的顺利进行较为关键 (Scheme 4a, top and bottom)。同时,反应过程中可能涉及NiI中间体的形成 (Scheme 4b),而烯丙酯可能无法直接通过醇与LiOAc之间的反应而形成 (Scheme 4c)。而且,上述的羧基化过程中同样涉及通过Ni-H参与的金属氢化步骤。之后,该小组进一步研究发现,HEH同样能够作为反应过程中的氢供体 (Scheme 4d)。并且,HCO3–与LiOAc之间的配体交换过程对于稳定型中间体的形成同样较为关键。
基于上述的实验研究以及前期相关的文献报道[10],作者提出如下合理的反应机理 (Scheme 5)。
总结
清华大学的席婵娟课题组成功设计出一种全新的采用光氧化还原/镍双重催化体系促进的通过烯丙醇化合物参与的羧基化反应方法学,进而以良好的E-立体选择性成功完成一系列线性羧酸分子的构建。这一全新的羧基化策略具有温和的反应条件以及良好的立体选择性等优势。
参考文献
- [1] M. Aresta, A. Dibenedetto, A. Angelini, Chem. Rev. 2014, 114, 1709. doi: 10.1021/cr4002758.
- [2] A. Correa, T. León, R. Martin, J. Am. Chem. Soc. 2014, 136, 1062. doi: 10.1021/ja410883p.
- [3] K. Nogi, T. Fujihara, J. Terao, Y. Tsuji, J. Org. Chem. 2015, 80, 11618. doi: 10.1021/acs.joc.5b02307.
- [4] Y. Liu, J. Cornella, R. Martin, J. Am. Chem. Soc. 2014, 136, 11212. doi: 10.1021/ja5064586.
- [5] T. Mita, Y. Higuchi, Y. Sato, Chem. Eur. J. 2015, 21, 16391. doi: 10.1002/chem.201503359.
- [6] Y. G. Chen, B. Shuai, C. Ma, X. J. Zhang, P. Fang, T. S. Mei, Org. Lett. 2017, 19, 2969. doi: 10.1021/acs.orglett.7b01208.
- [7] M. van Gemmeren, M. Börjesson, A. Tortajada, S. Z. Sun, K. Okura, R. Martin, Angew. Chem., Int. Ed. 2017, 56, 6558. doi: 10.1002/anie.201702857.
- [8] C. S. Yeung, Angew. Chem., Int. Ed. 2019, 58, 5492. doi: 10.1002/anie.201806285.
- [9] C. K. Ran, Y. N. Niu, L. Song, M. K. Wei, Y. F. Cao, S. P. Luo, Y. M. Yu, L. L. Liao, D. G. Yu, ACS Catal. 2022, 12, 18. doi: 10.1021/acscatal.1c04921.
- [10] D. Liu, Z. Xu, H. Yu, Y. Fu, Organometallics 2021, 40, 869. doi: 10.1021/acs.organomet.0c00789.
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载


















No comments yet.