本系列内容是为帮助大家能够直面全合成中应克服的困难而编写的。列举了一些在全合成过程中遇到的棘手问题的解决方案,采用了小问答的形式介绍给大家。
第9回小编准备介绍下、Andreas Pfaltz与铃木 启介(Suzuki Keisuke)等人的Macrocidin A的全合成(2010)。
往期内容回顾请戳我~
第九回 问题
该篇的原文献如下所示
“Total Synthesis and Absolute Configuration of Macrocidin A, a Cyclophane Tetramic Acid Natural Product”
Yoshinari, T.; Ohmori, K.; Schrems, M. G.; Pfaltz, A.; Suzuki, K. Angew. Chem. Int. Ed. 2010, 49, 881. DOI: 10.1002/anie.200906362
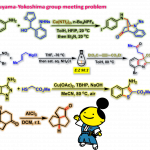
一般来说环化反应难以进行的原因大致是,反应性不够,其他的副反应更快,或者构象限制等。这回终盘运用到类似Dieckmannh环化反应,为了合成目标的大环骨架的结构,而反应没有顺利进行,很大的可能就是由于构象限制。
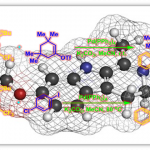
从原料的单晶结构解析[1]可以看出,两个反应位点(活性亚甲基的碳与酯基的羰基碳)离的很远,并且呈s-trans构象。这是环化反应无法顺利进行的原因。因此,才有了在酰胺上加一个保护基团,使得其整个构型变成s-cis,这样两个反应位点就能充分接近。
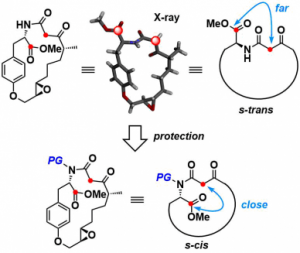
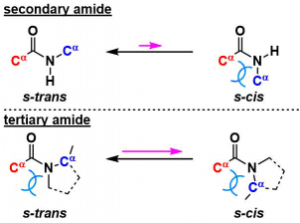
另外,众所周知N-取代后的酰胺具有cis,trans两种异构体,而2级酰胺的话基本上以热稳定性更强的s-trans体为主(立体位阻小)。但是三级酰胺的话,两个构型上立体位阻的差就变得很小了(例如N-酰基脯氨酸,两种构想只有3~4 kJ/mol的能量差),因此3级酰胺相比于2级酰胺,s-cis构象是主要构型。
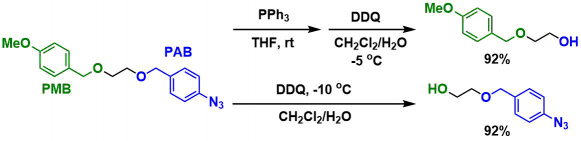
按照这个策略的话,理论上任何保护基都是可以达到目的的,然而这里作者却用了p-叠氮基苯[2]这个不常见的保护基团,同时如问题中所述,如果采用这个保护基,接下来还需要经历①叠氮→胺基(or亚氨基膦)的还原 ②氧化 这两步才能脱保护,从推测来看应该不是最优先考虑的保护基团。
而这次,其实是由于原料中具有不耐酸的环氧环,富电子的芳香环,反应性高的tetramic acid等部位,因此如果保护基采用Bn, PMB等脱保护条件是酸性的话,那些原料中的不耐酸基团都得悲剧。所以,才最终选择了在温和氧化条件下就就能除去的PAB基团。
这次你答对了么?
相关文献
- CCDC 756980
- Fukase, K.; Hashida, M.; Kusumoto, S. Tetrahedron Lett. 1991, 32, 3557. doi:10.1016/0040-4039(91)80832-Q
外部链接
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!














No comments yet.