本文作者:杉杉
导读
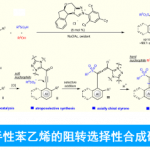
近日,美国Indiana大学M. K. Brown课题组在ACS Catal.中发表论文,报道一种合成高度取代螺环环丁烷的方法,涉及环丁烯的催化芳硼化反应。同时,根据环丁烯的取代基不同,可使用Cu/Pd或Ni催化体系。在Cu/Pd催化反应中,芳基硼化的铜配合物对于高选择性至关重要。此外,作者还对反应的实用性以及反应的机理进行了研究。
Catalytic Arylboration of Spirocyclic Cyclobutenes: Rapid Access to Highly Substituted Spiro[3.n]alkanes
A. K. Simlandy, M. Lyu, M. K. Brown,ACS Catal.2021, 11, 12815.
正文
近年来,对于Csp3中心的构建在药物开发领域备受关注。特别是,刚性和饱和的多环骨架是一种具有价值的结构单元。因此,开发新型的方法用于此类骨架的修饰与构建,对于促进药物的开发具有重要的意义。
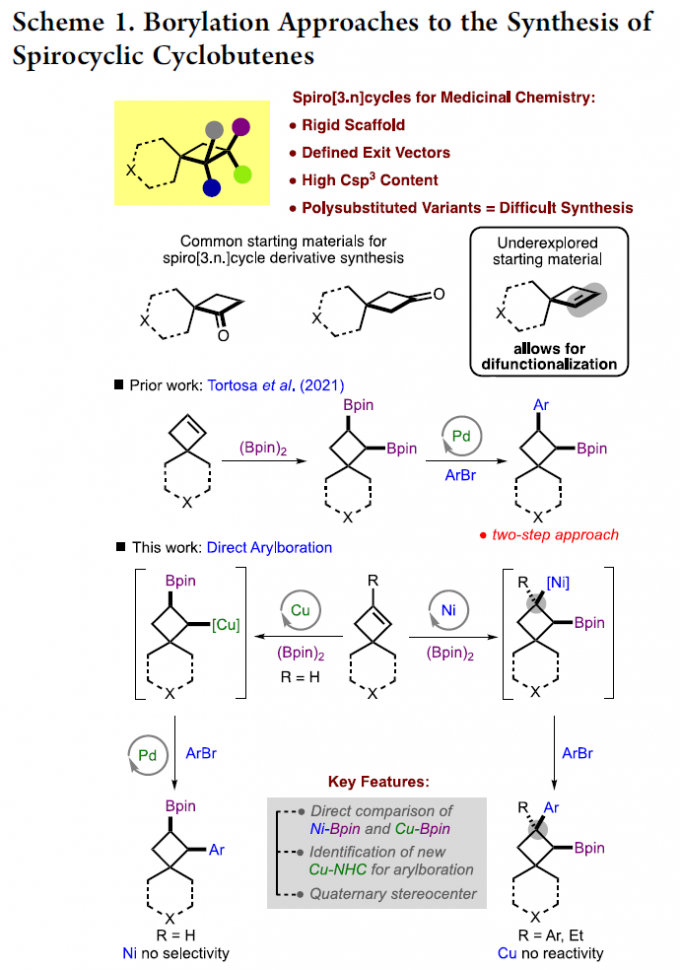
在螺环化合物中,环丁烷衍生物特别具有价值,因为它具有高刚性(Scheme 1)。对于简单的单取代环丁基螺环分子可通过市售的酮来合成,但对于复杂的多取代环丁基螺环分子的合成却很少被研究[1]。基于对烯烃双官能团化反应的兴趣,作者认为螺环环丁烯衍生物也可作为合适的底物。M. K. Brown以及其他课题组也报道了关于烯烃芳硼化反应的策略[2],可生成一系列复杂的分子。作者设想,若能实现螺环环丁烯的官能团化反应,则可实现刚性和复杂的饱和碳环和杂环的构建。在M. Kevin Brown课题组研究过程中,Tortosa课题组报道了一种螺环环丁烯官能团化的方法,涉及双硼化反应,随后在空间位阻较小的C-B键上进行区域选择性交叉偶联,从而可合成许多复杂的分子[3-4]。在此,M. Kevin Brown课题组报道了取代螺环环丁烯的芳基化的“一锅法”反应,并使用两个催化体系来拓宽底物范围。虽然获得的产物与Tortosa工作中产物相似,但它们的取代模式明显不同。值得注意的是,使用该策略可形成以前文献无法获得拥挤的C-C键,如季碳[5]。
在过去的七年里,M. K. Brown课题组已经开发了两种催化体系,可实现各种烯烃的芳硼化反应。其中,Pd/Cu催化体系的对活化烯烃的芳硼化有效,而Ni催化体系对未活化烯烃和某些烯基芳烃有效。同时,作者也报道了一例关于Pd/Cu催化对称环丁烯的芳硼化反应[6]。然而,对于非对称环丁烯底物,存在区域选择性控制的难题,可通过在螺环四元中心附近成键来克服空间问题。
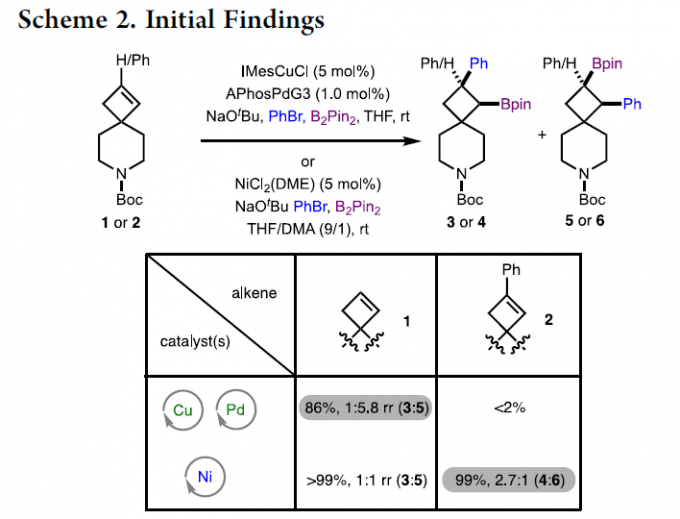
首先,作者采用未取代环丁烯衍生物1和2作为模型底物,分别于Pd/Cu和Ni催化体系中进行了相关芳硼化反应条件的尝试(Scheme 2)。当以环丁烯衍生物1为底物,可在Pd/Cu催化体系中获得86%收率的产物3/5(rr为1:5.8),而在Ni催化体系中获得大于99%收率的产物3/5(rr为1:1)。当以环丁烯衍生物2为底物,仅在Ni催化体系中获得99%收率的产物4/6(rr为2.7:1)。
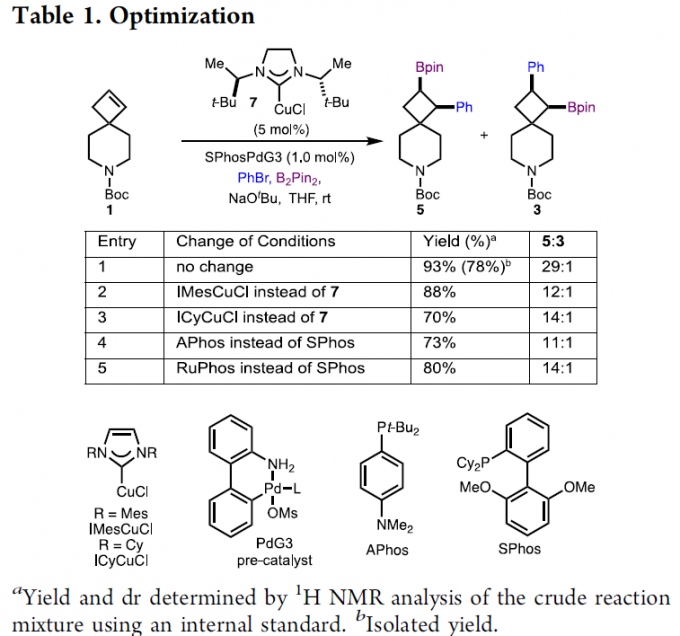
为了进一步提高反应的区域选择性,作者采用环丁烯衍生物1作为模型底物,对催化剂进行了筛选(Table 1)。筛选结果表明,Cu-NHC 7作为铜催化剂,SPhosPd-G3作为钯催化剂,NaOtBu作为碱,在THF溶剂中室温下进行反应,最终获得93%收率的产物5/3(rr为29:1)。
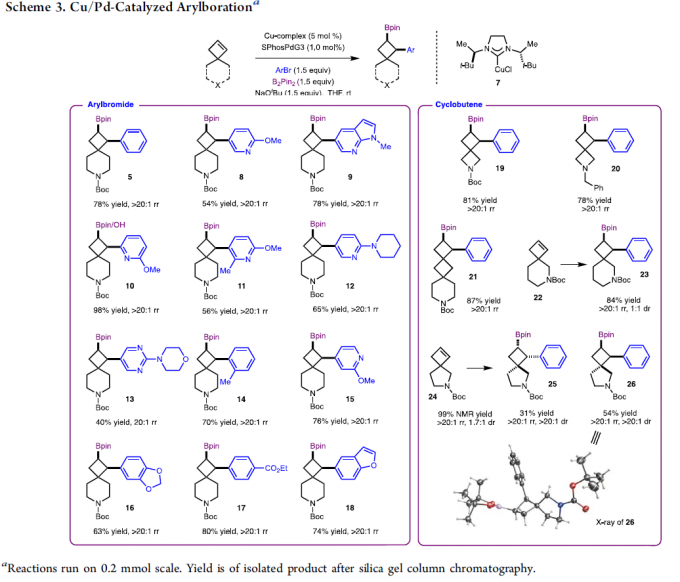
在上述最佳反应条件下,作者对Pd/Cu催化体系下的底物应用范围进行了考察(Scheme 3)。研究表明,带有供电子基与吸电子基取代的芳基溴底物均能较好地与上述反应条件兼容,并获得相应的产物14和16–17,收率为63-80%,rr > 20:1。其次,一系列不同取代的杂环芳基溴底物,也可顺利进行反应,获得相应的杂环产物8–13、15和18,收率为40-98%,rr > 20:1。此外,使用不同环尺寸的螺环环丁烯底物,均可顺利与芳基溴反应,获得产物19–21,收率为78-87%,rr > 20:1。值得注意的是,当使用非对称螺环底物时(如22和24),则会生成非对映异构体。其中,非对映异构体(产物25和26)很容易通过柱层析分离。并且,产物26的相对立体化学结构也通过单晶分析确定。
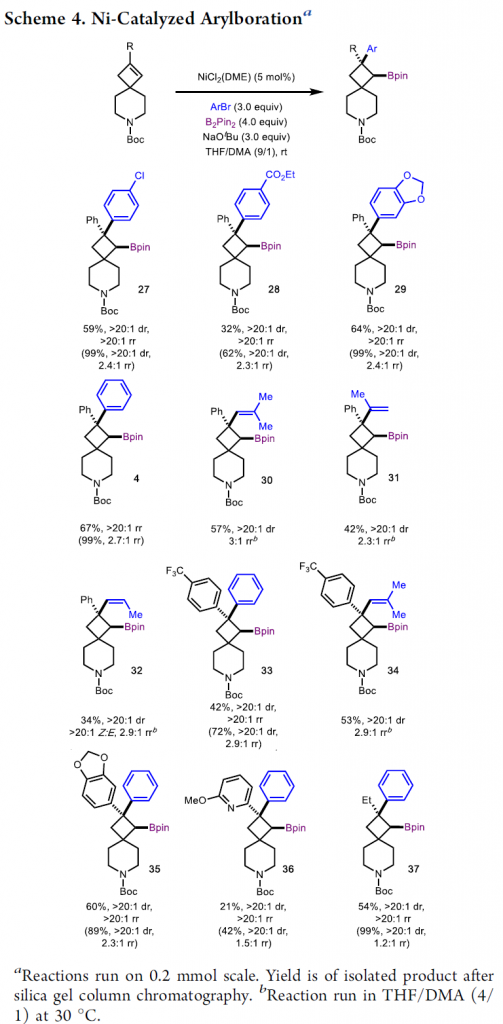
接下来,作者对Ni催化体系下的底物应用范围进行了考察(Scheme 4)。研究表明,一系列不同取代的芳基和烯基溴,均可顺利反应,获得具有四元立体中心的氮杂螺[3.5]壬烷产物4和27–36,且为区域异构体的混合物,可通过柱层析进行分离。值得注意的是,以不同的环丁烯衍生物为底物,可获得两种非对映异构体29和35。此外,烷基取代的环丁烯可获得高收率的产物37,但观察到了1.2:1的区域异构体混合物。
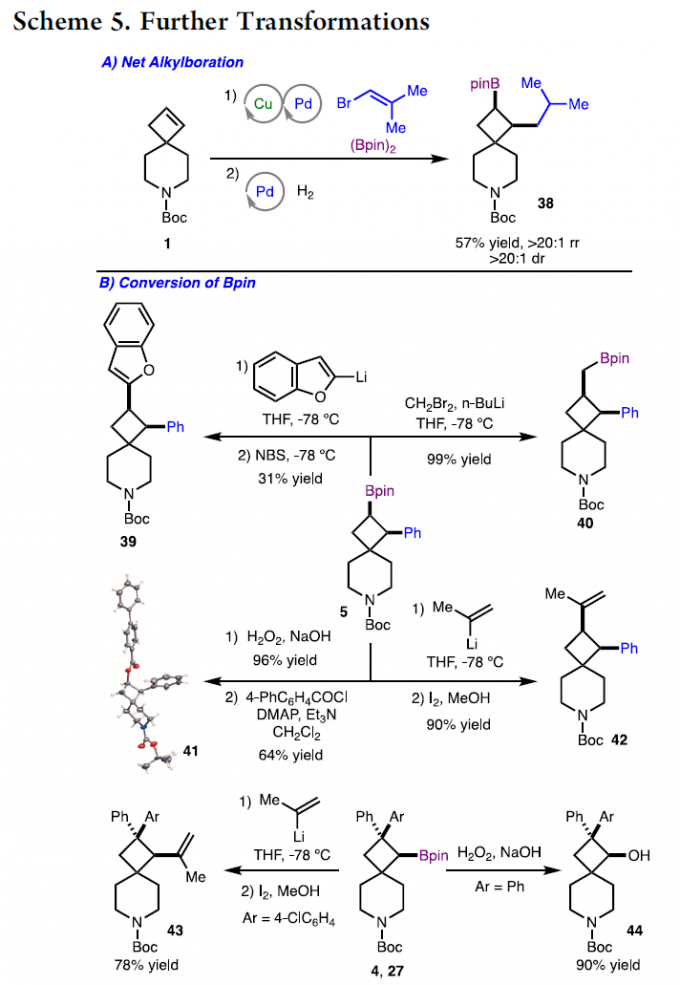
为了进一步研究上述芳硼化反应的实用性,作者进一步对获得的产物进行相应的后期修饰(Scheme 5)。首先,底物1在标准的Pd/Cu催化体系下与烯基溴和(Bpin)2反应,随后再进行氢化反应,可获得烷基产物38,收率为57%,rr > 20:1,dr > 20:1。其次,硼化产物5中的Bpin单元,可进行芳基化(产物39)、Matteson同系化(产物40)、Zweifel烯化(产物42)和氧化反应(产物41)。此外,通过进一步的修饰,还可获得化合物43和44。
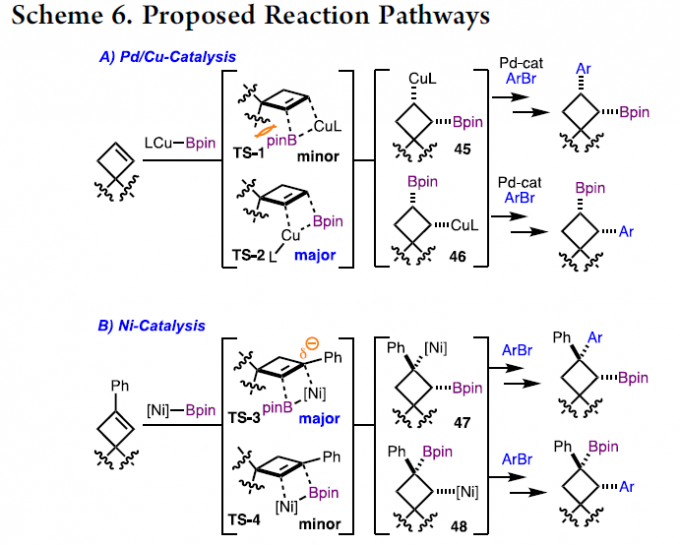
基于的文献报道[7],Pd/Cu催化的反应可能通过烯烃的硼基铜化(borylcupration)过程进行生成的烷基-铜中间体,随后进行Pd催化交叉偶联反应(Scheme 6)。当以螺环环丁烯为底物,硼基铜化(borylcupration)反应可能通过 TS-2进行,生成烷基-铜中间体46。为了使区域选择性结果合理化,Bpin单元和季碳之间的空间挤压(steric pressure)可能不利于TS-1。此外,在Ni催化体系中,螺环环丁烯为底物经硼基镍化 (boryl-nickelation)反应生成烷基镍配合物47,可与Ar-Br反应。在这种情况下,区域选择性可能受苄基位点的稳定形成的电荷(stabilization developing charge)控制,如TS-3。
总结
M. K. Brown课题组报道了一种一锅法实现双取代螺环环丁烷的合成方法。同时,根据环丁烯的取代基不同,可使用Cu/Pd或Ni催化体系,并可获得以前方法无法获得的一系列具有价值的产物。在Cu/Pd催化反应中,芳基硼化的铜配合物对于高选择性至关重要。此外,作者还对反应的实用性以及反应的机理进行了研究。
参考文献
[1] (a) P. R. D. Murray, W. M. M. Bussink, G. H. M. Davies, F. W. van der Mei, A. H. Antropow, J. T. Edwards, L. A. D’Agostino, J. M. Ellis, L. G. Hamann, F. Romanov-Michailidis, R. R. Knowles, J. Am. Chem. Soc. 2021, 143, 4055. doi: 10.1021/jacs.1c01173(b) C. G. Zhao, Z. T. Feng, G. Q. Xu, A. Gao, J. W. Chen, Z. Y. Wang, P. F. Xu, Angew. Chem. Int. Ed. 2020, 59, 3058. doi: 10.1002/anie.201912834
(c) N. J. Flodén, A. Trowbridge, D. Willcox, S. M. Walton, Y. Kim, M. J. Gaunt, J. Am. Chem. Soc. 2019, 141, 8426. doi: 10.1021/jacs.9b03372
[2] (a) K. B. Smith, K. M. Logan, W. You, M. K. Brown, Chem. – Eur. J. 2014, 20, 12032. doi: 10.1002/chem.201404310(b) A. L. Lambright, Y. Liu, I. A. Joyner, K. M. Logan, M. K. Brown, Org. Lett. 2021, 23, 612. doi: 10.1021/acs.orglett.0c04208
(c) K. Semba, Y. Nakao, Tetrahedron 2019, 75, 709. doi: 10.1016/j.tet.2018.12.013
[3] L. Nóvoa, L. Trulli, A. Parra, M. Tortosa, Angew. Chem. Int. Ed. 2021, 60, 11763. doi: 10.1002/anie.202101445 [4] L. Novoa, L. Trulli, I. Fernandez, A. Parra, M. Tortosa, Org. Lett. 2021, 23, 7434. doi: 10.1021/acs.orglett.1c02645 [5] F. W. Goetzke, A. M. Hell, L. van Dijk, S. P. Fletcher, Nat. Chem. 2021, 13, 880. doi: 10.1038/s41557-021-00725-y [6] K. M. Logan, M. K. Brown, Angew. Chem. Int. Ed. 2017, 56, 851. doi: 10.1002/anie.201609844 [7] (a) K. B. Smith, K. M. Logan, W. You, M. K. A. Brown, Chem. – Eur. J. 2014, 20, 12032. doi: 10.1002/chem.201404310(b) K. M. Logan, K. B. Smith, M. K. Brown, Angew. Chem. Int. Ed. 2015, 54, 5228. doi: 10.1002/anie.201500396
(c) K. M. Logan, M. K. Brown, Angew. Chem. Int. Ed. 2017, 56, 851. doi: 10.1002/anie.201609844
(d) K. B. Smith, M. K. Brown, J. Am. Chem. Soc. 2017, 139, 7721. doi: 10.1021/jacs.7b04024
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载

















No comments yet.