作者:石油醚
导读
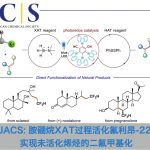
近日,上海有机化学研究所刘文研究员课题组对赛普霉素的骨架形成机制展开了研究。研究结果修正了赛普霉素的化学结构:除了已知的脱氢丁胺酸残基外,该分子还含未被发现的11个D型氨基酸残基,表明赛普霉素是一种长期以来被低估了的高度修饰核糖体肽。研究发现,仅由两个膜蛋白的共同作用,便能催化肽链上的4个苏氨酸脱水、1个半胱氨酸脱硫和11个氨基酸(3个丙氨酸、2个缬氨酸、2个天冬酰胺、2个异亮氨酸、2个脯氨酸)发生差向异构化反应。
“Reconstitution of the Linaridin Pathway Provides Access to the Family-Determining Activity of Two Membrane-Associated Proteins in the Formation of Structurally Underestimated Cypemycin
Yanqing Xue, Xiaofeng Wang, and Wen Liu*
J. Chem. Soc. 2023, ASAPDOI: 10.1021/jacs.3c01730 ”
正文:
核糖体肽是自然界通过翻译后修饰化学创造的一类结构复杂、活性优良的肽类天然产物。许多有广泛应用的抗生素,如乳酸链球菌素和硫链丝菌素,均通过翻译后修饰化学从20种天然氨基酸构成的简单多肽转化而来。上海有机所刘文课题组长期从事富硫细菌环肽的翻译后修饰化学研究,近期对相关肽的主链骨架修饰、氮杂核心环的形成以及非天然氨基酸的引入等酶促反应过程进行了剖析(J. Am. Chem. Soc. 2020, 142, 8454–8463; J. Am. Chem. Soc. 2021, 143, 13790−13797; Cell Chem. Biol. 2021, 28, 675-685; J. Am. Chem. Soc. 2022, 144, 4431-4438)。
赛普霉素是链霉菌产生的一类核糖体肽,具有显著抑制藤黄微球菌和小鼠白血病细胞生长的作用。自发现以来三十余年,人们对该类核糖体肽的翻译后修饰过程知之甚少。基于前期工作基础,刘文课题组对该分子的骨架形成机制展开了研究。研究结果修正了赛普霉素的化学结构:除了已知的脱氢丁胺酸残基外,该分子还含未被发现的11个D型氨基酸残基,表明赛普霉素是一种长期以来被低估了的高度修饰核糖体肽。研究发现,仅由两个膜蛋白的共同作用,便能催化肽链上的4个苏氨酸脱水、1个半胱氨酸脱硫和11个氨基酸(3个丙氨酸、2个缬氨酸、2个天冬酰胺、2个异亮氨酸、2个脯氨酸)发生差向异构化反应。
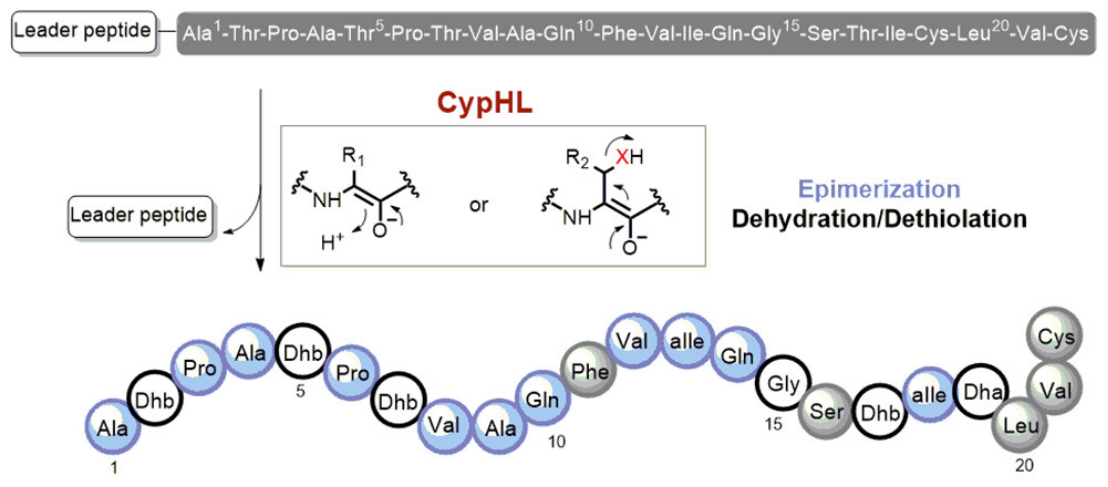
研究证明,上述三种后修饰反应在化学机制上是一致的。脱水反应、脱硫反应和差向异构化反应可以互换,例如将 D 型氨基酸位点突变苏氨酸,后修饰过程中该位点发生了脱水反应;将苏氨酸位点突变为半胱氨酸则发生了脱硫反应。通过同位素标记实验,证明差向异构化反应只断裂Ca-H键,从而支持上述反应经历相同的Ca烯醇化过程。尽管自然界存在多种脱水酶、消旋酶和脱硫酶,但从未发现在多肽水平上由相同化学机制串联起三种反应的酶促机制。该发现为这种高普适性、高底物泛杂性的氨基酸残基翻译后修饰化学提供了有力证据,并为解析该后修饰过程的分子机制打下良好基础。通过前体肽的工程化改造,获得了三十余种赛普霉素类似物,有助于探究赛普霉素的构效关系,以及通过合成生物学方法获得更高产量和更高活性的赛普霉素变体。
该研究成果近期在“Journal of the American Chemical Society”上发表(DOI:10.1021/jacs.3c01730)。该工作得到科技部、国家自然科学基金委相关基金的大力资助。
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载





















No comments yet.