本文作者:杉杉
导读
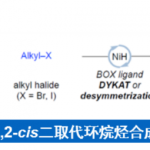
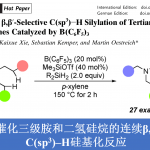
近日,南开大学的周其林课题组在Angew. Chem. Int. Ed.中发表论文,报道一种全新的镍催化1,6-二烯的串联去对称还原环化/偶联反应方法学,进而成功完成一系列具有四级立体中心的手性三级醇分子的构建。这一全新的对映选择性合成转化策略具有广泛的底物应用范围、良好的官能团兼容性以及优良的非对映与对映选择性等优势。同时,反应机理研究表明,反应过程中涉及烷基镍(I)中间体的参与。
Nickel-Catalyzed Desymmetric Reductive Cyclization/Coupling of 1,6-Dienes: An Enantioselective Approach to Chiral TertiaryAlcohol
T. Zhao, L. Xiao, Q. Zhou, Angew. Chem. Int. Ed. 2022, ASAP. Doi:10.1002/anie.202115702.
正文
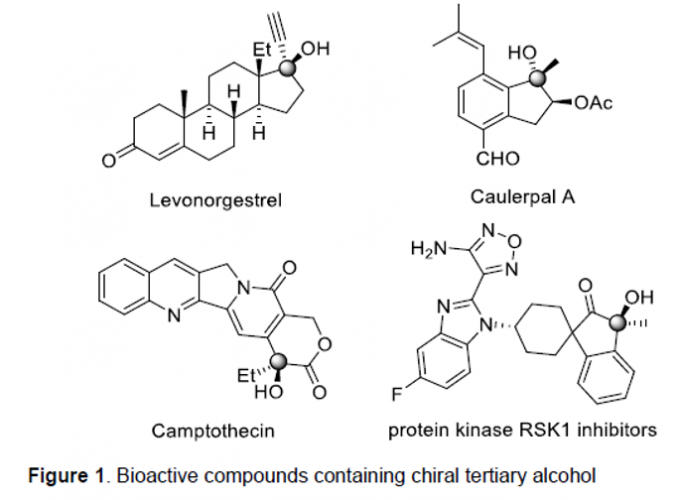
手性三级醇骨架广泛存在于各类天然产物以及生物活性分子中 (Figure 1)。并且,在过去的几十年里,已经成功设计出多种构建手性三级醇分子的合成转化策略[1]-[2]。然而,通过具有三级醇结构单元的非手性前体参与的去对称化反应方法学,目前却较少有相关的研究报道[3]。
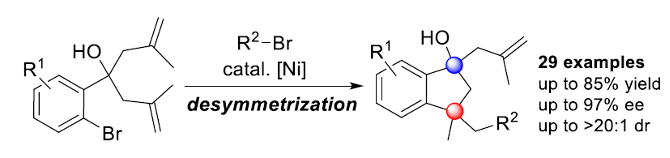
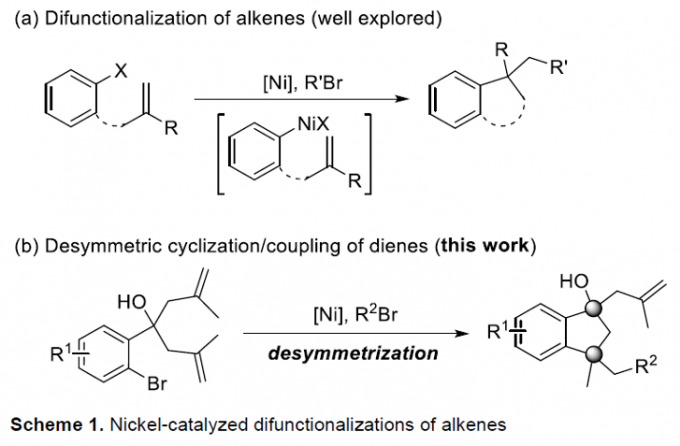
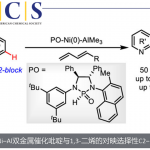
受到近年来对于镍催化烯基化合物的不对称串联环化/偶联反应方法学[4]、氧化还原中性[5]以及还原[6]烯基化合物不对称串联环化/偶联反应方法学相关研究报道的启发,这里,南开大学的周其林课题组报道一种全新的通过镍催化剂促进的1,6-二烯分子去对称还原串联环化/偶联反应方法学,进而顺利完成一系列具有手性四级立体中心的环三级醇分子的构建 (Scheme 1)。
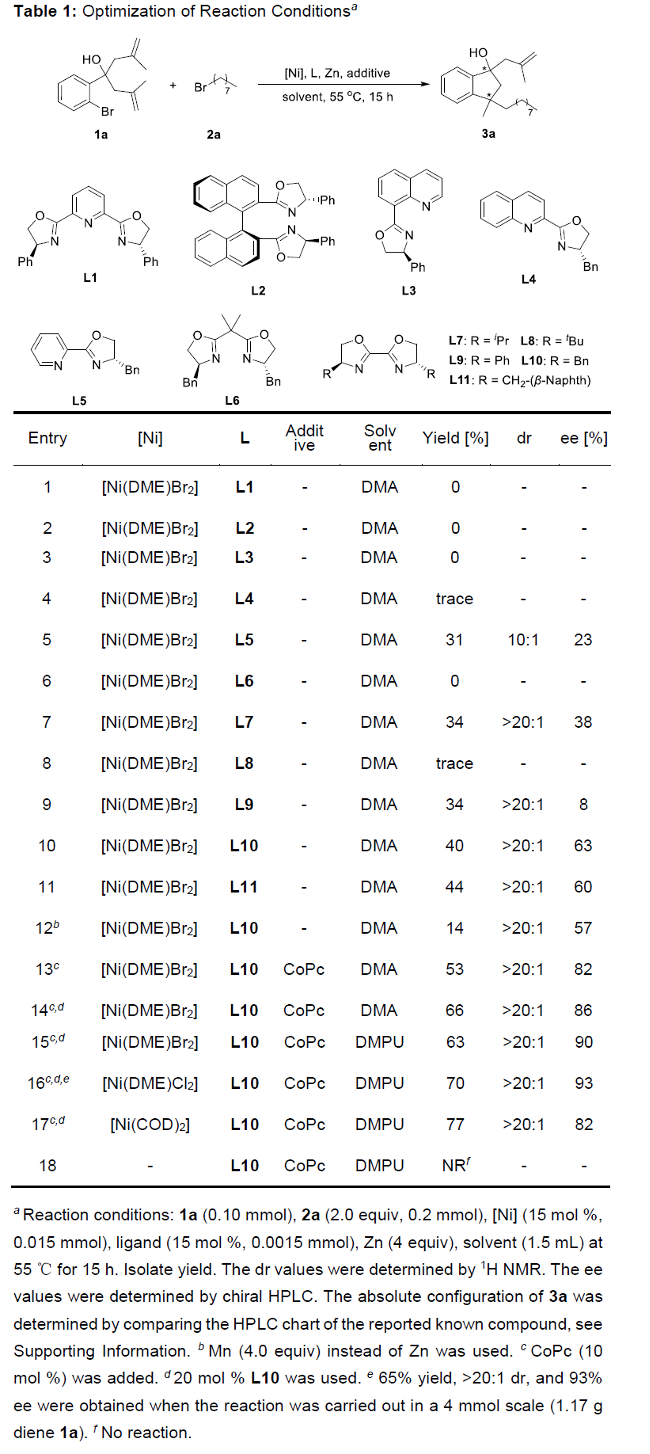
首先,作者采用1,6-二烯1a与正辛基溴2a作为模型底物,进行相关反应条件的优化筛选 (Table 1)。进而确定最佳的反应条件为:采用Ni(DME)Br2作为催化剂,L10作为手性配体,CoPc作为添加剂,Zn粉作为还原剂,在DMPU反应溶剂中,反应温度为55oC,最终获得70%收率的产物3a (>20:1 dr以及93% ee)。
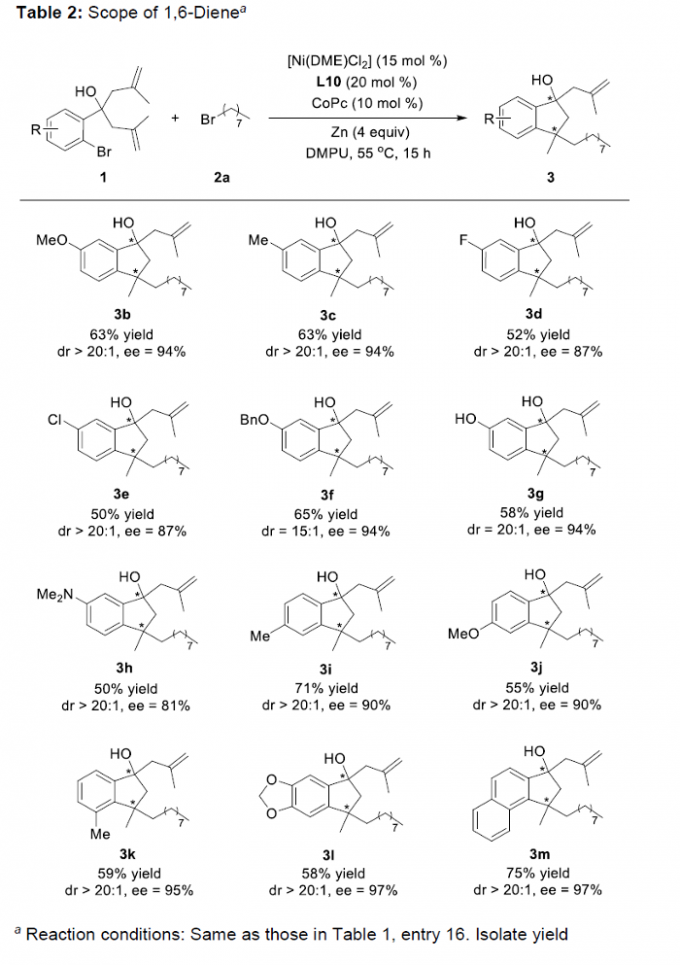
在上述的最佳反应条件下,作者首先对一系列1,6-二烯底物的应用范围进行考察 (Table 2)。研究表明,芳环中带有供电子基团取代的1,6-二烯底物 (3b,3c,(3f,3g,3i,3j,3k,3l),均能够顺利地参与上述的对映选择性环化过程,并以中等至良好的反应收率、高度的非对映选择性(15:1->20:1 dr)以及高度的对映选择性 (90-97% ee),获得相应的手性产物。然而,上述的标准反应条件对于具有二甲氨基取代的二烯底物 (3h),反应收率与对映选择性均出现显著降低。之后,作者进一步发现,上述的标准反应体系,对于带有吸电子基团取代的1,6-二烯底物,则无法获得良好的反应收率以及良好的对映选择性。之后,该小组发现,上述的标准反应体系对于具有α-萘基(3m)取代1,6-二烯底物,同样能够有效地兼容,并获得良好的反应收率、对映与非对映选择性。
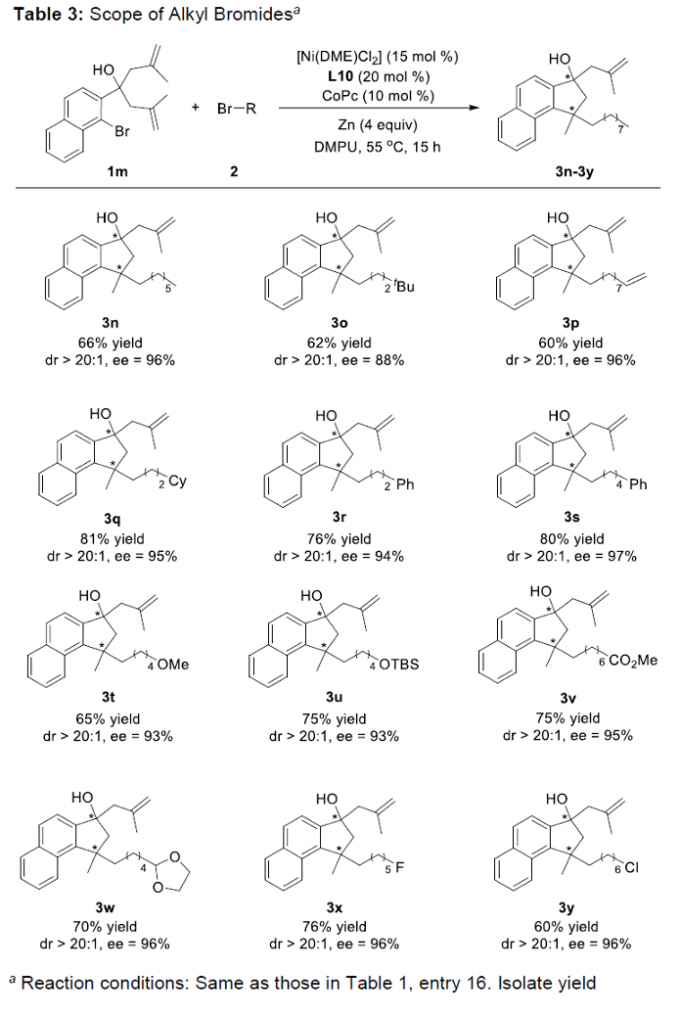
接下来,作者对各类烷基溴底物的应用范围进行考察 (Table 3)。研究表明,一系列烷基溴底物2均能够有效地参与上述的对映选择性环化过程,并获得相应的手性产物3n–3y (60-81% 反应收率,88-97% ee,>20:1 dr)。同时,作者发现,这一全新的去对称还原串联环化/偶联反应方法学能够表现出良好的官能团兼容性。
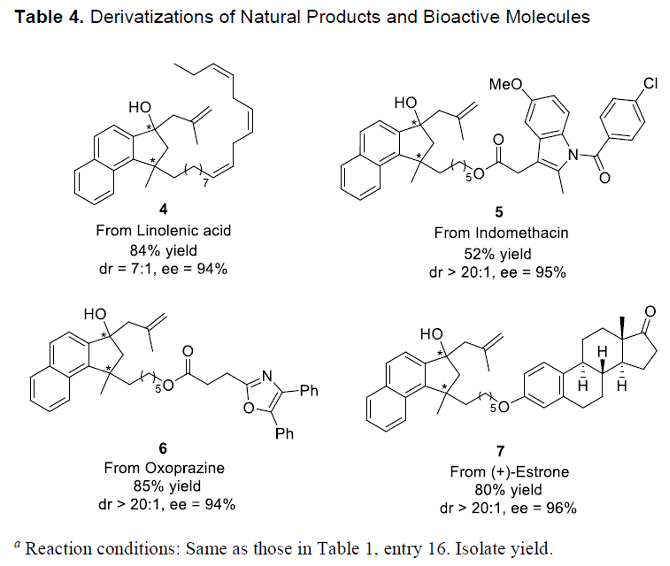
之后,该小组进一步对上述的对映选择性去对称环化/偶联策略的合成应用价值进行深入研究 (Table 4)。
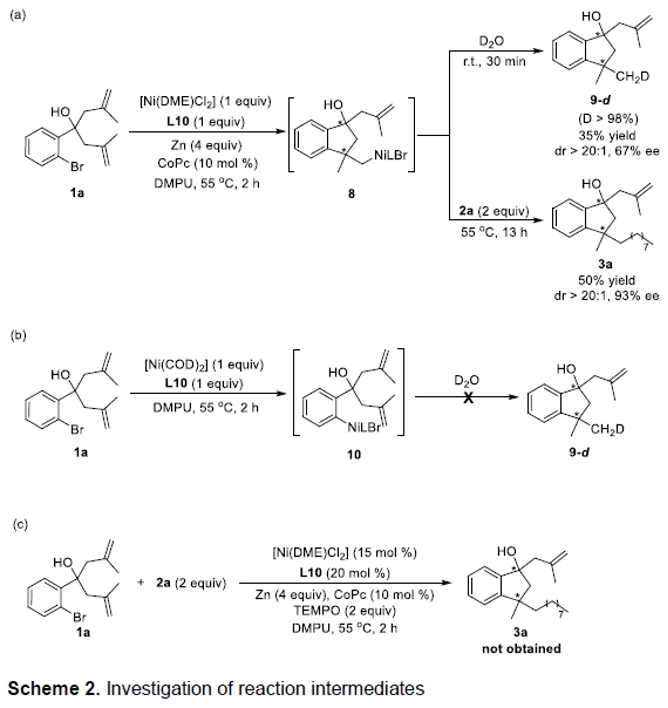
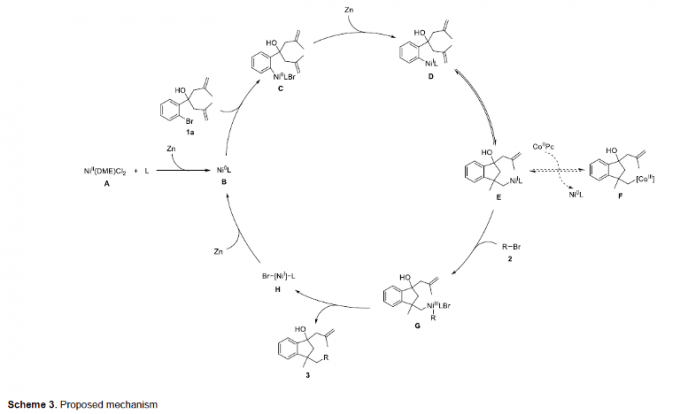
接下来,作者通过一系列化学计量反应实验研究 (Scheme 2)表明,烷基镍配合物8为反应过程中的关键中间体 (Scheme 2a)。同时,在迁移插入烯键之前,锌粉已经将Ni(II)中间体还原,形成相应的Ni(I)中间体 (Scheme 2b)。之后,该小组进一步在1a与2a的标准反应体系中加入自由基捕获剂TEMPO,观察到反应过程受到完全抑制,进而表明上述的去对称环化/偶联反应过程中涉及自由基中间体的参与 (Scheme 2c)。
基于上述的实验研究以及前期相关的文献报道[6],作者提出如下合理的反应机理 (Scheme 3)。
总结
南开大学的周其林课题组报道报道一种全新的镍催化1,6-二烯的串联去对称还原环化/偶联反应方法学,进而成功完成一系列具有四级立体中心的手性三级醇分子的构建。这一全新的对映选择性合成转化策略具有底物范围广泛、优良的官能团兼容性以及优良的非对映与对映选择性等优势。
参考文献
[1] D. J. Ramón, M. Yus, Angew. Chem. Int. Ed. 2004, 43, 284. doi: 10.1002/anie.200301696. [2] C. Li, R. Y. Liu, L. T. Jesikiewicz, Y. Yang, P. Liu, S. L. Buchwald, J. Am. Chem. Soc. 2019, 141, 506. doi: 10.1021/jacs.9b01784. [3] (a) B. Jung, M. S. Hong, S. Kang, Angew. Chem. Int. Ed. 2007, 46, 2616. doi: 10.1002/anie.200604977.(b) M. T. Corbett, J. S. Johnson, Chem. Sci. 2013, 4, 2828. doi: 10.1039/C3SC51022K.
(c) J. L. Olivares-Romero, Z. Li, H. Yamamoto, J. Am. Chem. Soc. 2013, 135, 3411. doi: 10.1021/ja401182a.
(d) H. Fernández-Pérez, J. R. Lao, A. Vidal-Ferran, Org. Lett. 2016, 18, 2836. doi: 10.1021/acs.orglett.6b01088.
(e) C. Wang, R. Zhu, K. Liao, F. Zhou, J. Zhou, Org. Lett. 2020, 22, 1270. doi: 10.1021/acs.orglett.9b04522.
[4] K. E. Poremba, S. E. Dibrell, S. E. Reisman, ACS Catal. 2020, 10, 8237. doi: 10.1021/acscatal.0c01842. [5] Y. Nakao, S. Ebata, A. Yada, T. Hiyama, M. Ikawa, S. Ogoshi, J. Am. Chem. Soc. 2008, 130, 12874. doi: 10.1021/ja805088r. [6] Z. X. Tian, J. B. Qiao, G. L.Xu, X. Pang, L. Qi, W. Y. Ma, Z. Z. Zhao, J. Duan, Y. F. Du, P. Su, X. Y. Liu, X. Z. Shu, J. Am. Chem. Soc. 2019, 141, 7637. doi: 10.1021/jacs.9b03863. [6] L. Ju, Q. Lin, N. J. LiBretto, C. L. Wagner, C. T. Hu, J. T. Miller, T. Diao, J. Am. Chem. Soc. 2021, 143, 14458. doi: 10.1021/jacs.1c07139.本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载
















No comments yet.