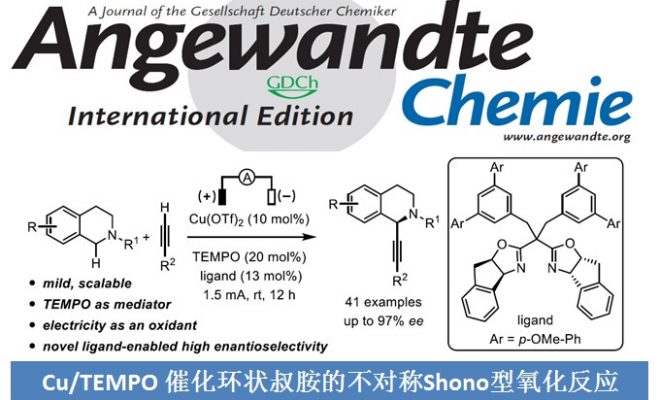
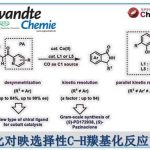
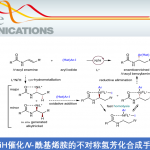
电化学合成比传统的氧化还原方法更环保,因为电化学合成不需要等当量的氧化剂或还原剂。此外,由于能够同时调节电位和电流,所以电化学合成可以有效地用于各种化合物的合成。其中,比较典型的例子是Shono团队[1]报道的电催化氨基甲酸酯在阳极氧化为N-氨基甲酰基亚胺离子再与MeOH反应生成α-甲氧基化产物。同时,合成的N,O-氨基产物在Brønsted酸或Lewis酸条件下可以转化为亚胺离子,该亚胺离子又可与各种亲核试剂反应合成α位为官能团取代的胺化物(Scheme 1a)。而不对称Shono型氧化C-C键偶联反应也是典型的电化学合成反应。早期的不对称Shono型氧化交叉偶联往往需要依赖手性配体,当使用烷基亲核试剂时的立体选择性变化很大。最近,Luo团队[2]报道了烯胺和电化学共同催化的C-H氧化反应,可以良好至优异的非对映选择性和对映选择性得到C1-烷基化四氢异喹啉(Scheme 1b)。中国科学院上海有机化学研究所梅天胜团队则一直致力于过渡金属与电化学协同催化原位选择性C-H功能化反应,并成功报道了过渡金属铜和TEMPO共同催化环状叔胺与末端炔烃的不对称Shono型氧化反应,能以良好至优秀的对映选择性得到一系列C1-烷基化四氢异喹啉(Scheme 1c)。该策略成功克服了前人应用不对称偶联反应合成四氢异喹啉所需氧化剂的问题,为合成手性C1-烷基化四氢异喹啉提供了一种新的有效的合成方法。相关研究成果发表于
“Cu(II)/TEMPO-Catalyzed Enantioselective C(sp3)–H Alkynylation of Tertiary Cyclic Amines via Shono-type Oxidation”
Gao, P.-S.; Weng, X.-J.; Wang, Z.-H.; Zheng, C.; Sun, B.; Chen, Z.-H.; You, S.-L.; Mei, T.-S.* Angew. Chem. Int. Ed. 2020, Early View. DOI: 10.1002/anie.202005099
Scheme 1 背景研究
论文作者介绍
梅天胜研究员
研究经历
- 1997-2001,兰州大学,学士(导师: 李裕林教授)
- 2001-2005,兰州大学,研究生学习(导师:李裕林教授)
- 2005-2007,Brandeis University,硕士(导师:余金权教授)
- 2007-2012,The Scripps Research Institute,博士(导师:余金权教授)
- 2012-2014,Postdoctoral Research Associate,University of Utah(导师:Prof. Matthew S. Sigman)
- 2014-至今,中国科学院上海有机化学研究所金属有机化学国家重点实验室,研究员
获奖及荣誉
- 2009获Best Poster in Chemistry Award-TSRI Symposium
- 2009获Chinese Government Award for Outstanding Self-Financed Students Abroad
- 2013获Travel Award, University of Utah
- 2015获“Shanghai Pujiang Talent Plan”
- 2016获“Thieme Chemistry Journals Award”
研究方向
- 小分子活化,水裂解,甲烷氧化
- 过渡金属催化的高选择性反应研究
- 不对称催化,催化剂设计以及反应机理研究
- 电化学在金属有机化学中的应用
论文概要
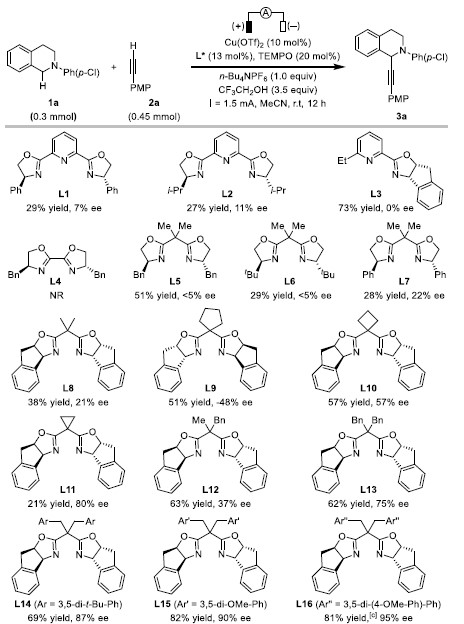
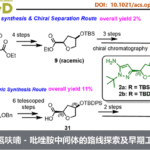
作者以2-(4-氯苯基)-1,2,3,4-四氢异喹啉1a和1-乙炔基-4-甲氧基苯2a为模板底物,通过对催化剂、配体、溶剂以及添加物等反应条件反复筛选,确定最优反应条件(Table 1):10 mol% Cu(OTf)2为催化剂,20 mol% TEMPO为共催化剂,13 mol% L16为手性配体,1.0 equiv n-Bu4NPF6和 3.5 equiv CF3CH2OH为添加物,MeCN为溶剂,在25℃条件下反应12小时,能以82%的收率和95%的对映选择性得到产物3a。
在最优反应条件下,作者对四氢异喹啉的底物范围进行了考察。氮原子上各种苯基取代、烷基和杂环取代的四氢异喹啉能较好地适应反应条件,能以良好的收率和优秀的对映选择性得到相应产物。氮原子上为酯基取代的四氢异喹啉与末端炔烃反应产物的对映选择性较高,但收率却较低。接着,作者考察了末端炔烃的底物范围。各种邻、间、对苯基取代、噻吩、呋喃等杂环取代、含酯基和烯烃等官能团取代以及二茂铁、甲硅烷等特殊取代的末端炔烃均能较好的适应反应条件,能以中等至良好的收率和良好至优秀的对映选择性得到相应产物。但酰基和烷基取代的末端炔烃则不能得到相应产物。
Table 1 条件筛选
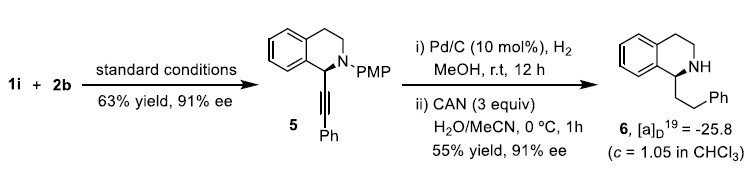
为了证明反应的应用潜力,作者进行了衍生反应(Scheme 2)。在标准反应条件下,1i与2b发生电化学氧化C-H烷基化反应得到化合物5。5再经历氢化反应和对甲基氧化裂解反应能以91%的对映选择性得到广泛存在于生物碱中重要化合物1-芳基乙基取代四氢异喹啉。
Scheme 2 衍生反应
紧接着,作者进行了对照实验,并根据对照实验的结果推测可能的反应机理(Scheme 3):首先,TEMPO在阳极被氧化为氧铵盐(TEMPO+)8。然后,1与8经历氢化物转移过程分别得到亚胺中间体9和TEMPO-H 7。在碱性条件下,Cu(I)和炔烃2反应生成的手性乙炔化合物10与亲电试剂9反应生成产物3或4,其中,活化的Cu(I)是Cu(II)与TEMPO-H在阴极反应生成。
Scheme 2 反应机理
论文总结评价
中国科学院上海有机化学研究所梅天胜团队报道了电化学条件下,过渡金属铜和TEMPO共同催化环状叔胺与末端炔烃的不对称Shono型氧化交叉偶联反应,能以良好至优秀的对映选择性得到一系列C1-烷基化四氢异喹啉,其中反应中使用的配体为新型手性双恶唑啉配体。该策略成功克服了前人应用不对称偶联反应合成四氢异喹啉所需氧化剂的问题,为合成手性C1-烷基化四氢异喹啉提供了一种新的有效的合成方法。
参考文献
- [1] Shono, T.; Hamaguchi, H.; Matsumura, Y. J. Am. Chem. Soc. 1975, 97, 4264-4268. DOI: 10.1021/ja00848a020
- [2] Fu, N.; Li, L.; Yang, Q.; Luo, S. Org. Lett. 2017, 19, 2122-2125. DOI: 10.1021/acs.orglett.7b00746
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!























No comments yet.