导读:
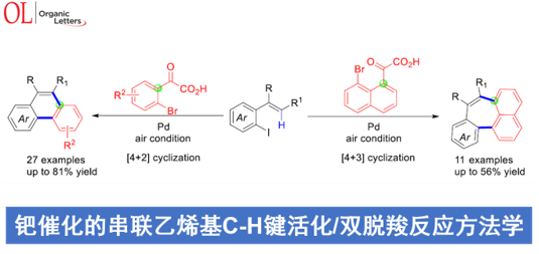
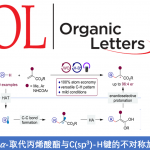
近日,南通大学的戴红与吴新星课题组在Org. Lett.中发表论文,报道一种在钯/空气催化体系存在的条件下,采用α-氧代羧酸作为插入单元,并通过C(vinyl), C(aryl)-环钯中间体进行的[4+2]或[4+3]环化反应方法学。反应过程中涉及乙烯基C-H键活化与双重脱羧的串联过程,并以良好的反应收率与区域选择性,完成一系列菲以及环庚[1,2,3-de]萘分子的构建。同时,该小组通过克级规模实验以及相关功能性材料分子的合成,进一步阐明这一全新的环化反应策略具有潜在的合成应用价值。
Palladium-Catalyzed Sequential Vinyl C-H Activation/Dual Decarboxylation: Regioselective Synthesis of Phenanthrenes and Cyclohepta[1,2,3-de]naphthalenes
G. Jiang, H. Ye, L. Shi, H. Dai, X. Wu, Org. Lett. 2021, ASAP. doi: 10.1021/acs.orglett.1c03517.
正文:
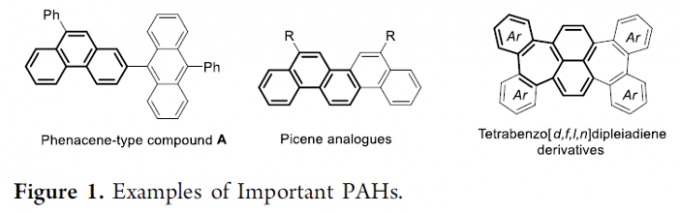
由于分子中扩张π-共轭体系的存在,各类多环芳香化合物能够表现出独特的光学与电化学特性以及良好的稳定性。同时,能够广泛应用于一系列功能性有机材料的研究 (Figure 1)。目前,对于扩张π-共轭体系的构建,有机合成化学家已经成功设计出多种相关的合成转化策略[1]。然而,上述策略中,通常存在需要采用多步的反应过程以及无法获得优良的区域选择性控制等诸多局限。因此,仍然需要设计一系列更为有效的反应策略,进而完成各类多环芳香化合物的区域选择性构建。
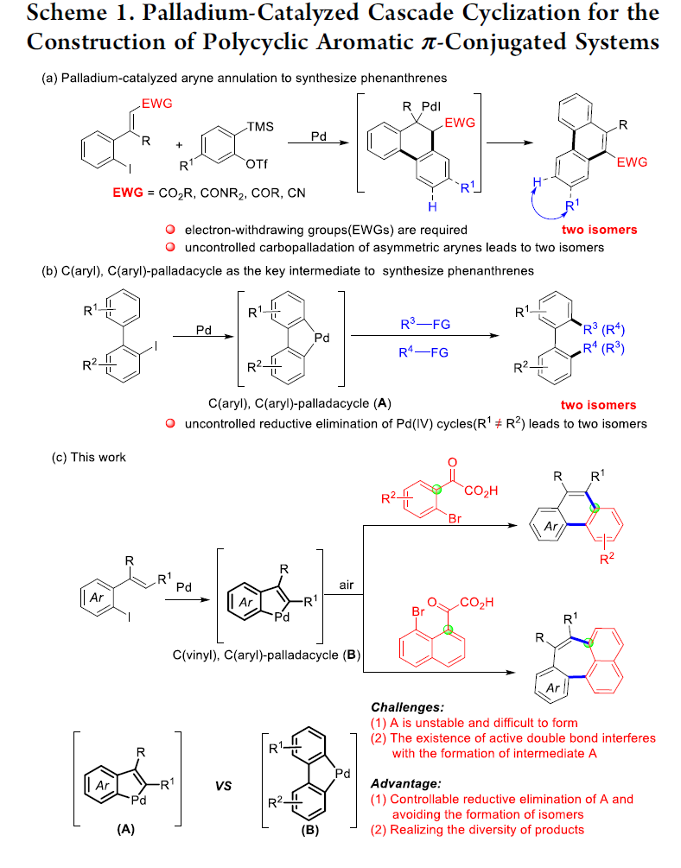
这里,受到通过钯催化剂促进的串联环化反应方法学[2]与近期对于C(aryl),C(aryl)-环钯中间体[3]参与的双重交叉偶联反应方法学[4]-[5]的相关研究以及本课题组前期相关研究报道[6]-[7]的启发,南通大学的戴红与吴新星课题组成功开发出一种的通过乙烯基配位的环钯中间体与α-氧代羧酸之间的区域选择性插入过程进行的π-共轭菲与环庚[1,2,3-de]萘分子构建的全新反应策略 (Scheme 1c)。
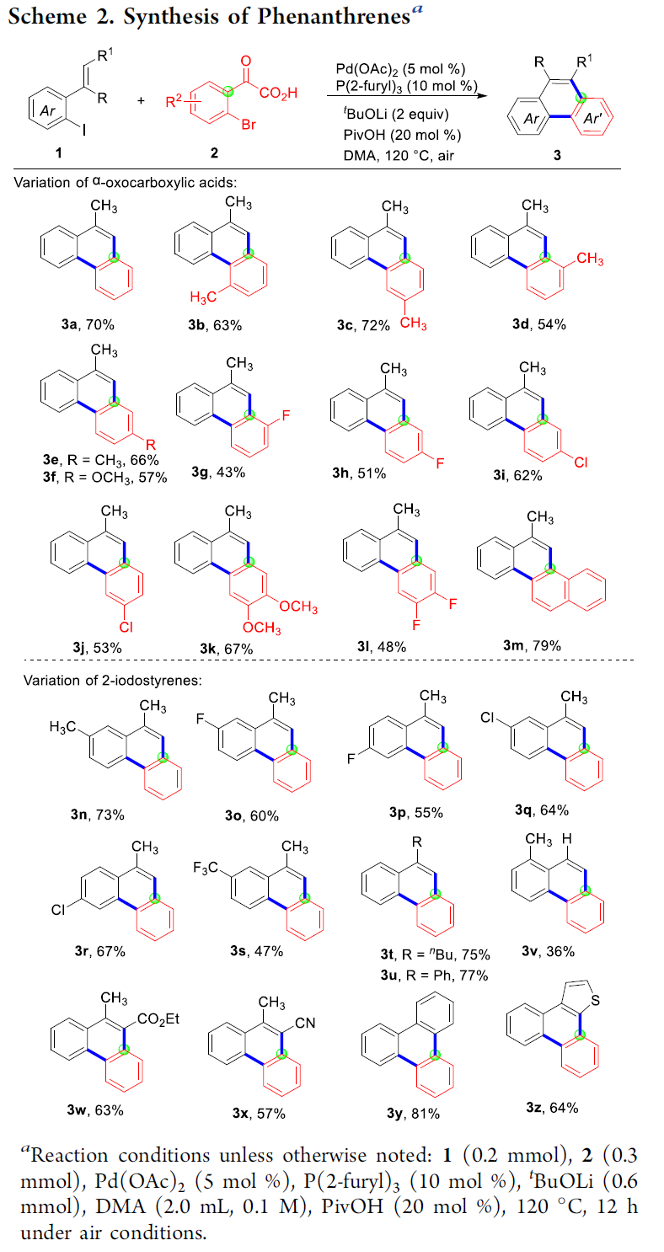
首先,作者采用1a与2a作为模型底物,进行相关反应条件的优化筛选 (Table 1)。进而确定最佳的反应条件为:采用Pd(OAc)2作为催化剂,P(2-furyl)3作为配体,PivOH作为添加剂,tBuOLi作为碱,DMA作为反应溶剂,反应温度为120oC,最终获得70%收率的环化产物3a。
在上述的最佳反应条件下,作者首先对各类α-氧代羧酸底物的应用范围进行考察 (Scheme 2)。研究表明,一系列带有供电子与吸电子基团取代的芳基α-氧代羧酸底物,均能够较好地与上述的标准反应条件兼容,并获得相应的环化产物3a–3j (43-72% 收率)。同时,作者发现,芳基中具有两种不同基团以及萘基团取代的α-氧代羧酸底物,同样能够有效地参与上述的环化过程,并获得相应的目标产物3k–3m (48-79% 收率)。之后,作者进一步对一系列2-碘苯乙烯底物的应用范围进行深入研究。该小组发现,芳基中具有一系列供电子与吸电子基团取代的2-碘苯乙烯底物,均能够顺利地参与上述的环化过程,并获得相应的菲类产物3n–3s (47-73% 收率)。而对于烯基末端位置无取代基、存在一种以及两种不同基团取代的2-碘苯乙烯底物,同样能够良好地兼容,并获得相应的环化产物3t–3x (36-77% 收率)。接下来,作者进一步发现,上述的标准反应体系对于2-碘联苯底物,则表现出更高的反应活性,并以良好的反应收率,获得预期的环化产物3y。同时,作者发现,上述的环化策略同样能够有效地应用于具有噻吩环稠合的菲类化合物3z的合成。
接下来,作者对底物2′与各类2-碘苯乙烯底物1之间的关环反应进行进一步研究 (Scheme 3)。作者发现,在上述的标准反应条件下,通过底物2′与1之间的关环过程,能够成功获得一系列相应的环庚[1,2,3-de]萘产物4a–4k (26-56%收率)。
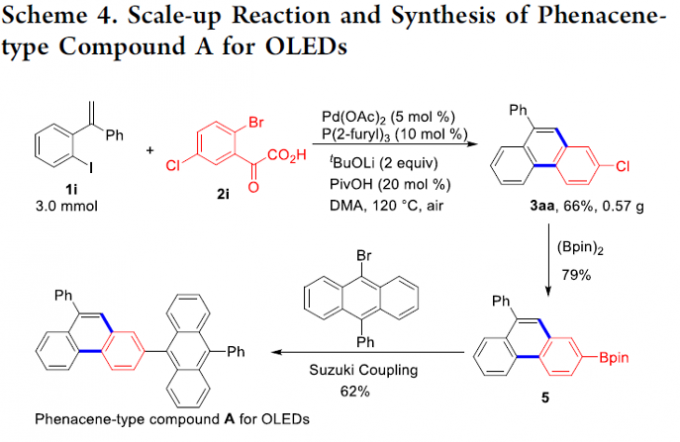
之后,作者对这一全新的环化策略的合成实用性进行研究 (Scheme 4)。该小组发现,这一全新的环化策略同样能够完成实现相应的克级规模反应。同时,研究表明,通过上述环化过程获得的3aa产物能够进一步转化为相应的phenacene型化合物A。
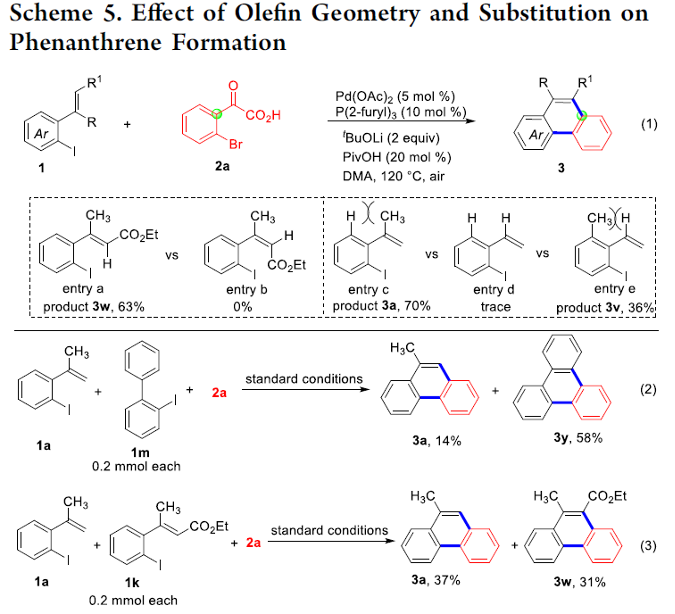
接下来,为提出合理的反应机理,作者进行一系列相关的实验研究 (Scheme 5)。首先,研究发现,(E)-三取代烯基化合物在上述的标准反应体系中,能够成功转化为相应的菲类产物3w;然而,采用(Z)-三取代烯基化合物却无法获得预期的环化产物 (Scheme 5, entry a vs entry b)。上述事实表明,在菲类产物的形成过程中,涉及通过分子内乙烯基C-H键活化步骤形成的C(vinyl), C(aryl)-环钯中间体的参与。同时,研究表明,烯基取代基的存在,对于上述的环化过程的顺利进行同样十分关键。例如,在去除α-甲基苯乙烯底物中的甲基取代基时,能够观察到目标产物收率的显著降低 (Scheme 5, entry c vs entry d)。然而,作者进一步发现,将甲基引入至乙烯基的邻位时,同样能获得36%收率的菲产物 (Scheme 5, entry d vs entry e)。通过上述的实验观察进一步表明,乙烯基与苯基之间立体位阻的存在,有利于相应环化过程的进行。之后,该小组发现,在上述的标准反应条件下,加入相同当量的1a、1m与2a进行反应 (Scheme 5, eq 2)时,能够分别获得相应的环化产物3a (14% 收率)与3y (58% 收率)。通过这一实验观察表明,与C(aryl),C(aryl)-环钯相比,C(vinyl), C(aryl)-环钯中间体具有更低的反应活性。并且,研究发现,在加入相同当量的1a、1k与2a进行反应时,则分别获得相应的关环产物3a (37% 收率)以及3w (31% 收率),进而表明,烯基化合物中取代基的电子效应对环化反应过程无显著影响。
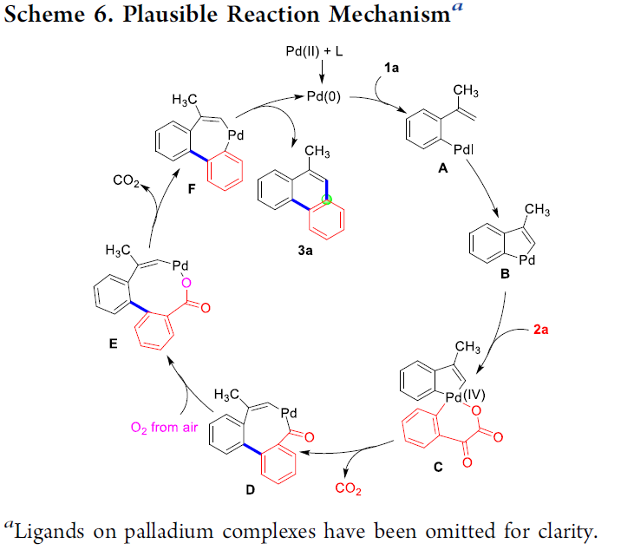
基于上述研究,作者提出如下合理的反应机理 (Scheme 6)。
总结:南通大学的戴红与吴新星课题组报道一种全新的通过2-碘苯乙烯与α-氧代羧酸之间的串联乙烯基C-H键活化/双重脱羧反应策略,进而成功完成一系列菲以及环庚[1,2,3-de]萘分子的构建。这一全新的环化策略具有底物应用范围广泛、良好的官能团兼容性以及优良的区域选择性等优势。
参考文献:
[1] (a) J. Vollbrecht, H. Bock, C. Wiebeler, S. Schumacher, H. Kitzerow, Chem. – Eur. J. 2014, 20, 12026. doi: 10.1002/chem.201403287.(b) N. Chang, X. Chen, H. Nonobe, Y. Okuda, H. Mori, K. Nakajima, Y. Nishihara, Org. Lett. 2013, 15, 3558. doi: 10.1021/ol401375n.
[2] (a) S. A. Worlikar, R. C. Larock, Org. Lett. 2009, 11, 2413. doi: 10.1021/ol900554r.(b) T. Yao, H. Zhang, Y. Zhao, Org. Lett. 2016, 18, 2532. doi: 10.1021/acs.orglett.6b00558.
(c) M. Iwasaki, Y. Araki, S. Iino, Y. Nishihara, J. Org. Chem. 2015, 80, 9247. doi: 10.1021/acs.joc.5b01693.
(d) K. Ozaki, H. Zhang, H. Ito, A. Lei, K. Itami, Chem. Sci. 2013, 4, 3416. doi: 10.1039/C3SC51447A.
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载























No comments yet.